实时荧光RT-PCR鉴别检测美洲型PRRSV及其变异株*
2011-03-07罗宝正王连想薄清如王爱民徐海聂黄好兴
罗宝正,王连想,薄清如,王爱民,徐海聂,黄好兴
(1.珠海出入境检验检疫局国家外来病检测重点实验室,广东珠海519015;2.广东温氏食品集团有限公司,广东新兴527300;3.珠海市农业局,广东珠海519000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS),俗称“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的高度传染性免疫抑制疾病,以成年猪早产、流产和死胎,以及仔猪呼吸异常为特征,常常继发其他病原感染[1]。自1987年美国报道以来,该病已逐渐成为困扰世界各国养猪业的重要疾病,给养猪生产造成了重大经济损失,也是集约化养猪生产中猪病控制的重点和难点[2]。我国1996年首次报道PRRS,关于该病发生、流行以及研究的报告日趋增多[3-5]。PRRSV分为美洲型和欧洲型,截止目前我国尚未发现由欧洲型毒株感染引起的猪蓝耳病。2006年5月份以来,在我国多个省份暴发流行并造成仔猪大量死亡的猪“高热病”疫情,经过流行病学调查、病原分离鉴定、动物试验等科技攻关,证实了其病原为美洲型PRRSV变异株(NSP2 1594~1680缺失)[6]。目前,该变异毒株已广泛存在于我国多个省份。
传统的PRRS诊断方法有病毒分离、ELISA、免疫过氧化酶单层试验、间接荧光试验、血清中和试验等,然而传统诊断方法无法区分PRRSV和PRRSV变异株,因而急需研究出快速、灵敏、便捷的实验室诊断方法。荧光RT-PCR作为一种新型核酸检测技术比普通RT-PCR具有更多优势。本研究拟建立美洲型PRRSV通用实时荧光RT-PCR及其变异株(NSP2 1594~1680缺失)实时荧光RT-PCR检测方法,期望为科学监测和综合防控PRRS提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 病毒 美洲型PRRSV Ch-1a株为PRRSV弱毒疫苗株,上海海利生物药品有限公司;ATCC VR-2332株为PRRSV弱毒疫苗株,勃林格殷格翰动物保健(美国)有限公司。
美洲型PRRSV变异株(NSP2 1594~1680缺失):GDBY-3株为第3代细胞分离变异株(NSP2 1594~1680缺失),广东省动物防疫监督总所分离鉴定保存;JX-A1株为PRRSV灭活疫苗株,广东省肇庆大华农生物技术有限公司。
猪瘟病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、日本脑炎病毒、猪伪狂犬病病毒、猪圆环病毒2型均为细胞毒,由珠海出入境检验检疫局保存。
1.2 方法
1.2.1 TCID50测定 GDBY-3株为第3代细胞分离株,其TCID50测定按Reed Muench法进行。
1.2.2 RNA的提取 病毒、样品总RNA提取用Mrcgene公司的T rizol Reagent Kit,按其说明书进行。用20 μ L DEPC H2O溶解提取的RNA。取2 μ L用于RT-PCR反应。
1.2.3 引物、探针的设计与合成 从GenBank中获取多个美洲型PRRSV M基因序列和病毒变异株(NSP2 1594~1680缺失株)NSP2区域基因序列,用CLUSTAL X进行序列分析,找到保守片段用Primer Express 2.0进行特异性引物、探针设计。引物和探针均在上海英骏生物技术有限公司合成。探针5′端标记发光基团FAM,3′端标记泯灭基团TAMRA。PRRSV特异性引物和探针:上游引物5′-GAT TGCGGCAAATGATAACCA-3′;下游引物5′-AACCCGGGCACCAATGT-3′;Taqman探针FAM-ATT TGTCGTCCGGCGTCCCG-TAMRA。PRRSV变异株引物和探针:上游引物5′-CAGGATGAGCCTCTGGATT TG-3′;下游引物5′-CCTCCAGGATGCCCAT GTT-3′;Taqman探针FAM-CGGAATATGAGGCT TTCCCCCTAGCATAMRA。其中,针对M基因的引物、探针用于建立美洲型PRRSV通用实时荧光RT-PCR检测方法,针对NSP2基因的引物探针用于建立PRRSV变异株(NSP2 1594~1680缺失株)实时荧光RTPCR检测方法。
1.2.4 RT-PCR产物的克隆、测序 使用TAKARA公司一步法RT-PCR试剂盒进行扩增,每条引物终浓度为0.2 mmol/L。反应条件为50℃逆转录30 min;94℃预变性2 min;然后94℃10 s,58℃30 s,72℃30 s,40个循环;最后72℃7 min延伸。取RT-PCR产物5 μ L在15 g/L的琼脂糖凝胶上电泳,凝胶成像系统观察并保存结果。将扩增到的目的基因片段采用T-A克隆方案克隆至pMD18-T载体。使用QIAGEN公司的质粒DNA抽提纯化试剂盒抽提重组质粒(按照说明书进行),送广州英骏生物公司测序。
1.2.5 实时荧光RT-PCR检测 对两套引物、探针配制的反应体系进行实时荧光RT-PCR,反应条件均为42℃30 min;92℃2 min;然后92℃10 s,55℃30 s,40个循环;反应在Lightcycler实时荧光PCR仪上进行。每条引物终浓度为0.4 mmol/L,探针浓度为0.2 mmol/L。反应体系使用深圳匹基公司的颗粒酶和珠海科登生物技术有限公司的TaqDNA聚合酶配制,每个反应使用1/4颗粒酶和2 U TaqDNA聚合酶。加入DEPC H2O将每个反应体系补足到25 μ L。
1.2.6 特异性检测 提取PRRSV弱毒疫苗株(Ch-1a株、ATCC VR-2332株)和变异PRRSV毒株(GDBY-3株、JX-A1株)、猪瘟病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、日本脑炎病毒等病毒RNA,提取猪伪狂犬病毒和猪圆环病毒2型基因组DNA,用上述实时荧光RT-PCR进行检测,验证其特异性。
1.2.7 敏感性检测 对GDBY-3分离株进行10倍倍比稀释,每个稀释度200 μ L提取病毒RNA为模板,配制反应体系在实时荧光PCR仪上检测进行敏感性试验,检测到的最低浓度作为该方法的灵敏度。
1.2.8 临床可疑样品检测 建立的两种实时荧光RT-PCR检测方法对24份临床可疑样品进行检测,包括猪肺、淋巴结、组织样品和血液。同时用病毒分离方法进行检测。
2 结果
2.1 RT-PCR反应及克隆测序
根据引物的设定,PRRSV RT-PCR产物预期大小为81 bp,PRRSV变异株RT-PCR产物91 bp。RT-PCR产物测序结果在GenBank中进行比对,与目的片段序列基本一致。
2.2 实时荧光RT-PCR反应的建立
2.2.1 特异性试验 利用设计的两套引物、探针配制反应体系,提取PRRSV弱毒疫苗株(Ch-1a株、ATCC VR-2332株)和PRRSV变异株(GDBY-3株、JXA1株)RNA进行检测,经过40个循环后,PRRSV实时荧光RT-PCR方法对以上4个病毒株的检测都呈阳性,PRSSV变异株实时荧光RT-PCR方法只对变异株PRRSV毒株(GDBY-3株、JX-A1株)检测阳性,PRRSV弱毒疫苗株(Ch-1a株、ATCC VR-2332株)检测都是阴性,因此可以有效区分PRRSV与PRRSV变异株(NSP2 1594~1680缺失)。猪瘟病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、日本脑炎病毒、猪伪狂犬病病毒、猪圆环病毒2型和空白对照都无实时荧光值增长。显示该检测方法具有良好的特异性,能特异性的检测PRRSV及其变异株(NSP2 1594~1680缺失)(图1和图2)。
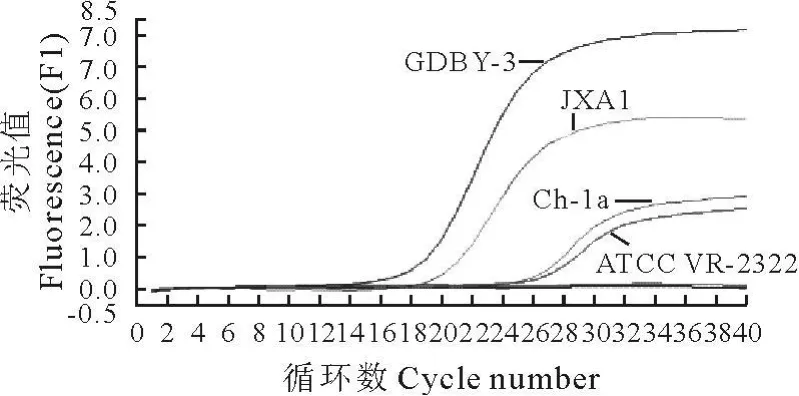
图1 PRRSV实时荧光RT-PCR检测方法特异性扩增曲线Fig.1 Real-time PCR amplification curve of specificity for PRRSV

图2 PRRSV变异株实时荧光RT-PCR检测方法特异性 扩增曲线 Fig.2 Real-time PCR amplification curve of specificity for variant PRRSV
2.2.2 灵敏性试验 GDBY-3株毒价经测定为103.67TCID50/0.2 mL,两种实时荧光RT-PCR检测方法都能检测到104倍稀释的病毒培养液,相当于0.47个TCID50,105倍之后的病毒稀释液检测全部阴性(图3和图4)。
2.3 临床可疑样品检测及与病毒分离方法的比较
对24个临床可疑样品进行病毒分离,分离到21株PRRSV,经NSP2序列测定均为PRSSV变异株(NSP2 1594~1680缺失)。本研究建立的方法均检测到21份阳性,与病毒分离方法检测结果一致(图5和图6)。

图3 PRRSV实时荧光RT-PCR检测方法灵敏度扩增曲线图Fig.3 Sensitivity amplification curve of PRRSV real-time RT-PCR

图4 PRRSV变异株实时荧光RT-PCR检测方法灵敏度 扩增曲线图 Fig.4 Sensitivity amplification curve of PRRSV variant strain real-time RT-PCR

图5 PRRSV实时荧光RT-PCR临床样品扩增曲线Fig.5 Clinical sample amplification curve of PRRSV real-time RT-PCR

图6 PRRSV变异株实时荧光RT-PCR临床样品 扩增曲线 Fig.6 Clinical sample amplification curve of PRRSV variant strain real-time RT-PCR
3 讨论
我国于1996年首次分离到PRRSV,现已发现此病在国内流行广泛,并且都为美洲型PRRSV引起。国内外均有关于PRRSV NSP2氨基酸缺失的报道[7-8],但出现两个不连续位点缺失30个氨基酸的毒株,且在全国范围内广泛流行并造成重大损失的高致病性PRRSV,2006年在我国属于首次发现。PRRSV的NSP2是各毒株间差异较大的一个编码区,具有种特异性,美洲型和欧洲型PRRSV的氨基酸序列同源性只有32%,NSP2与PRRSV对细胞或组织的嗜性有关,在遗传关系很近的毒株间也可有较大差异。NSP2基因序列的缺失是2006年我国暴发所谓“高热病”以来猪场PRRSV分离株的一个显著特征,且不同省市猪场流行的PRRSV相互之间高度同源,这些基因的缺失和结构蛋白基因序列的突变,可能与毒力的改变具有非常重要的相关性[9]。
郝晓芳等[10]曾建立了高致病性PRRSV RTPCR鉴定技术。然而,该方法的灵敏度方面与实时荧光RT-PCR技术比较有明显的差距。范忠军等[11]建立了针对PRRSV实时荧光RT-PCR检测技术,并具有良好的效果,其主要是针对PRRSV基因组中保守的M蛋白基因,而M蛋白基因具有很强的群特异性,可以作为群特异性检测的靶基因,无法区分传统型PRRSV和PRRSV变异株。罗长保等[12]建立PRRSV变异株实时荧光RT-PCR检测技术,其检测的区域是NSP2基因,虽然国内暂时分离到的PRRSV变异株(NSP2 1594~1680缺失)在NSP2同源性较高,但NSP2毕竟具有高突变性,不断出现的新毒株容易在NSP2发生突变,而造成漏检。本研究建立了同时针对PRRSV M基因和NSP2基因的实时荧光RT-PCR方法,其中针对NSP2基因的诊断方法可区分美洲型PRRSV和PRRSV变异株(NSP2 1594-1680缺失),针对保守的M基因的引物设计策略,还可有效防止因NSP2区突变而造成的漏检。
[1] Cho J G,Dee S A.Porcine reproductive and respiratory syndrome virus[J].T heriogenology,2006,66(3):655-662.
[2] Keffaber K K.Reproductive failure of unknown etiology[J].Am Assoc Swine Pract Newslett,1989(2):1-9.
[3] 任向阳,王川庆,陈 陆,等.猪繁殖与呼吸综合征病毒地方株的分离与鉴定[J].动物医学进展,2007,28(3):16-19.
[4] 黄伟坚,卢桂娟,陈 樱,等.南方三省猪繁殖与呼吸综合征病毒分子流行病学调查研究[J].中国预防兽医学报,2007,29(2):150-154.
[5] 仇华吉,郭宝清,童光志,等.猪繁殖与呼吸道综合征病毒(P RRSV)CH-1a株基因型鉴定[J].中国兽医学报,1998,18(2):118-120.
[6] Tian K G,Yu X L,Zhao T Z,et al.Emergence of fatal P RRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[7] Nielsen H S,Oleksiewicz M B,Forsberg R,et al.Reversion of a live porcine reproductive and respiratory syndrome vaccine investigated by parallel mutations[J].J Gen Virol,2001,82:1263-1272.
[8] 严 安.猪繁殖与呼吸综合征病毒NSP2基因和ORF5基因变异分析[D].北京:中国农业大学,2004.
[9] 郝晓芳,周艳君,田志军,等.高致病性猪繁殖与呼吸障碍综合征病毒RT-PCR鉴别诊断方法的建立[J].中国预防兽医学报,2007,29(9):704-709.
[10] 范忠军,柴 虹,陈继明,等.美洲型猪繁殖与呼吸综合征病毒荧光RT-PCR检测方法的建立[J].中国预防兽医学报,2007,29(2):134-137.
[11] 罗长保,肖性龙,鱼海琼,等.应用荧光RT-PCR技术检测高致病性猪蓝耳病病毒[J].中国兽医杂志,2008,44(1):85-86.
[12] 童光志,周艳君,都晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,25(9):323-327.
