植物亚细胞定位载体卡盒pCEG的构建及验证
2011-03-07朱延明
朱 丹,王 希,朱延明,陈 超,李 勇,柏 锡,才 华,纪 巍
(东北农业大学生命科学学院,哈尔滨 150030)
在基因的功能研究过程中,外源重组基因表达产物的功能与其在宿主细胞中的定位有重要的关系,特别是对于真核细胞,蛋白质位于不同的细胞部位所行使的功能也不同,所以研究其在宿主细胞中的亚细胞定位,对研究外源重组基因表达产物的功能或未知新基因的功能来说具有很重要的意义。目前被广泛应用的能进行亚细胞定位的报告基因主要是绿色荧光蛋白(Green fluorescent protein,GFP)。绿色荧光蛋白是细胞生物学和分子生物学研究中的一个重要的工具,绿色荧光蛋白相对分子质量很小,能与多种不同的蛋白质N端或C端融合而保持其天然蛋白的特性,因此是一种直观性很强的遗传标记物[1-3]。通过与某单一序列的融合,可特异地进行细胞核、线粒体、质体、内质网等细胞器的定位。由于GFP基因其产物可以自身发光,不需要任何底物和辅助因子参与就能检测其活性,所以用GFP进行亚细胞定位,避免了提纯蛋白、标记异硫氰酸荧光素等荧光染料、经显微注射或其他方式导入细胞的复杂方法,从而使研究蛋白在活细胞的准确定位变得简单易行[4-6]。但在研究基因在植物细胞中的定位时,必须构建与基因融合的GFP亚细胞定位载体,常常会因酶切位点的难以选择使得构建周期长,操作复杂,如果能构建出具有多个可用酶切位点的植物表达载体卡盒,将大大缩短载体构建周期,节省大量人力物力[7-8]。
本研究通过酶切连接手段消除pCAMBIA-1302载体本身的多克隆位点(Multip cloning site,MCS),同时通过高保真PCR扩增克隆了原核表达载体pET-32b的多克隆位点,并将此多克隆位点插入已消除本身多克隆位点的载体pCAMBIA-1302的GFP基因序列前,构建成植物GFP亚细胞定位载体卡盒pCEG;通过农杆菌介导的转化方法,将此载体卡盒pCEG于烟草叶片中进行瞬时表达,用激光共聚焦显微镜观察GFP蛋白的亚细胞定位情况,发现GFP蛋白在细胞质和细胞核都有表达,证明此载体卡盒可用于植物基因的亚细胞定位分析;本研究所构建的载体卡盒为目的基因的植物亚细胞定位载体的构建带来了很大的便利,也为目的基因在宿主细胞中的亚细胞定位研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌菌株DH5α,根癌农杆菌菌株EHA105。
植物GFP亚细胞定位载体pCAMBIA-1302,植物表达载体pEbTIP,原核表达载体pET-32b均由东北农业大学植物生物工程研究室保存;中间表达载体pCEbT和植物GFP亚细胞定位载体卡盒pCEG由本研究室构建;测序载体pGEM-T购自Promega公司。质粒图谱见结果与分析。
1.1.2 常用试剂及酶类
LA TaqDNA聚合酶、T4DNA连接酶、限制性内切酶及DNA胶回收试剂盒均购自大连宝(TaKaRa)生物工程公司。卡那霉素、氨苄青霉素等其他试剂均为进口或国产分析纯。引物合成、DNA测序由上海生物工程公司完成。
1.1.3 植物材料
烟草品种为本氏烟。
1.2 方法
1.2.1 质粒DNA提取、电泳、酶切、大肠杆菌及农杆菌感受态制备、转化、菌落PCR
均采用常规分子生物学操作技术,具体操作步骤参照文献[9]。
1.2.2 琼脂糖凝胶中DNA片段的回收
按照试剂盒操作说明进行。
1.2.3 连接反应方法
具体操作步骤参照文献[10]。
1.2.4 引物设计
根据原核表达载体pET-32b上MCS区附近的序列,应用Primer Premier 5.0软件分析其内部酶切位点,设计一对MCS的克隆引物,为方便后续载体构建,上游引物端从NcoⅠ位点开始设计,并在下游端加入了BglⅡ位点。最终确定引物序列如下:
根据载体pCEG上新插入的MCS上游区的碱基序列,应用Primer Premier 5.0软件设计了一条引物用于载体卡盒pCEG中新插入的MCS的测序,其引物序列如下:
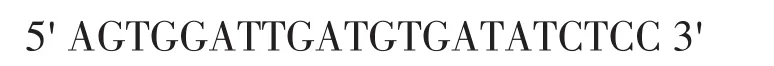
1.2.5 农杆菌介导的亚细胞定位载体卡盒pCEG对烟草的转化
将质粒pCEG转入农杆菌EHA105,通过PCR鉴定阳性转化子,将转入质粒pCEG的农杆菌注射培养4周大小的烟草叶片。
1.2.6 GFP亚细胞定位观察
取侵染后3 d的烟草叶片,在激光共聚焦显微镜488 nm检测波长下,观察GFP蛋白的表达情况以及亚细胞定位情况。
2 结果与分析
2.1 植物GFP亚细胞定位载体pCAMBIA-1302中MCS的消除
用Eco RⅠ和PstⅠ双酶切质粒pCAMBIA-1302,消除其多酶切位点(MCS),同样用Eco RⅠ和PstⅠ双酶切质粒pEbTIP并回收切下的大小约280bp不含有常用酶切位点的基因片段作为小接头,与切成线性的pCAMBIA-1302连接,构建成中间表达载体,命名为pCEbT。将pCEbT转化大肠杆菌DH5α,在含有Km的LB培养基平板上筛选转化菌落,提取转化子质粒,并用SalⅠ和BglⅡ进行双酶切鉴定,酶切电泳图结果显示不能切下约700bp大小的条带,证明SalⅠ酶切位点已被消除,即证明质粒pCAMBIA-1302中的MCS已被消除(见图1)。
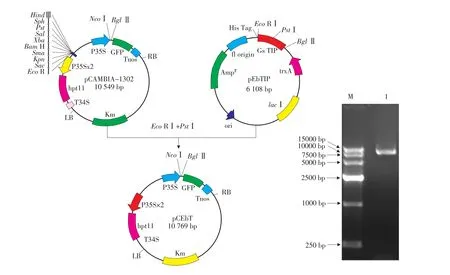
图1 重组质粒pCEbT的构建及酶切鉴定Fig.1 Construction and characterization with endonucleases of recombination plasmid pCEbT
2.2 原核表达载体pET-32b MCS的获得
分析原核表达载体pET-32b上MCS区附近的序列及其内部酶切位点,设计一对MCS的克隆引物,并在上游引物端加入NcoⅠ酶切位点,在下游端加入BglⅡ酶切位点。
以原核表达载体pET-32b为模板,采用设计的引物进行高保真PCR扩增,扩增出约100bp的特异带,即pET-32b的MCS,其碱基序列及所含的酶切位点如图2所示。将得到的DNA片段与pGEM-T连接,转化大肠杆菌DH5α,在含有Amp的LB培养基平板上筛选转化菌落,将鉴定正确的阳性克隆菌落送交测序,测序结果正确。
2.3 植物GFP亚细胞定位载体卡盒pCEG的构建
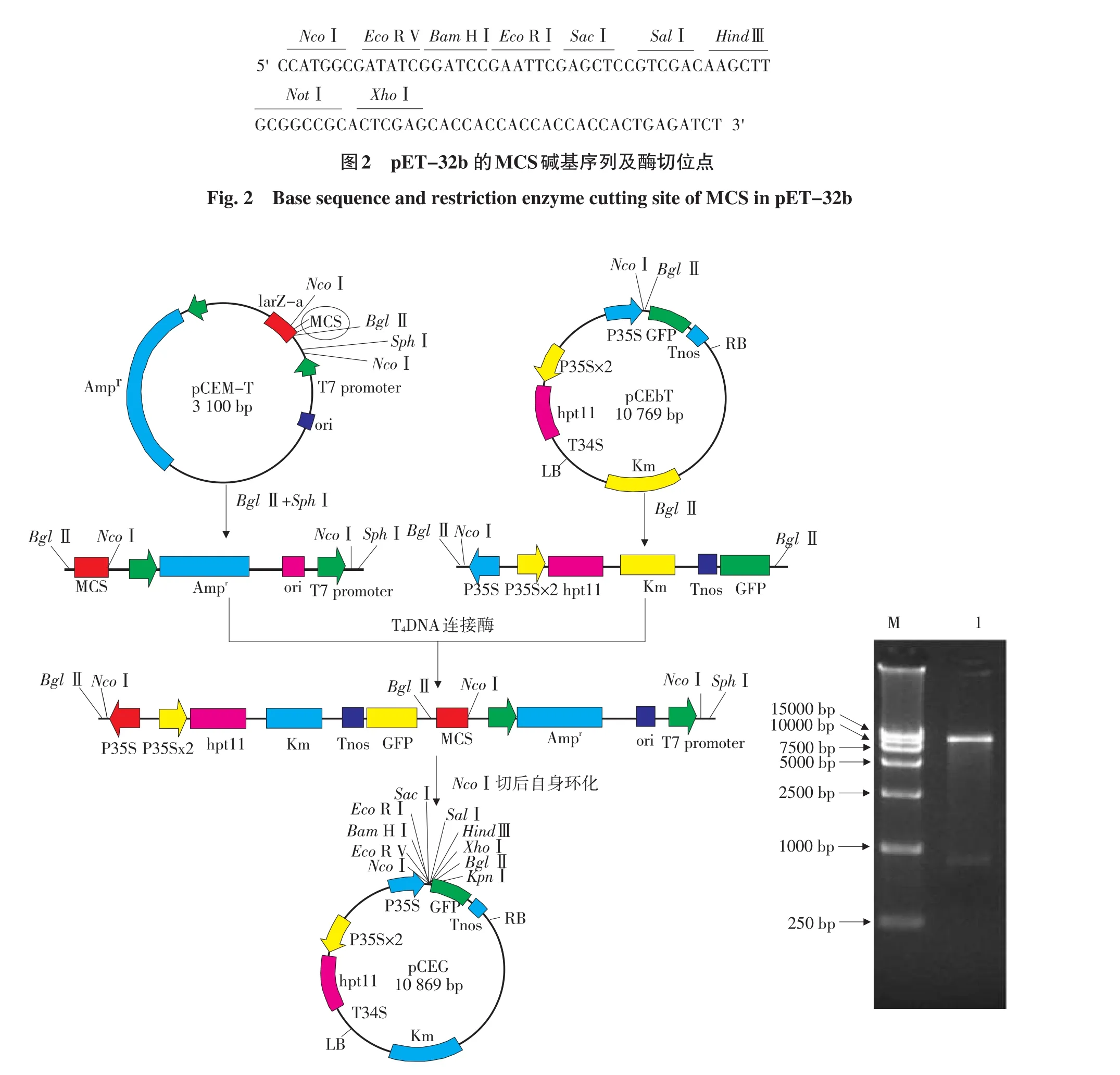
分析pGEM-T(含pET-32b的MCS)和pCEbT的酶切位点,设计了pCEG构建方案,即用BglⅡ和SphⅠ双酶切pGEM-T(含pET-32b的MCS)并回收大小约3.1 kb的线性大片段,用BglⅡ单酶切pCEbT,将两载体的酶切产物进行线性连接,并回收线性连接产物,然后用NcoⅠ单酶切回收的线性连接产物,并回收酶切产物大片段,最后用T4DNA连接酶进行NcoⅠ酶切产物的自身环化连接,构建成最终载体卡盒pCEG(见图3)。转化大肠杆菌DH5α,在含有Km的LB培养基平板上筛选转化菌落,提取阳性克隆质粒,并用SalⅠ和PstⅠ进行双酶切鉴定,凝胶电泳结果显示能切下大小约900bp的条带,证明终载体卡盒pCEG中存在SalⅠ酶切位点,即新合成的MCS成功插到了质粒pCEbT的GFP基因序列前面。为了进一步验证终载体卡盒pCEG中新插入的MCS的正确性,在载体卡盒pCEG中新插入的MCS上游区设计了一条引物(引物序列见材料与方法)用于新插入的MCS的测序,将酶切鉴定正确的终载体卡盒pCEG和新合成的引物送交测序,测序结果与pET-32b的MCS序列完全一致,其碱基序列所具有的酶切位点及顺序如图2所示,即证明终载体卡盒pCEG构建正确。

图2 pET-32b 的MCS碱基序列及酶切位点Fig.2 Base sequence and restriction enzyme cutting site of MCS in pET-32b
2.4 亚细胞定位载体卡盒pCEG对烟草的转化及GFP蛋白的亚细胞定位分析
为了验证植物亚细胞定位载体卡盒pCEG的可应用性,将载体卡盒pCEG转到根瘤农杆菌EHA105中,通过筛选得到阳性转化子;将转化了pCEG的根瘤农杆菌EHA105对烟草叶片进行注射,使烟草叶片瞬时表达pCEG中的GFP蛋白,通过激光共聚焦显微镜观察,GFP蛋白在烟草叶片的细胞核及细胞质中均有强烈表达(见图4),说明此载体卡盒可用于目的基因的亚细胞定位分析。
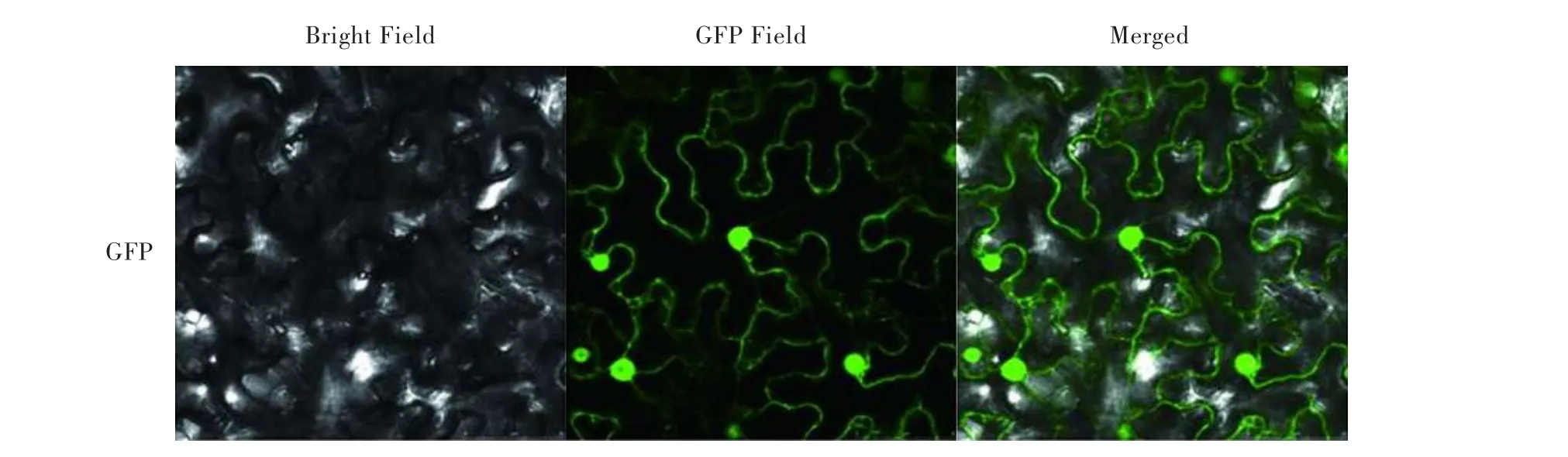
图4 载体卡盒pCEG中GFP蛋白在烟草叶片中的亚细胞定位Fig.4 Subcellular localization of GFP protein of plasmid pCEG in N.benthamiana
3 讨论与结论
3.1 植物GFP亚细胞定位载体卡盒pCEG的通用性
由于亚细胞定位载体卡盒pCEG的GFP基因序列前面插入了一个多克隆位点,而载体本身的多克隆位点已被消除,为目的基因构建与GFP融合的蛋白提供了很多可用的酶切位点,为目的基因的亚细胞定位载体构建过程提供了很多便利,这将大大缩短载体构建周期,节省大量人力物力。
由于亚细胞定位载体卡盒pCEG具有与pET-32b相同的多克隆位点(MCS),且位于报告基因GFP之前,任何研究的目的基因可直接从pET-32b上切下来连到卡盒pCEG上,而不会改变基因表达的编码框,大大简化了目的基因和GFP基因构成融合基因来用于目的基因的亚细胞定位分析的操作过程。
3.2 大载体与小片段连接策略
本研究需要将大小约0.1 kb的DNA小片段(pET-32b的MCS)连接到大小为10.7 kb的大载体上。由于小片段和大载体大小相差悬殊,若直接对两载体用NcoⅠ和BglⅡ进行双酶切连接,要得到连接产物pCEG会比较困难。本试验通过分析两载体上的酶切位点,设计了一个巧妙的连接过程(见图3)。其先将大小为3.1 kb的载体和大小为10.7 kb的载体进行线性连接,连接成的大片段用NcoⅠ单酶切,回收后的片段进行自连即可获得最终载体卡盒pCEG,使得小片段和大载体连接困难的问题得到很好的解决。
[1]宋传玲,李丽,文景芝.大豆疫霉菌(Phytophthora sojae)增强型绿色荧光蛋白遗传转化载体的构建[J].东北农业大学学报,2009,40(1):9-12.
[2]李杰,齐岩,朱延明,等.OsmaPK7基因的克隆、序列分析及其植物表达载体的构建[J].东北农业大学学报,2005,36(6):723-728.
[3]Bisicchia P,Botella E,Kevin M.Suite of novel vectors for ectopic insertion of GFP,CFP and IYFP transcriptional fusions in single copy at the amyE and bglS loci in Bacillus subtilis[J].Plasmid,2010,64(3):143-149.
[4]Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as amarker for gene expression[J].Science,1994,263(5148):802-805.
[5]吴瑞,张树珍.绿色荧光蛋白及其在植物分子生物学中的应用[J].分子植物育种,2005,3(2):240-244.
[6]贺竹梅,李华平,李宝键,等.绿色荧光蛋白在生命科学研究中的应用[J].遗传,1998,20(5):43-46.
[7]Wu C M,Chung T C.Green fluorescent protein is a reliable reporter for screening signal peptides functional in Lactobacillus reuteri[J].Journal of Microbiological Methods,2006,67:181-186.
[8]鞠传丽,王东,孔冬冬,等.绿色荧光蛋白在植物细胞生物学中的应用[J].生命的化学,2001,21(6):121-125.
[9]王关林.植物基因工程原理与技术[M].北京:科学出版社,2002.
[10]萨姆布鲁克.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[11]李杰,李晶,朱延明,等.DREB1A基因植物表达载体的构建[J].东北农业大学学报,2003,34(2):199-204.
[12]吴书音,郭玉双,柏锡,等.豆荚特异性启动子Pmsg的克隆及抗大豆食心虫植物表达载体的构建[J].东北农业大学学报,2008,39(3):58-63.
