肾移植患者术后口服环孢素A的群体药动学研究
2011-02-27张瑞麟李忠东
周 慧,张瑞麟,李忠东,李 俊
(1.空军总医院药学部,北京 100142;2.安徽医科大学药学院,安徽合肥 230032)
环孢素(cyclosporine),又名环孢菌素A(cyclospoine A,CsA),是从真菌的代谢产物中提取的含11个氨基酸的强效免疫抑制剂,临床用于各种器官移植及造血干细胞移植后免疫排异反应的预防和治疗,提高了移植成功率与患者存活率[1-2]。但CsA治疗窗窄、毒副作用大,口服吸收不规则、不完全,个体差异较大,在临床治疗过程中需要根据不同个体情况实施个体化给药方案[3]。群体药动学(population pharmacokinetics,PPK)常采用非线性混合效应模型[4](nonliner mixed effect model,NONMEM)定量考察病理生理及联合用药等固定效应因素对患者体内血药浓度差异的影响,该模型将经典药动学模型与统计学模型相结合,采用扩展的最小二乘法原理一步估算出各种群体药动学参数,并获得每一病人的个体参数,来施行个体化治疗。
本文利用空军总医院肾移植患者术后口服CsA的血药浓度监测数据,采用NONMEM法建立PPK模型,为制定CsA的个体化给药方案提供参考依据。
1 材料与方法
1.1 数据来源在解放军空军总医院回顾性查阅62例(男43例,女19例)肾移植患者住院病历,收集术后口服环孢素A的常规血药浓度监测数据,共160个,并记录如下信息:年龄、性别、体重、环孢素A每日剂量、术后时间(POD)、血常规和肝肾功能[包括:红细胞压积(HCT)、红细胞计数(RBC)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、白蛋白(ALB)、总蛋白(TP)、血清肌酸酐(Cr)、肌酐清除率(Ccr)]、以及合并用药情况:硝苯地平(NIFE)、奥美拉唑(OME)、更昔洛韦(GAN)、西咪替丁(CIM),数据统计信息见Tab 1。

Tab 1 Patients’demographic features
所有患者于肾移植术后采用“环孢素+强的松+霉酚酸酯”或“环孢素+强的松+硫唑嘌呤”或“环孢素+强的松+咪唑立宾”的三联免疫抑制方案。CsA 剂量为(5.58 ±1.44)mg·kg-1·d-1。
1.2 药品环孢素软胶囊(新赛斯平),10 mg/粒、25 mg/粒、50 mg/粒,杭州中美华东医药有限公司。
1.3 病例入选标准和排除标准
1.3.1 入选标准 在空军总医院泌尿外科接受同种异体肾移植术,术后口服CsA同一剂量连续7 d以上,男女不限,年龄17~70岁。
1.3.2 排除标准 术后发生排斥反应;术后严重肝肾功能不全;CsA血药浓度超出最高检测限或低于最低检测限。
1.4 血样的采集及测定按临床治疗需要,于患者早晨服药前瞬间采集静脉血1~2 ml,置于EDTA抗凝管中,采用荧光偏振免疫法(FPIA)在TDx仪上测定 CsA 浓度。检测范围为0 ~1 500 μg·L-1,日内及日间变异系数均<15%。
1.5 仪器和软件荧光偏振免疫分析仪(TDxFlx,美国Abbott公司);NONMEM软件(VersionV,Level 1.0,Globomax,USA)。
2 群体药动学模型建立
2.1 基础模型的选择根据以往文献[6-9,11-12]报道可采用一级吸收和消除的一房室开放模型来描述CsA体内药动学过程。
基础模型表达式如下:
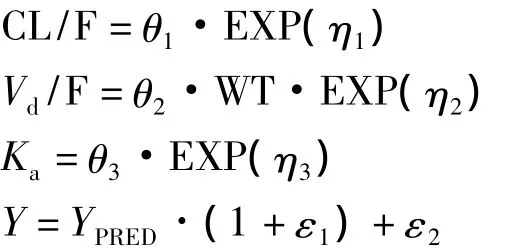
CL:清除率,单位L·h-1;Vd:表观分布容积,单位L;Ka:吸收速率常数,单位h-1;F:绝对生物利用度;CL/F、Vd/F均为被F校正过的相对表观值;WT为体重。
θ1、θ2、θ3:分别为 Cl、Vd、Ka的群体典型值;η1、η2、η3:分别表示 CL、Vd、Ka的个体间随机效应因素,通常认为这种个体间随机效应符合以0为中心,方差为ω2的正态分布。
Y:观测值(observed concentrations);YPRED:预测值(predicted values);ε1、ε2为个体间随机效应因素,通常认为这种个体内随机效应符合以0为中心,方差为σ2的正态分布。ε1为比例型误差,ε2为加和型误差。
2.2 全量回归模型和最终模型的建立分别考察年龄(AGE)、性别(GEND)、体重(WT)、术后时间(POD)、红细胞压积(HCT)、红细胞计数(RBC)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、白蛋白(ALB)、总蛋白(TP)、血清肌酸酐(CR)、血尿素氮(BUN)以及合并用药情况对CsA药动学参数的影响。
实验用逐步回归法建立群体药动学模型,在基础模型上,用加法、乘法或指数模型等分别引入各固定效应,比较固定效应模型与基础模型间目标函数值(OFV)的差异,作假设检验。若加入某一固定效应因素后,OFV的下降值大于3.84(df=1),表示该因素对模型有明显影响(P<0.05),以此筛选出单独存在有意义的固定效应因素,再将筛选出的固定效应因素按其加入模型后ΔOFV从大到小排序,按此顺序以递加方式逐一引入各固定效应,若模型ΔOFV大于3.84(df=1,P<0.05),模型中保留该因素,反之剔除,从而建立全量回归模型。再用逆向剔除法检验各相关因素存在的必要性,从全量回归模型中每次减去一个协变量,若 OFV增加值大于6.63,则该因素有显著性影响(P<0.01),在模型中予以保留,否则剔除,得到最终回归模型。
2.3 模型的验证本研究选用 Bootstrap(Perlspeaks-NONMEM,Verson 3.1.0)法进行模型验证。其过程是从含有n个样本的原数据集中有放回的随机抽取n个样本,组成一个新的数据集,然后求算模型参数值。本试验用1 000次bootstrap对最终模型进行验证,取得各验证组模型参数后进行统计学计算,得到 bootstrap验证的最终模型参数平均值(mean)和 95%的置信区间(confidence interval,CI),进行比较。
3 结果
3.1 基础模型的选择用NONMEM程序中ADVAN2子模块(单室模型),FOCE(first order conditional estimates)方法对数据进行分析。由于本研究为回顾性研究,数据来源为常规血药浓度监测,仅能获得稳态消除相数据,NONMEM无法准确估算Ka和Vd/F值,同时由于Ka和Vd/F对Cl/F的估算影响较小[5],因此需对其进行固定。根据文献[6-8]将Ka固定为 1.28 h-1;Vd/F 设置为 θ2× WT[8],θ2从2.0到10.0中筛选,发现将其固定为3.85时,估算误差最小,因此将Vd/F固定为3.85×WT。
3.2 全量回归模型和最终模型基础模型中CL/F分别受到 WT、HCT、TBIL、TP、GAN 和 CIM 影响(P<0.05),然而,当上述固定效应按ΔOFV从大到小有序递加后,仅WT、HCT、TBIL和TP对CL/F有影响(P<0.05),被保留在全量回归模型中。在逆向剔除过程中,发现 WT、HCT、TBIL对 CsA对 CL/F有影响(P<0.01),TP无影响(ΔOFV=4.656,P>0.01),予以剔除,最终模型参数见Tab 2。
CsA的最终药动学公式为:

3.3 最终模型评价
3.3.1 权重残差与群体预测值、病人ID散点图权重残差(WRES)是通过对残差(观测值与群体预测值之间的差异)加权得到的,对残差加权可以将残差正常化,使得分布方差为1。WRES应介于±4之间,过大或过小的点可能来源于异常数据。WRES对群体预测值(PRED)作图(Fig 1A),可见WERS值介于-2.61和2.75之间,且绝大多数分布于±2之间,均匀分布于坐标轴上下两侧,不随浓度变化。WRES对患者ID作图(Fig 1B)可看出残差是否与某些特定个体有关,由Fig 2B可见,WRES在X轴上下均匀分布,未见特别异常患者。
3.3.2 拟合优度评估 为了估算模型的预测精准性,模型拟合优度用群体的权重残差(WR)的平均值(MWR)和绝对权重残差(AWR)的平均值(MAWR),以及个体的权重残差(IWR)的平均值(MIWR)和绝对权重残差(AIWR)的平均值(MAIWR)来评估。

Tab 2 Final population pharmacokinetic parameter estimates of CsA and the results of internal validation(Bootstrap method)

Fig 1 Weight residual values(WRES)vs population predicted values(PRED)or patient's identification number(ID)

其中OBS为观察值,PRED、IPRED为模型预测值和个体预测值。本研究中MWR和MIWR分别为1.82%和0.23%,MAWR和MAIWR分别13.01%和8.22%,模型拟合度好,没有偏倚。
3.4 模型验证内部验证结果显示,1 000次bootstrap成功932次,成功率为93.2%,获得的参数均值与最终模型参数比较差异无显著性,最终模型参数值在932组bootstrap相应参数值的95%CI中(Tab 2),证明模型稳定可靠。
4 讨论
本研究最终建立了空军总医院肾移植患者术后口服CsA的PPK模型,并考察了性别、年龄、体重、术后时间、血常规、肝肾功能及合并用药等对CsA药动学参数的影响。最终估算出CsA药动学参数的 CL/F 的群体典型值为 30.5 L·h-1,与 Wu 等[7]报道相似。
最终模型公式表明,体重影响CsA的清除率,体重越大,CsA 清除率越大,这与部分文献[5-8,10]报道结论一致,提示临床应根据患者体重设定不同的给药剂量。
HCT与 CsA 的清除率呈负相关,与 Wu[7]、Yin[9]报道的一致,这是由于CsA在血液中约50%分布于红细胞中,因此,HCT值越高,CsA与红细胞结合的越多,则血浆中的CsA越少,能被清除的比例也就相应减小。
总胆红素(包括直接胆红素与间接胆红素)是反映肝功能的指标之一,肝功能受损时,部分直接、间接胆红素返流入血,血中总胆红素水平升高。而CsA主要在肝脏代谢,约90% ~96%经胆汁排泄,因此患者的肝功能水平是影响CsA体内过程的重要因素。本研究结果显示,患者体内总胆红素水平对CsA清除率有影响,提示临床使用CsA时还需要考虑肝功能(总胆红素)的影响。
CsA是肝微粒体酶CYP3A的代谢底物,因此CYP3A酶的抑制剂、诱导剂以及由该酶催化代谢的其他底物均可影响CsA的代谢过程[10]。本研究考察了肾移植术后常用药硝苯地平、奥美拉唑、更昔洛韦和西咪替丁对CsA的药动学参数的影响,这些药均为CYP3A4的代谢底物,但最终模型中未体现出这些代谢底物对CsA代谢的影响,可能与合并上述药物的人次少且用药时间短等有关。
本研究中的数据为肾移植患者术后的常规监测的稳态谷浓度数据,所以我们采用NONMEM法以一室模型为基础定量考察了固定效应因素如人口统计学特征、术后时间、肝肾功能及合并用药等对药动学参数的影响,并用统计学模型定量描述个体间及个体内差异,得到的最终效应模型公式与国内其他学者如芮建中等[6][CL(L·h-1)=59.8+0.03·体重 +4.31·性别 - 12.7·持续用药时间]、Wu[7][CL/F(L·h-1)=28.5-1.24·术后时间 -0.252·(总胆红素-11)+0.188·(体重 -58)-0.191·(年龄 -42)-2.45·肝药酶抑制剂 -0.212·(红细胞压积 -28)]和任斌等[11][CL(L · h-1)=12.81-0.067·年龄+0.101·体重]以同样方法研究的结果不完全一致,其原因与各亚群体的群体特征如人口统计学特征、遗传学特征、病理生理因素、检测方法、治疗方案、联合用药以及样本量大小和数据来源等不完全相同有关。
[1] Beauchesne P R,Chung N S,Wasan K M.Cyclosporine A:a review of current oral and intravenous delivery systems[J].Drug Dev Ind Pharm,2007,33(3):211 -20.
[2] 孙海英,李振宇,徐开林,等.昆明山海棠联合环孢素A防治小鼠急性移植物抗宿主病[J].中国药理学通报,2008,24(9):1259-60.
[2] Sun H Y,Li Z Y,Xu K L,et al.Prevention of mouse acute graftversus-host disease by tripterygium hypoglaucum hutch combined with Cyclosporin A[J].Chin Pharmcol Bull,2008,24(9):1259 -60.
[3] Fukudo M.Individualized dosage regimen of immunosuppressive drugs based on pharmacokinetic and pharmacodynamic analysis[J].Yakugaku Zasshi,2007,127(7):1081 - 9.
[4] Sheiner L B,Rosenberg B,Marathe W.Estimation of population characteristics of pharmacokinetic parameters from routine clinical data[J].J Pharmacokinet Biop,1977,5(5):445 - 79.
[5] 焦 正,钟明康,施孝金,等.NONMEM法估算中国癫痫患者卡马西平的清除率[J].中国药理学通报,2003,19(3):314-8.
[5] Jiao Z,Zhong M K,Shi X J,et al.The estimation of clearance of carbamazepine in chinese epileptic patients by NONMEM[J].Chin Pharmcol Bull,2003,19(3):314 - 8.
[6] 芮建中,卓海通,姜国华,陈 刚.NONMEM法分析肾移植患者环孢素 A的群体药动学[J].药学学报,1995,30(4):241-7.
[6] Rui J Z,Zhuo H T,Jiang G H,Chen G.Evaluation of population pharmacokinetics of cyclosporine A in renal transplantation patients with NONMEM[J].Acta Pharma Sin,1995,30(4):241 -7.
[7] Wu K H,Cui Y M,Guo J F,et al.Population pharmacokinetics of cyclosporine in clinical renal transplant patients[J].Drug Metab Dispos,2005,33(9):1268 -75.
[8] Du X L,Fu Q.Population pharmacokinetic study of cyclosporine in patients with nephrotic syndrome[J].J Clin Pharmacol,2009,49(7):782-8.
[9] Yin O Q P,Lau S K,Chow M S S.Population pharmacokinetics of cyclosporine in chinese cardiac transplant recipients[J].Pharmacotherapy,2006,26(6):790 -7.
[10] Thomas K,Volker F,Urs A M.Cyclosporine metabolism in human liver:Identification of a cytochrome P-450Ⅲgene family as the major cyclosporine-metabolizing enzyme explains interactions of cyclosporine with other drugs[J].Clin Pharmacol Ther,1998,43(6):630-5.
[11]任 斌,黎曙霞,王长希,等.非线性混合效应模型法估算肾移植患者环孢素A清除率[J].中国药学杂志,2003,38(9):692-4.
[11] Ren B,Li S X,Wang C X,et al.Estimation of relative clearance of cyclosprine A in patients after renal transplantation using nonlinear mixed effect model[J].Chin Pharm J,2003,38(9):692 -4.
[12]陈 冰,蔡卫民.群体药动学在免疫抑制剂合理用药中的应用[J].中国药理学通报,2010,26(2):159 -63.
[12] Chen B,Cai W M.Application of population pharmcokinetics in the rational usage of immunosuppressive drugs[J].Chin Pharmcol Bull,2010,26(2):159 -63.
