红车轴草异黄酮抑制小胶质细胞活化保护多巴胺能神经元的研究
2011-02-27陈寒青孙汉巨汪锡金徐学明金征宇
陈寒青,孙汉巨,汪锡金,徐学明,金征宇
(1.合肥工业大学生物与食品工程学院,安徽合肥 230009;2.上海交通大学医学院附属瑞金医院神经内科,神经病学研究所,上海 200025;3.江南大学食品科学与技术国家重点实验室,食品学院,江苏无锡 214122)
帕金森病(Parkinson’s disease,PD)是中老年人常见的中枢神经系统退变性疾病,其主要病理生化特征为黑质致密部多巴胺(dopamine,DA)能神经元进行性、选择性变性,导致纹状体DA含量明显降低[1]。近年来,越来越多的证据表明[2-5]:小胶质细胞参与PD的发病与病情发展。在受到缺血、损伤或免疫/炎性因素刺激时,小胶质细胞迅速活化,释放出一些促炎物质,包括促炎细胞因子,如TNF-α、IL-1β和自由基(如NO和氧自由基),导致神经元特别是多巴胺能神经元变性、死亡[3,6]。
如何有效地阻止或抑制小胶质细胞的活化,使神经元免于或减少损害,则是目前许多研究者关注的问题。有研究表明[7],雌激素可抑制小胶质细胞的活化,且其抑制作用与小胶质细胞上的雌激素受体有关。但长期服用雌激素会导致激素依赖性疾病,如乳腺癌和前列腺癌,从而限制了雌激素作为PD的药物在临床上的应用。而植物雌激素——异黄酮具有毒副作用小、使用安全等特点。
目前,关于植物雌激素异黄酮对中枢神经系统的作用多局限于对神经元本身的作用,如抗凋亡作用[8-9],而对小胶质细胞活化介导的多巴胺能神经元损伤的影响鲜见报道。
本文通过对从红车轴草中分离的5种异黄酮(芒柄花素、大豆黄素、毛蕊异黄酮、红车轴草素、德鸢尾素)对小胶质细胞活化介导的多巴胺能神经元损伤的作用进行探讨,这不仅有助于阐明PD的发病机制,同时也为PD的治疗提供新的有价值的线索。
1 材料与方法
1.1 实验动物SD大鼠购于中科院上海实验动物中心。
1.2 实验试剂和药品5种异黄酮(芒柄花素、大豆黄素、毛蕊异黄酮、红车轴草素、德鸢尾素。本实验室从红车轴草中分离得到,经 UV,MS,NMR鉴定,纯度均为95%以上),化学结构如Fig 1所示;脂多糖(LPS,Escherichia coli O111:B4,Sigma 公司);[3H]dopamine(DA)(30 Ci/mmol)(Perkin Elmer生命科学公司,PELS);抗酪氨酸羟化酶抗体(Sigma公司);抗胶质纤维酸性蛋白(GFAP)、OX-42单克隆抗体(Chemicon公司);生物素化二抗(抗小鼠)、ABC试剂盒及DAB试剂盒(Vector Laboratories Ins公司);大鼠TNF-α定量免疫测定试剂盒(R&D公司);NO比色测定试剂盒(Calbiochem公司);细胞培养用试剂(Invitrogen公司);其余试剂均为Sigma公司产品。

Fig 1 The chemical structure of five isoflavones from Trifolium pratense
1.3 实验仪器MicroBeta液闪测定仪(PELS公司);IX700倒置显微镜(Olympus公司);MultisKan mk3酶联免疫检测仪(Thermolabsystems公司);AW165-1型CO2培养箱(HAIRIS公司);HNY-100B恒温摇床(北京瑞尔欣德科技有限公司)。
1.4 异黄酮的前处理先将不同异黄酮以较高浓度(10 mmol·L-1)溶解在二甲亚砜与乙醇混合液(体积比1∶1)中,经0.25 μm有机微孔滤膜过滤,然后用细胞培养液稀释成一定浓度待用。
1.5 中脑原代神经元 -胶质细胞混合培养[10-11]取孕14 d(E14 d)大鼠胚胎,无菌条件下分离中脑腹侧组织(含A8-A10区),剪碎,胰酶振荡消化,胎牛血清终止消化,滴管吹打制成细胞悬液,滤膜过滤,离心,弃上清,加入培养液[MEM+10%FBS(小牛血清)+10%HS(马血清)+1 g·L-1葡萄糖+2 mmol·L-1L-谷氨酸盐 +1 mmol·L-1丙酮酸钠 +100 μmol·L-1非必需氨基酸 +5 ×104U·L-1青霉素+50 mg·L-1链霉素],计数,依据不同实验目的,分别以每孔5×105、2.5 ×105、1×105个细胞数接种于涂有多聚-D-赖氨酸的24、48、96孔培养板,置于37℃、5%CO2的孵箱中培养。以上细胞培养定期换液。
1.6 小胶质细胞纯化培养[11]取出生后1 d的乳鼠,无菌条件下取全脑,去脑膜,剪碎,胰酶振荡消化,胎牛血清终止消化,滴管吹打,滤膜过滤,接种于150 cm2培养瓶(5×107),14 d后置37℃恒温摇床,180 r·min-1振摇5 h,收集脱落到上清液中的细胞,即为小胶质细胞。经免疫组化(OX-42、GFAP)鉴定,纯化的小胶质细胞纯度在98%以上。
1.7 测定指标和方法
1.7.1 免疫细胞化学染色(ABC 法)[10-11]培养细胞经3.7%多聚甲醛室温固定20 min,1%H2O2作用10 min,封闭液(含 1%BSA,0.4%Triton X-100和4%马血清)作用40 min,加一抗[anti-TH(1∶1 000)、OX-42(1 ∶1 000)],4℃过夜,加生物素化二抗,37℃孵育1 h,加 AB 混合液,37℃孵育1 h,加底物显色,终止反应。倒置显微镜下观察细胞形态,并对免疫阳性细胞进行计数,培养板上每孔随机选取10个视野,计数视野内的阳性细胞数,每个视野数两遍,取平均数作为该视野内的阳性细胞数,顺序为自上而下,由左至右,不完全位于视野内的细胞不计数,最后取各视野内细胞数的平均值。并表示为对照孔的百分比。
1.7.2 [3H]DA 摄取力的测定[10-11]培养细胞用Krebs-Ringer缓冲液(KRB,含 16 mmol·L-1磷酸钠、119 mmol·L-1氯化钠、4.7 mmol·L-1氯化钾、1.8 mmol·L-1氯化钙、1.2 mmol·L-1硫酸镁、1.3 mmol·L-1乙二胺四乙酸、5.6 mmol·L-1葡萄糖,pH 7.4)洗 2次,于 37℃ KRB孵育 15 min(含 1 μmol·L-1[3H]DA),冰 KRB 洗 3 次后,用 1 mol·L-1NaOH溶解细胞后,用液闪仪测定。对于DA的非特异性摄取,通过加10 μmol·L-1马吲哚(mazindol)排出。
1.7.3 TNF-α、NO 和超氧自由基的测定 TNF-α测定采用ELISA法,测定波长为450 nm;NO测定依据Griess反应[12],测定波长为540 nm;超氧自由基测定采用细胞色素 C还原法[10-11],测定波长为550 nm。以上测定均参照试剂盒说明书进行。
1.8 数据统计处理每个实验重复5次,每次设3个平行样品,实验数据均表示为对照组的百分比,以±s形式表示,利用SAS 6.12进行单因素的方差分析。
2 结果
2.1 不同异黄酮对中脑混合培养体系DA摄取力的影响如 Fig 2所示,脂多糖(LPS,10 μg·L-1)处理中脑原代混合培养体系,导致培养体系的DA摄取力明显下降,为对照组的37.2%,但在LPS处理前30 min,加入不同异黄酮(浓度分别为0.25、1.0 和2.5 μmol·L-1,在预实验中通过 MTT 检测观察到,不同异黄酮在此3浓度下对中脑原代培养体系的细胞活力无影响),培养7 d,通过液闪测定法观测到,不同异黄酮能明显减轻LPS诱导的DA摄取力的下降,其中以pratensein作用最明显,其次为 daidzein,以下依次为:calycosin,formononetin,Irilone(Fig 2),并且异黄酮的作用呈现剂量效应,以2.5 μmol·L-1作用效果最佳。在浓度为 2.5 μmol·L-1时,经过 pratensein,daidzein,calycosin,formononetin,irilone预处理,DA摄取力分别为对照组的80.2%、70.1%、65.7%、60.7% 和 56.1%,并且与LPS处理组比较,差异均有显著性(P<0.05)。另外,与vehicle处理的对照组比较,在培养体系中只加入异黄酮,对DA摄取力无影响(P>0.05)。

Fig 2 Effect of different isoflavones from Trifolium pratense on DA uptake in primary mesencephalic neuron-glia cultures
2.2 不同异黄酮对中脑混合培养体系多巴胺能神经元数目的影响如Fig 3所示,LPS(10 μg·L-1)处理中脑原代混合培养体系,导致培养体系的DA能神经元数目明显下降,为对照组的46.7%。但是,在LPS处理前30 min,加入不同异黄酮(浓度均分别为0.25、1.0 和2.5 μmol·L-1),培养7 d,结果显示,上述处理明显减轻LPS诱导的DA能神经元数目的下降,其作用强弱类似于对DA摄取力的影响,作用强弱依次为 pratensein,daidzein,calycosin,formononetin,irilone(Fig 3),并且异黄酮的作用呈现剂量效应,以2.5 μmol·L-1作用效果最佳。在浓度为 2.5 μmol·L-1时,经过 pratensein,daidzein,calycosin,formononetin,irilone预处理,DA 能神经元数目分别为对照组的81.1%、71.3%、66.8%、61.8%和57.1%,并且与LPS处理组间差异均有显著性(P<0.05)。同样,与vehicle处理的对照组比较,在培养体系中只加入异黄酮,对DA能神经元数目无明显影响,与对照组间差异无显著性(P>0.05)。
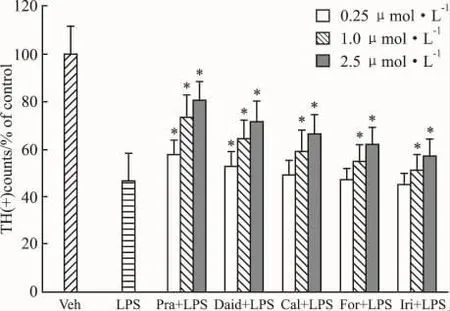
Fig 3 Effect of different isoflavones from Trifolium pratense on the number of DA neurons in primary mesencephalic neuron-glia cultures
2.3 不同异黄酮对中脑混合培养体系中小胶质细胞活化和炎性因子生成的影响如Fig 4A所示,在培养体系中,LPS(10 μg·L-1)明显诱导小胶质细胞的活化,导致小胶质细胞数目明显增加,而不同异黄酮明显抑制LPS诱导的小胶质细胞数目的增加。在浓度为 2.5 μmol·L-1时,经过 pratensein,daidzein,calycosin,formononetin,irilone 预处理,小胶质细胞数目分别比LPS处理组降低了51.3%、45.3%、40.5%、36.4%和32.1%,并且与LPS处理组间差异均有显著性(P<0.05)。
如 Fig 4B所示,在培养体系中,LPS(10 μg·L-1)明显诱导TNF-α的生成,而不同异黄酮明显抑制LPS诱导的该炎性因子的增加,在浓度为2.5 μmol·L-1时,经过 pratensein,daidzein,calycosin,formononetin和irilone预处理,TNF-α的生成量分别比 LPS处理组降低了 37.7%、34.4%、31.3%、28.1%和24.8%,并且与LPS处理组间差异均有显著性(P<0.05)。同时,不同异黄酮还明显抑制LPS诱导的NO和superoxide的生成量,在浓度为2.5 μmol·L-1时,经过 pratensein,daidzein,calycosin,formononetin和 irilone预处理,NO生成量分别比 LPS处理组降低了 67.3%、62.7%、58.4%、54.3% 和50.6%,superoxide的生成量分别比LPS处理组降低了74.3%、69.7%、65.9%、62.3%和58.7%,并且与LPS处理组间差异均有显著性(P<0.05)(Fig 4C,4D)。
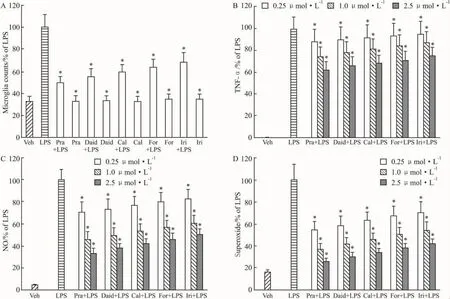
Fig 4 Effect of different isoflavones from Trifolium pratense on microglia activation and the production of proinflammatory factors in primary mesencephalic neuron-glia cultures
2.4 不同异黄酮对小胶质细胞纯化体系中小胶质细胞活化和炎性因子生成的影响如Fig 5A~C所示,在培养体系中,LPS(10 μg·L-1)明显诱导 TNF-α,NO和superoxide的生成,但是,在LPS处理前30 min,加入不同异黄酮(2.5 μmol·L-1),培养 7 d,结果显示,不同异黄酮明显抑制LPS诱导的上述炎性因子的生成,经过 pratensein,daidzein,calycosin,formononetin和irilone预处理,TNF-α生成量分别比LPS处理组降低了38.3%、33.5%、29.2%、24.9%和21.1%,NO生成量分别比LPS处理组降低了62.3%、57.1%、52.2%、48.6% 和44.2%,Superoxide的生成量分别比 LPS处理组降低了70.2%、64.9%、60.4%、56.1% 和51.8%,并且与LPS处理组间差异均有显著性(P<0.05)。
3 讨论
帕金森病是严重危害中老年人生命健康的中枢神经系统变性疾病。近年来研究表明[13],小胶质细胞参与帕金森病的发病和病情发展。小胶质细胞是中枢神经系统的免疫活性细胞,在脑中黑质部位小胶质细胞密度最高[5]。小胶质细胞的激活是帕金森病脑中重要的病理现象之一,小胶质细胞活化后可通过生成一些促炎因子导致神经元变性,抑制小胶质细胞的活化可达到神经保护作用[11,14]。如何有效地阻止或抑制小胶质细胞的激活,使神经元免于或减少损害,则是当前神经科学的研究热点之一。
红车轴草是一种豆科植物,在我国分布广泛。红车轴草中含有丰富的异黄酮,其中鸡豆黄素A(biochanin A)、芒柄花素(formononetin)、染料木素(genistein)、大豆黄素(daidzein)、红车轴草素(pratensein)、毛蕊异黄酮(calycosin)和德鸢尾素(irilone)是红车轴草中主要的异黄酮。研究表明:染料木素和鸡豆黄素A对LPS诱导的多巴胺能神经元的损伤具有保护作用[15-16]。然而,红车轴草中除了染料木素和鸡豆黄素A外,其他5种主要的异黄酮对小胶质细胞介导的多巴胺能神经元损伤的影响尚未见报道。
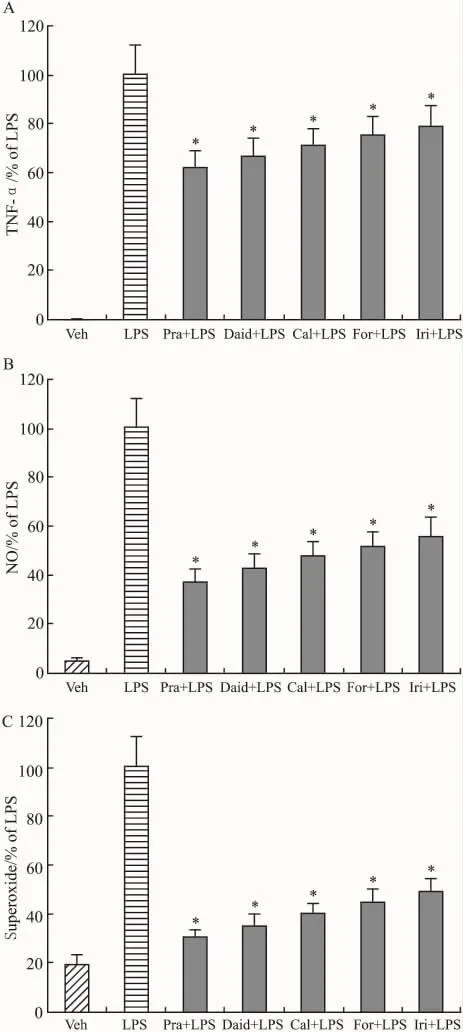
Fig 5 Effect of different isoflavones from Trifolium pratense on the production of proinflammatory factors in primary microglia-enriched cultures
本文研究表明,红车轴草中这5种异黄酮均能不同程度地抑制LPS诱导的小胶质细胞的活化和促炎因子的生成,减轻多巴胺能神经元的损伤,表现为多巴胺摄取力和多巴胺能神经元数目的增加。在抑制促炎因子生成方面,本实验观察了5种异黄酮对TNF-α、NO和超氧自由基的影响。这是因为已有的研究表明[2,17],在 LPS(10 mg·L-1)处理的中脑原代混合培养体系中,TNF-α、NO和超氧自由基被证明是导致多巴胺能神经元变性的主要促炎因素。本实验结果表明:来源于红车轴草的5种异黄酮对超氧自由基的抑制作用似乎较其它两种因子(TNF-α和NO)的作用强。实际上,前人研究表明,多巴胺能神经元由于自身的原因对氧化应激特别敏感,氧自由基被认为是导致多巴胺能神经元变性的最重要的促炎因子。Liu等[18]研究表明,在LPS处理的中脑原代混合培养体系中,如果一种物质能选择性抑制氧自由基的生成,则它可能是保护多巴胺能神经元免于LPS诱导损伤的有效药物。
本文还表明,来源于红车轴草的这5种异黄酮对促炎因子生成和保护多巴胺能神经元的作用似乎并不表现出完全的一致性。这可能主要是由于以下原因:(1)异黄酮类化合物保护多巴胺能神经元的作用,不仅与抑制小胶质细胞的活化有关,可能还有其它机制参与。前人[8-9]研究表明,异黄酮类化合物可直接作用于神经元,表现出保护作用。(2)我们观察到的异黄酮类化合物对促炎因子生成的作用仅限于对某个时间点的观察。(3)异黄酮类化合物选择性抑制氧自由基的生成。
本文还发现,这5种异黄酮对多巴胺能神经元的保护作用不同,造成这种作用差异的原因可能与它们的雌激素活性有关。Liu等[19]报道,雌激素通过小胶质细胞中雌激素受体α和β,对活化的小胶质细胞诱导的多巴胺能神经元的损伤产生保护作用。由于异黄酮与雌激素在结构上有类似之处,所以异黄酮可能通过与小胶质细胞上雌激素受体的相互作用,从而产生神经保护作用。而植物雌激素通过与雌激素受体结合从而显示雌激素活性。因此,异黄酮与雌激素受体结合力的大小可以用来评价不同异黄酮雌激素活性的强弱。Kuiper等[20]研究发现,一些植物雌激素如香豆雌酚(coumestrol)、染料木素、芹菜素(apigenin)、柚皮素(naringenin)、山奈酚(kaempferol)与17β-雌二醇竞争结合雌激素受体β能力的强弱顺序为:genistein=coumestrol>daidzein>apigenin=kaempferol=naringenin>formononetin,这与本文研究结果异黄酮神经保护作用强弱顺序一致。本文研究表明,daidzein的神经保护作用大于formononetin。因此,这5种异黄酮雌激素活性的差异可能导致了其神经保护作用强弱的不同。然而,除了雌激素活性的差异外,并不排除其他的可能性。因此,有必要进一步研究阐明这5种异黄酮神经保护作用的差异。
总之,红车轴草中5种主要的异黄酮对LPS诱导的多巴胺能神经元的损伤均具有不同程度的保护作用,且保护作用强弱的顺序依次为:pratensein>daidzein>calycosin>formononetin>irilone,抑制小胶质细胞的活化是其作用机制之一。
[1] Olanow C W,Tatton W G.Etiology and pathogenesis of Parkinson’s disease[J].Annu Rev Neurosci,1999,22:123 -44.
[2] Liu B,Hong J S.Role of microglia in inflammation-mediated neurodegenerative diseases:mechanisms and strategies for therapeutic intervention[J].J Pharmacol Exp Ther,2003,304(1):1 - 7.
[3] Le W,Rowe D,Xie W,et al.Microglial activation and dopaminergic cell injury:an in vitro model relevant to Parkinson’s disease[J].J Neurosci,2001,21(21):8447 -55.
[4] Kim W G,Mohney R P,Wilson B,et al.Regional difference in susceptibility to lipopolysaccharide-induced neurotoxicity in the rat brain:role of microglia[J].J Neurosci,2000,20(16):6309 -16.
[5] Lawson L J,Perry V H,Dri P,Gordon S.Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain[J].Neuroscience,1990,39(1):151 -70.
[6] Kreutzberg G W.Microglia:a sensor for pathological events in the CNS[J].Trends Neurosci,1996,19(8):312 -8.
[7] Vegeto E,Bonincontro C,Pollio G,et al.Estrogen prevents the lipopolysaccharide-induced inflammatory response in microglia[J].J Neurosci,2001,21(6):1809 - 18.
[8] Sonee M,Sum T,Wang C,Mukherjee S K.The soy isoflavone,genistein,protects human cortical neuronal cells from oxidative stress[J].Neurotoxicol,2004,25(5):885 -91.
[9] 牛英才,潘 志,李晓明,等.葛根异黄酮对MPP+诱导的PC12细胞凋亡的保护作用[J].中国药理学通报,2009,25(1):112-5.
[9] Niu Y C,Pan Z,Li X M,et al.The protection action of total isoflavones from pueraria lobata against MPP+induced PC 12 cellular apoptosis[J].Chin Pharmacol Bull,2009,25(1):112 -5.
[10] Gao H M,Jiang J,Wilson B,et al.Microglial activation-mediated delayed and progressive degeneration of rat nigral dopaminergic neurons:relevance to Parkinson’s disease[J].J Neurochem,2002,81(6):1285-97.
[11] Liu B,Du L,Hong J S.Naloxone protects rat dopaminergic neurons against inflammatory damage through inhibition of microglia activation and superoxide generation[J].J Pharmacol Exp Ther,2000,293(2):607-17.
[12] Green L C,Wagner D A,Glogowski J,et al.Analysis of nitrate,nitrite,and[15N]nitrate in biological fluids[J].Anal Biochem,1982,126(1):131 -8.
[13] Orr C F,Rowe D B,Halliday G M.An inflammatory review of Parkinson’s disease[J].Prog Neurobiol,2002,68(5):325 -40.
[14] McGeer P L,McGeer E G.The inflammatory response system of brain:Implications for therapy of Alzheimer and other neurodegenerative diseases[J].Brain Res Rev,1995,21(2):195 -218.
[15] Wang X,Chen S,Ma G,et al.Genistein protects dopaminergic neurons by inhibiting microglial activation[J].Neuroreport,2005,16(3):267-70
[16]陈寒青,金征宇.鸡豆黄素A抑制小胶质细胞活化保护多巴胺能神经元[J].营养学报,2007,29(6):605 -9,613.
[16] Chen H Q,Jin Z Y.Biochanin A protects dopaminergic neurons by inhibiting microglia activation[J].Acta Nutrimenta Sin,2007,29(6):605 -9,613.
[17] Gayle D A,Ling Z D,Tong C W,et al.Lipopolysaccharide(LPS)-induced dopamine cell loss in culture:roles of tumor necrosis factor-α,interleukin-1β,and nitric oxide[J].Brain Res Dev Brain Res,2002,133(1):27 -35.
[18] Liu Y X,Qin L Y,Li G R,et al.Dextromethorphan protects dopaminergic neurons against inflammation-mediated degeneration through inhibition of microglial activation[J].J Pharmacol Exp T-her,2003,305(1):212 -8.
[19] Liu X,Fan X L,Zhao Y,et al.Estrogen provides neuroprotection against activated microglia-induced dopaminergic neuronal injury through both estrogen receptor-α and estrogen receptor-β in microglia[J].J Neurosci Res,2005,81(5):653 -65.
[20] Kuiper G G,Lemmen J G,Carlsson B,et al.Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor β[J].Endocrinology,1998,139(10):4252 -63.
