bFGF通过上调Ras/ERK信号通路诱导BMSCs表达Ⅰ型胶原
2011-02-27扎拉嘎胡陈小义王英慧
买 霞,陈 莉,扎拉嘎胡,陈小义,王英慧
(中国人民武装警察部队医学院1.细胞生物学与医学遗传学教研室、2.天津市职业和环境生物标志物重点实验室,天津 300162)
干细胞增殖与分化与其所处的微环境密切相关,除细胞间相互作用外,离不开生长因子调控[1-2]。研究表明[3-4],碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种对中胚层组织和神经外胚层细胞具有促有丝分裂作用的多肽生长因子,能够促进多种细胞增殖,促进微血管分化,使局部毛细血管增加,刺激骨细胞DNA合成,提高骨细胞合成胶原和非胶原蛋白的能力。
细胞因子通过不同的信号转导途径来实现其对细胞的调节作用[5]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKS)家族是真核细胞接受生长因子作用后,引起细胞生物学效应的一类重要的酶蛋白信号系统,参与细胞的增殖与分化等多种调节过程[6]。但是 Ras/ERK信号通路在bFGF促进骨髓间充质干细胞(bone marrow derived mesenchymal stem cell,BMSCs)分化过程中的作用还未见报道。本实验以BMSCs为研究对象,观察其在bFGF作用下成骨细胞分化表型变化,以及Ras/ERK信号通路相关蛋白p42/44ERK表达水平的变化,探讨bFGF诱导BMSCs细胞分化的作用及其可能的作用机制。
1 材料与方法
1.1 材料bFGF(Sigma公司),SD大鼠(SPF级)由中国人民解放军军事医学科学院实验动物中心引进;H-DMEM培养基、胰蛋白酶(Gibco公司);胎牛血清(Biochrom公司);β-actin、Ⅰ型胶原 、P-ERK抗体(均为Santa Cruz公司);SP检测试剂盒和DAB显色试剂盒(北京中杉公司)。UV-2401PC紫外分光光度计(岛津公司,日本);GEIDOC2000凝胶自动成像系统(Bil-Rad公司,美国)。
1.2 实验分组和步骤
1.2.1 BMSCs的分离与扩增 取成年SD大鼠2只,脱颈致死,体积分数为0.75的乙醇浸泡消毒,在无菌条件下暴露股骨,剪去股骨两端关节软骨后用预冷无血清培养基冲洗骨髓腔数次,收集冲洗液1 000×g离心8 min,弃上清后加入DMEM培养基(其中含胎牛血清质量浓度为100 g·L-1,L-谷氨酰胺2.0 mmol·L-1,庆大霉素8万U·L-1)制成细胞悬液,接种于6孔培养板内,置37℃、体积分数为0.05的CO2及饱和湿度条件下培养。通过细胞对培养皿的附壁特性筛选骨髓间充质干细胞。细胞扩增至第3代时,用体积分数为0.0025胰蛋白酶消化后悬浮于培养液中备用。
1.2.2 实验分组BMSCs诱导分化 将第3代BMSCs调整细胞密度为5×108·L-1细胞接种于培养瓶(免疫细胞化学检测标本接种于加有盖玻片经APES处理的6孔培养板内),细胞接种24 h后,诱导组分别加入不同浓度bFGF:A组终浓度为10 μg·L-1,B 组终浓度为 5 μg·L-1,C 组终浓度为 20 μg·L-1,D组为对照组只用常规DMEM培养基培养,每3天换液1次,持续培养28 d。
1.2.3 形态学观察 BMSCs在诱导后6 h开始在倒置光显微镜下对各组细胞形态变化进行动态观察,并作照相记录。收集d 3细胞3大瓶,常规制作透射电镜标本,在透射电镜下观察细胞的超微结构变化。
1.2.4 RT-PCR检测Ⅰ型胶原mRNA表达 收集BMSCs细胞,TRIzol法提取 A组和 D组细胞总RNA,紫外分光光度计测定RNA含量和纯度(RNA在260 nm和280 nm的A值比值为1.8~2.0),以10 g·L-1琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值≥2.0)。取1 μg细胞总RNA进行逆转录合成 cDNA,条件如下:30℃ 10 min,42℃30 min,99℃ 5 min,5℃ 5 min。采用 Omiga 2.0 引物设计软件设计Ⅰ型胶原引物序列,内参照β-actin。引物序列:Ⅰ型胶原上游引物 5'-GGACTTGGGCAAGACAGTGATC-3',下游引物5'-GTCACGTTCAGTTGGTCAAAGAT-3',片段长度 333 bp;β-actin上游引物5'-TGTTTGAGACCTTCAACACCC-3',下游引物5'-AGCACTGTGTTGGCGTACAG-3',片段长度540 bp。扩增条件,94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸 1 min;共 35 个循环。反应完毕后取10 μl扩增产物行琼脂糖凝胶电泳,紫外分光光度计下观察,GEIDOC 2000凝胶自动成像系统扫描,以靶基因/β-actin A值的比值作为表示不同样本间的相对量,实验独立重复3次,取均值作统计学分析。
1.2.5 免疫细胞化学染色 在诱导后不同时间点取出细胞爬片各3张,用新鲜配制的预冷固定液(甲醇 ∶丙酮=1∶1)4℃ 固定10 min,常规方法进行Ⅰ型胶原和p-ERK免疫细胞化学染色,苏木精复染后,脱水、透明、中性树胶封片。在光学显微镜下观察并计数阳性细胞,每组观察3张细胞爬片,随机选择10个不同视野(×200),计算阳性细胞率。
1.2.6 Western blot检测p-ERK蛋白表达 取实验BMSCs细胞PBS洗2次,冰上裂解45 min,12 000×g离心10 min,定量上清液中的蛋白。上样50 μg进行SDS-PAGE,转移至PVDF膜上。0.5 g·L-1脱脂奶粉37℃封闭2 h,一抗(mouse anti-p-ERK)4℃孵育过夜,TBST洗3次,每次15 min,HRP标记的兔抗鼠IgG(1∶4 000)37℃孵育2 h,TBST洗3次,将PVDF膜置于暗盒中,X线曝光,显影定影。采用Bandscan 5.0软件测定各条带的A值。
1.3 统计学分析所有数据以±s表示,SPSS 11.0软件处理。两样本均数的比较采用t检验;多组比较用单因素方差分析。
2 结果
2.1 形态学观察倒置光显微镜观察采用贴壁筛选法分离的BMSCs,原代培养12 h后细胞开始贴壁,24 h后贴壁细胞可达20%。以后贴壁细胞逐渐增多,d 5可见有50%细胞贴壁,d 7左右细胞融合80%。此时以成纤维样细胞为主并有集落形成。培养1周后传代,传代培养后的细胞体积较大,细胞形态趋于一致,为成纤维样细胞,呈火焰状生长,细胞生长较快,为d 7~10传一代。透射电镜观察,对照组BMSCs细胞表现出未分化细胞的特征:细胞体积较小,核质比例较大,核仁大而明显,细胞表面有微绒毛,胞质内可见核糖体和线粒体,其他细胞器较少,经bFGF作用d 7后细胞粗面内质网和分泌泡明显增加,为成骨细胞超微结构特征(Fig 1)。

Fig 1 Morphology changes of BMSCs by electron microscope(×3 000)
2.2 bFGF上调Ⅰ型胶原mRNA表达RT-PCR检测示A组d 3、5、7、14、21Ⅰ型胶原 mRNA 水平较D组水平分别上调1.67倍、2.09倍、1.99倍、2.21倍和1.03倍(Fig 2)。
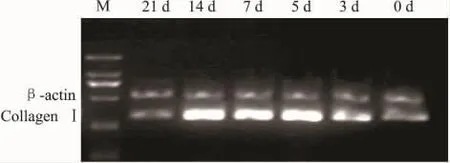
Fig 2 The mRNA expression levels of collagenⅠin the BMSCs treated with 10 μg·L -1bFGF at different time points by RT-PCR
2.3 bFGF上调p-ERK蛋白表达并促进细胞Ⅰ型胶原蛋白合成免疫细胞化学染色结果表明,A组bFGF作用从d 3开始,细胞Ⅰ型胶原蛋白表达明显增强,随培养时间延长至d 14达最高(Tab 1,Fig 3);与此同时A组抗p-ERK免疫细胞化学染色在各个时间点均较D组为高(Tab 2,Fig 4);Western blot实验结果进一步证明BMSCs经bFGF作用后,A组p-ERK蛋白表达水平较D组水平分别上调1.28倍、1.40倍、2.65倍和1.47倍(Fig 5)。
Tab 1 The effect of different concentration group bFGF on the collagen Ⅰ protein in the BMSCs at different time points(%, ± s,n=10)

Tab 1 The effect of different concentration group bFGF on the collagen Ⅰ protein in the BMSCs at different time points(%, ± s,n=10)
**P<0.01 vs group D
Group Time(culture)/d 14 21 A 3 5 7 35.4 ±1.04** 42.6 ±1.05** 61.6 ±3.18** 85.4 ±2.10** 76.3 ±1.14**B 28.8 ±1.15** 39.7 ±2.12** 57.8 ±3.22** 84.7 ±4.32** 73.4 ±3.12**C 35.6 ±2.04** 42.8 ±3.05** 63.7 ±4.16** 86.3 ±1.01** 75.3 ±2.04**D 14.6 ±1.01 20.4 ±1.25 31.5 ±1.14 43.8 ±1.19 42.7 ±1.15
Tab 2 The effect of bFGF(10 μg·L -1)on the p-ERK in the BMSCs at different time points(% , ± s,n=10)
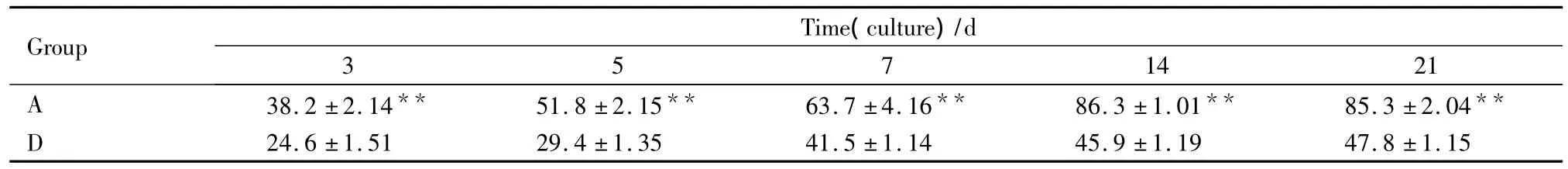
Tab 2 The effect of bFGF(10 μg·L -1)on the p-ERK in the BMSCs at different time points(% , ± s,n=10)
**P<0.01 vs group D
Group Time(culture)/d 14 21 A 3 5 7 38.2 ±2.14** 51.8 ±2.15** 63.7 ±4.16** 86.3 ±1.01** 85.3 ±2.04**D .8 ±1.15 24.6 ±1.51 29.4 ±1.35 41.5 ±1.14 45.9 ±1.19 47

Fig 3 The protein levels of collagenⅠin the BMSCs by immunocytochemistry(×100)

Fig 4 The protein levels of p-ERK in the BMSCs by immunocytochemistry(×100)

Fig 5 The protein expression levels of p-ERK in the BMSCs treated with 10 μg·L -1bFGF at different time points by Western blot
3 讨论
BMSCs由于其在体外易于分离培养和扩增,具有多向分化潜能,是近年来被认为是骨组织工程研究的首选种子细胞[7-8]。bFGF是调控 BMSCs定向分化、促进骨缺损修复和骨折愈合的首选生长因子之一,同时它还是一种强大的毛细血管增殖刺激剂,能为BMSCs生长提供充足的血供和营养。本研究结果表明,BMSCs经bFGF作用后在光镜下可见细胞为矮柱状,细胞之间有突起相连。透射电镜下可见细胞粗面内质网很丰富,并有较多的分泌泡,这些均为成骨样细胞的形态特征。成骨细胞在成骨时可分泌含大量胶原纤维(其化学成分主要是Ⅰ型胶原蛋白)的类骨质。通过RT-PCR和免疫细胞化学方法证明BMSCs在bFGF的作用下,细胞Ⅰ型胶原蛋白和mRNA表达均较对照组高,提示bFGF可以诱导体外培养BMSCs分化为成骨样细胞。
越来越多的研究表明,包括细胞因子在内的胞外刺激信号从细胞膜转导到细胞核内是通过Ras/ERK信号通路来实现细胞对外界环境刺激作出相应的反应,以调控细胞生长、增殖、分化等重要生理过程[9-11]。本研究结果表明,BMSCs在 bFGF 作用较早时期(24 h),用抗ERK抗体进行免疫细胞化学染色发现,细胞内阳性颗粒就高于对照组,随培养时间的延长,阳性细胞比率逐渐增加,至d 14达最高,尤以10 μg·L-1bFGF 作用最强,经 Western blot检测,进一步证明BMSCs经bFGF作用d 14时,p-ERK蛋白表达水平较对照组高2.65倍,有趣的是此时细胞抗Ⅰ型胶原蛋白抗体阳性细胞较对照组高出近1倍,mRNA表达较对照组上调2.21倍,提示bFGF诱发BMSCsⅠ型胶原基因和蛋白的表达,通过ERK信号途径来实现影响其转录和翻译过程。
bFGF通过上调Ras/ERK信号通路诱导BMSCs表达Ⅰ型胶原具有明显的时效关系。但是,对其量效关系进行研究时,却发现 bFGF 在 5、10、20 μg·L-1的浓度范围内,上调ERK表达诱导BMSCs细胞Ⅰ型胶原蛋白和mRNA表达无浓度依赖性差异。本研究仅仅在体外培养条件下初步研究了bFGF对BMSCs细胞Ⅰ型胶原表达的影响及其作用机制。有关成骨细胞分化的其他表型,如钙结合蛋白和碱性磷酸酶的表达以及促进成骨化作用的细胞因子表达及其作用机制仍需做较多的研究工作。
[1] Yoshida A,Noda T,Tani M,et al.The role of basic fibroblast growth factor to enhance fetal intestinal mucosal cell regeneration in vivo[J].Pediatr Surg Int,2009,25(8):691 -5.
[2] Hwang N S,Kim M S,Sampattavanich S,et al.Effects of three-dimensional culture and growth factors on the chondrogenic differentiation of murine embryonic stem cells[J].Stem Cells,2006,24(2):284-91.
[3] Hong B Z,Park S A,Kim H N,et al.Basic fibroblast growth factor increases intracellular magnesium concentration through the specific signaling pathways[J].Mol Cells,2009,28(1):13 -7.
[4] Rabie A B,Lu M.Basic fibroblast growth factor up-regulates the expression of vascular endothelial growth factor during healing of allogeneic bone graft[J].Arch Oral Biol,2004,49(12):1025 -33.
[5] 史永红,任韫卓,赵 松,等.细胞因子信号传导抑制蛋白1对糖基化终末产物诱导的肾小管细胞转分化的影响[J].中国药理学通报,2010,26(2):190 -4.
[5] Shi Y H,Ren Y Z,Zhao S,et al.Influence of SOCS-1 on AGEs-induced renal tubular epithelial-myofibroblast transdifferentiation[J].Chin Pharmacol Bull,2010,26(2):190 - 4.
[6] 袁国强,王玲玲,杨海涛,等.p38 MAPK通路在TNF-α诱导人脐静脉内皮细胞分泌ET-1与eNOS中的作用及通心络干预影响[J].中国药理学通报,2009,25(11):1415 -20.
[6] Yuan G Q,Wang L L,Yang H T,et al.The role of p38MAPK signal pathway in the course of TNF-α inducing HUVEC to secrete ET-1 and eNOS and the effect of Tongxinluo[J].Chin Pharmacol Bull,2009,25(11):1415 -20.
[7] Goessler U R,Riedel K,Hormann K,Riedel F.Perspectives of gene therapy in stem cell tissue engineering[J].Cells Tissues Organs,2006,183(3):169 -79.
[8] Jager M,Feser T,Denck H,Krauspe R.Proliferation and osteogenic diferentiation of mesenchymal stem cells cultured onto three diferent polymers in vitro[J].Ann Biomed Engi,2005,33(10):1319-32.
[9] 柴文戍,王洪梅,张书芹.铜绿假单胞菌通过MAPK信号传导通路诱导U937细胞表达 IL-8[J].中国药理学通报,2009,25(10):1354-8.
[9] Chai W S,Wang H M,Zhang S Q.Roles of mitogen-activated protein kinase pathways during Pseudomonas aeruginosa-induced expression of IL-8 in U937 cells[J].Chin Pharmacol Bull,2009,25(10):1354-8.
[10] Raabe T,Rapp U R.KSR-aregulator and scaffold protein of the MAPK pathway[J].Sci STKE,2002,11(136):pe28.
[11] Murphy D A,Makonnen S,Lassoued W,et al.Inhibition of tumor endothelial ERK activation,angiogenesis and tumor growth by sorafenib(BAY43-9006)[J].Am J Pathol,2006,169(5):1875 -85.
