枇杷叶三萜酸对TGF-β1刺激的人胚肺成纤维细胞转分化及ERK通路的影响
2011-02-27杨雅茹吕雄文熊自忠
杨雅茹,黄 艳,李 俊,吕雄文,金 涌,熊自忠,张 磊,刘 红
(1.安徽医科大学药学院,安徽天然药物活性研究省级实验室,安徽合肥 230032;2.安徽医科大学第一附属医院感染病科,安徽合肥 230022)
肺纤维化(pulmonary fibrosis)是多种病因引起的一种慢性炎性间质性肺疾病,主要病理特点是早期的弥漫性肺泡炎、肺泡上皮受损和后期大量肺成纤维细胞的病理性增生及基质胶原进行性积聚并取代正常的肺组织结构[1]。流行病学调查发现,肺纤维化发病率、死亡率不断上升,5年生存率<50%。目前临床上仍以糖皮质激素和免疫抑制剂及细胞毒性药物为主,但疗效均不理想,且具有明显的毒副作用[2]。肺成纤维细胞的过度增生和分泌胶原在肺纤维化形成过程中扮演了重要的角色。因此,寻找有效药物抑制肺成纤维细胞的过渡增生是防治肺纤维化的重要手段之一。
枇杷叶三萜酸(triterpene acids of loquat,TAL)是从枇杷叶中提取的主要活性部位,具有抗炎、抗氧化、止咳平喘和免疫调节等作用[3-4]。本实验室前期研究发现[5]TAL对慢性支气管炎大鼠有良好的防治作用。近年来又发现其具有抗纤维化的作用,刘娟等[6]研究发现给肺纤维化模型大鼠灌注TAL可有效降低肺内细胞外基质的生成。本实验观察TAL对人胚肺成纤维细胞(HFL-Ⅰ)活化、结缔组织生长因子(connective tissue growth factor,CTGF)、胶原生成及其对ERK通路的影响。
1 材料
1.1 主要药物与试剂人胚肺成纤维细胞(HFL-Ⅰ):中国科学院上海细胞库;TAL由安徽省安泰医药生物技术有限责任公司提供,批号080601,纯度可达到 >80%。MTT(3,4,5-dimethylthiazo-2-yl-2,5-diphenyltetrazolium bromide)粉,美国 Sigma公司产品。DMSO(二甲基亚砜)、碘化丙啶(PI):北京科海军舟有限公司;α-MEM培养液:Gibco公司;胎牛血清:杭州四季青。
1.2 主要仪器Napeo-6100型细胞培养箱,美国杜邦公司产品;PowerPac HC电泳仪,Trans-Blot SD半干转仪器均由伯乐公司生产;酶标仪:美国BD公司;冷冻离心机TGL-18R,珠海黑马医学仪器有限公司产品。PCR扩增仪为Eppendorf公司产品。
2 方法
2.1 枇杷叶三萜酸配制用双蒸水溶解TAL粉剂,加少量无水乙醇(体积分数小于3%)作为助悬剂,用双蒸水配制成 1 g·L-1的母液,0.22 μm 膜过滤除菌,-20℃保存,临用前解冻,2周有效。
2.2 细胞培养将传代细胞接种于含10%胎牛血清α-MEM培养液(100 U·ml-1青、链霉素)的25 cm2培养瓶中,接种浓度为1×109·L-1,置于5%CO2、37℃培养箱中培养。12 h贴壁后,用含0.5%小牛血清的 α-MEM培养液换液,再在5%CO2、37℃培养箱中培养。
2.3 细胞增殖测定(MTT法)根据参考文献[7],用含10%胎牛血清α-MEM培养液调整细胞浓度为1×104/孔接种于96孔板,12 h后换含0.5%小牛血清的培养液培养24 h,实验组加入不同浓度的TAL,其终浓度分别为0.05、0.5、5、50 和500 mg·L-1,对照组只加等量的α-MEM液,每组设7平行孔,将培养板置于5%CO2、37℃培养箱中,2 h之后,模型组和实验组加入细胞刺激因子TGF-β1(终浓度10 μg·L-1),继续培养24、48、72 h,在培养结束前4 h 每孔加入20 μl MTT,吸去上清液,加入 DMSO,每孔200 μl,混匀10 min后,于自动酶标仪570 nm处测定各孔吸光度A值,实验重复3次,根据MTT的吸光度A值计算出MTT细胞增生抑制率。增生抑制率/%=(对照组A值-实验组A值)/对照组A值×100%,实验重复3次,取平均值。
2.4 RT-PCR 法检测各组 HFL-Ⅰ中 CTGF、α-SMA、CⅠ、CⅢ mRNA的表达
2.4.1 总RNA的提取 将 HFL-Ⅰ分5组(n=3/组):对照组、TGF-β1(10 μg·L-1)刺激组、TGF-β1+TAL5、50和500 mg·L-1组。TAL给药后2 h加入 TGF-β1(10 μg·L-1)共培养24 h,采用 TRIzol一步法提取细胞总RNA。
2.4.2 RT-PCR 反应 按照 Promega Corporation提供的Reverse Transcription System进行。引物序列:CTGF(503 bp),forward:5'-CATGCCATGTCTCCGTA CATC-3',reverse:5'-CCGACTGGAAGACACGTTTGG-3';α-SMA(373 bp),forward:5'-GGAAGGACCTCTAT GCTAAC-3',reverse:5'-CATAGGTAACGAGTCAGAG C-3';COL-1(458 bp),forward:5'-TGGTGACAAGGGT GAGACAG-3',reverse:5'-GGATGTTCTCGATCTGCTG G-3';COL-3(493 bp),forward:5'-GAATGCCTGGAGA AAGAGGA-3',reverse:5'-GGGTTACCATTACTACCA GG-3';β-actin(205 bp),forward:5'-CCCACACTGTGC CCATCTACG-3',reverse:5'-GCCATCTCTTGCTCGAA GTCC-3';PCR 扩增反应条件为:94℃,5 min;94℃,40 s;51℃,40 s;72℃,1 min;72℃,10 min,35 个循环。
2.5 Western blot法检测各组 HFL-Ⅰ ERK、p-ERK的蛋白的表达TAL给药后2 h加入TGF-β1(10 μg·L-1)共培养48 h后,弃去培养瓶内培养基,每瓶加入1 ml RIPA裂解液(每1 ml裂解液中加10 μl PMSF),冰上裂解 30 min。4℃,12 000 r·min-1离心 10 min,取上清。加入上样缓冲液,100℃,加热5 min使蛋白变性。每孔上样15 μl总蛋白,进行SDS-聚丙烯酰胺凝胶电泳(浓缩胶电压80V,分离胶120V)。电泳结束后用半干转仪器将蛋白转移到PVDF膜上,电压15V,时间25 min。膜在室温下用含50 g·L-1脱脂奶粉的TBST缓冲液封闭2 h。膜清洗后加入一抗,一抗的稀释浓度为:ERK、p-ERK(1 ∶400 稀释)、β-actin(1 ∶500 稀释),4℃过夜。再分别加入与一抗相匹配的二抗(1∶2 000稀释),室温放置1 h。ECL发光试剂盒显影,分析条带吸光值。
2.6 统计学处理结果以±s表示,使用SPSS 10.0统计软件中单因素方差分析程序检验各组间差异的显著性。
3 结果
3.1 不同浓度的TAL对人胚肺成纤维细胞增殖的影响体外培养人胚肺成纤维细胞,将HFL-Ⅰ按如下分组:对照组、TGF-β1(10 μg·L-1)刺激组、不同浓度的 TAL给药组(TGF-β1刺激 +不同浓度的TAL)。MTT比色法检测结果如下Tab 1,由表中我们可以看出随着TAL浓度的增大,或孵育时间的延长,在570 nm处的吸光度A值都越来越小。由Tab 1分析可以得知,与对照组相比,TGF-β1刺激组HFL-Ⅰ细胞增殖明显(P<0.01)。浓度为50 mg·L-1时变化最明显(P <0.01),500 mg·L-1时抑制率最高。同一浓度TAL作用下与24 h相比较,48 h抑制率差异有显著性(P<0.05)。
Tab 1 Effect of TAL on the proliferation of HFL-Ⅰstimulated by TGF-β1(±s,n=7)

Tab 1 Effect of TAL on the proliferation of HFL-Ⅰstimulated by TGF-β1(±s,n=7)
*P <0.05,**P <0.01,TAL group vs TGF-β1-stimulated group at the same time;△P <0.05,△△P <0.01 vs 24 h group at the same dose;##P <0.01,TGF-β1-stimulated group vs control group
Group Dose/mg·L-1 24 h/A570 48 h/A570 72 h/A570 Control - 0.209 ±0.020 0.217 ±0.016 0.249 ±0.024 TGF-β1 - 0.706 ±0.018## 0.712 ±0.011## 0.717 ±0.032##TAL 0.05 0.701 ±0.031 0.699 ±0.021 0.692 ±0.028*0.5 0.698 ±0.027 0.693 ±0.013* 0.673 ±0.022*5 0.694 ±0.042* 0.690 ±0.010* 0.649 ±0.017**△50 0.607 ±0.035** 0.564 ±0.019**△0.525 ±0.012**△△500 0.594 ±0.036** 0.533 ±0.033**△0.486 ±0.018**△△
不同浓度 TAL对 TGF-β1刺激后 HFL-Ⅰ细胞的抑制率如Fig 1,从图中可知,给药组HFL-Ⅰ增殖的生长抑制率均随着TAL浓度的增大或TAL与HFL-Ⅰ细胞共孵育时间的延长而逐渐增大,呈浓度-时间依赖性。
3.2 TAL 对 TGF-β1 刺激 HFL-Ⅰ后 CTGF、α-SMA、CⅠ、CⅢ mRNA表达的影响采用RT-PCR法进一步检测 TAL 对 TGF-β1(10 μg·L-1)刺激HFL-Ⅰ 后 CTGF、α-SMA、CⅠ、CⅢ mRNA 表达的影响。结果如Fig 2,3所示:与对照组比较,TGF-β1刺激组 HFL-Ⅰ中 α-SMA、CTGF、CⅠ、CⅢ mRNA 明显表达,且差异有显著性(P<0.01)。而与 TGF-β1刺激组比较,TAL(50 mg·L-1)能明显降低α-SMA、CTGF、CⅠ、CⅢ mRNA 的表达(P <0.01)。

Fig 1 Time-inhibition curve of TAL on the proliferation of HFL-Ⅰ stimulated by TGF-β1
3.3 TAL 对 TGF-β1刺激 HFL-Ⅰ后ERK、p-ERK蛋白表达的影响Western blot检测ERK、p-ERK结果如Fig 4所示,TGF-β1刺激 HFL-Ⅰ 48 h后,与对照组比较,TGF-β1刺激组HFL-Ⅰ 的p-ERK蛋白表达明显增加,且差异具有显著性(P<0.01)。与TGF-β1刺激组比较,TAL(50 mg·L-1)组明显抑制了TGF-β1刺激 HFL-Ⅰ后 p-ERK蛋白表达(P<0.01)。
4 讨论
肺纤维化的形成与肺的反复损伤后的过度修复有关,表现为肺细胞外基质(extracellular matrix,ECM)合成与降解稳态失衡,尤其是胶原代谢失衡[8]。ECM过度沉积与许多因素有关,其中细胞因子起到主要调控作用,转化生长因子β1(transforming growth factor-β1,TGF-β1)被认为是一种强效的致纤维化细胞因子,在ECM过度沉积和肺纤维化中起到关键作用[9],因此以 TGF-β1诱导肺成纤维细胞作为体外肺纤维化模型。肺成纤维细胞(FB)是肺纤维化过程的主要效应细胞,其活化、过度增殖及合成胶原等细胞外基质增多是肺纤维化的基本特征。已有研究证实[10],成纤维细胞的活化是肺纤维化形成的关键步骤和中心环节;肺成纤维细胞在病理情况下或受到刺激时表现出增殖、分泌细胞因子、合成大量ECM,这一系列变化被称为成纤维细胞的活化。

Fig 2 Effect of TAL on expression of α-SMA,CTGF,CⅠ,CⅢmRNA in HFL-Ⅰstimulated by TGF-β1(±s,n=3)
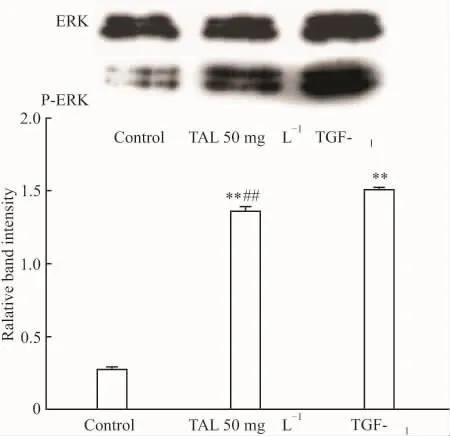
Fig 3 Effect of TAL on expression of ERK,p-ERK protein in HFL-Ⅰstimulated by TGF-β1(±s,n=3)
枇杷叶是蔷薇科枇杷属枇杷的叶,是传统的药用植物。前期研究发现TAL对慢性支气管炎大鼠有良好的防治作用[11],近来研究还提示 TAL具有抗肺纤维化作用[6]。本课题以人胚肺成纤维细胞(HFL-Ⅰ)为研究对象,在体外初步探讨了TAL对HFL-Ⅰ增殖、活化、胶原生成及ERK磷酸化的影响,以进一步研究TAL防治肺纤维化的作用机制。我们选择MTT比色法测定TAL对HFL-Ⅰ的增殖抑制率。结果表明,TAL对HFL-Ⅰ的增殖具有抑制作用,并具有时间依赖性和浓度依赖性。
活化后的成纤维细胞转变为肌成纤维细胞,肌成纤维细胞能表达平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),因此,成纤维细胞表达 α-SMA 是其活化及损伤的标志[12]。已有报道发现[13]TGF-β1诱导成纤维细胞表型转化。另有实验研究表明[14-15]TGF-β1诱导结缔组织生长因子(CTGF)表达,CTGF编码的蛋白具有明显的丝裂原性和趋化性,可诱导肺成纤维细胞增殖分化,从而介导ECM沉积;CTGF刺激细胞后,能够明显促进细胞内ERK1/2的磷酸化。本实验发现,TGF-β1能刺激成纤维细胞α-SMA基因表达,使成纤维细胞转化成肌成纤维细胞;TGF-β1还能刺激成纤维细胞过度表达CTGF、Ⅰ型胶原、Ⅲ型胶原,提示发生表型转变的成纤维细胞能合成和分泌大量胶原等ECM成分,与此同时,TAL(5~500 mg·L-1)可以抑制这一进程。
丝裂素活化蛋白激酶(MAPK)通路是信号从细胞表面转导到细胞内部的重要途径,主要包括ERK、JNK、p38 通路[16-17]。MAPK 家族在调控细胞生长、发育、分裂及细胞间功能的同步性等多种生理功能中起着重要作用。细胞外调节蛋白激酶(ERK)通路是迄今研究最为透彻的一条MAPK信号转导通路,它的激活同许多细胞因子密切相关[18]。前期的动物实验已表明,许多细胞因子及激酶参与了肺纤维化的形成,包括TGF-β1、肿瘤坏死因子(TNF-α)等。越来越多的研究发现,MAPK激酶信号参与了TGF-β1信号转导,TGF-β1同ERK信号通路的活化有密切关系[18-19]。胡永斌等[19]在研究中发现TGF-β1可以使HLF细胞内ERK、p38激酶磷酸化而活化,但没有检测到JNK激酶信号分子的活化。徐芳等[18]通过免疫组化及Western blot蛋白定量的方法研究该通路中重要信号蛋白ERK在肺纤维化大鼠模型肺组织中的表达情况,结果发现各时间段ERK1、ERK2及p-ERK表达明显增加,明显高于同期对照组,说明信号蛋白ERK无论是在早期的肺泡炎,还是在最后的纤维化阶段都发挥了重要作用,提示ERK信号通路参与了肺纤维化的发病过程。本实验我们可观察到,TGF-β1刺激HFL-Ⅰ组p-ERK1/2蛋白表达较对照组明显增加;与TGF-β1刺激组比较,TAL组明显降低了p-ERK1/2蛋白的表达,而ERK无变化。提示,ERK1/2信号途径参与了TGF-β1刺激成纤维细胞活化的过程,并且TAL可能通过抑制ERK1/2蛋白磷酸化这一环节来发挥作用。
综上,TAL能抑制HFL-Ⅰ的增殖,同时也能使活化后 HFL-Ⅰ中的α-SMA生成减少,CTGF、胶原和p-ERK1/2表达降低。提示,TAL可能通过抑制α-SMA基因表达来阻断成纤维细胞向肌成纤维细胞转化;可能通过降低 CⅠ、CⅢ、CTGF的过度表达,减少ECM的沉积;可能通过抑制ERK1/2蛋白磷酸化环节阻断ERK通路等3个机制阻断肺纤维化进程,发挥其抗肺纤维化的作用。
[1] Gross T J,Hunninghake G W.Idiopathic pulmonary fibrosis[J].N Engl J Med,2001,345(7):517-25.
[2] Dempsey O J.Clinical review:Idiopathic pulmonary fibrosis-Past,present and future[J].Respir Med,2006,100(11):1871-85.
[3] 黄 艳,孟晓明,李 俊,等.TAL对慢支模型大鼠肺泡巨噬细胞凋亡的影响及部分机制研究[J].中国药理学通报,2009,25(12):1623-9.
[3] Huang Y,Meng X M,Li J,et al.Effect of TAL and MAPK signal transduction on alveolar macrophage apoptosis and activity of chronic bronchitis rats[J].Chin Pharmacol Bull,2009,25(12):1623-9.
[4] 葛金芳,李 俊,胡成穆,等.枇杷叶三萜酸的免疫调节作用研究[J].中国药理学通报,2006,22(10):1194-8.
[4] Ge J F,Li J,Hu C M,et al.Immunoregulatory actions of triterpene acids loquat leaf(TAL)[J].Chin Pharmacol Bull,2006,22(10):1194-8.
[5] Huang Y,Li J,Wang R,et al.Effect of triterpene acids of Eriobotrya japonica(Thunb.)Lindl.leaf on inflammatory cytokine and mediator induction from alveolar macrophages of chronic bronchitis rats[J].Inflamm Res,2007,56(2):76-82.
[6] 刘 娟,黄 艳,张 磊,等.枇杷叶三萜酸对大鼠肺纤维化预防及抗脂质过氧化作用的研究[J].安徽医科大学学报,2010,45(1):50-3.
[6] Liu J,Li J,Huang Y,Zhang L,et al.Preventive effect of triterpene acids of loquat on lipid peroxidation of pulmonary fibrosis on rats[J].Acta Univ Med Anhui,2010,45(1):50-3.
[7] 修春英,蔡 辉,赵智明,等.溶血磷脂酸对心脏成纤维细胞增殖和胶原合成的影响[J].医学研究生学报,2006,19(7):589-91.
[7] Xiu C Y,Cai H,Zhao Z M,et al.The effects of lysophosphatidic acid on the proliferation and collagen synthesis of cardiac fibroblasts[J].J Med Postgr,2006,19(7):589-91.
[8] A raucous C C,Leon L L.Biological activities of Curcuma longaL[J].Mem Inst Oswald Cruz,2001,96(5):723-8.
[9] 李 杨,王德文,宋良文,等.TGF-β1对肺成纤维细胞中转录因子SP1、AP1和 Smad3、Smad4活性的影响[J].细胞与分子免疫学杂志,2005,21(6):679-82.
[9] Li Y,Wang D W,Song L W,et al.Effects of TGFβ1on the transcriptional activity of SP1,AP1 and Smad3 ~Smad4 in lung fibroblasts[J].Chin J Cell Mol Immunol,2005,21(6):679-82.
[10]李 健,牛建昭.胶原纤维与器官纤维化[J].解剖学报,2003,34(6):662-4.
[10] Li J,Niu J Z.Review of collagen fiber and organic fibrosis[J].Acta Anat Sin,2003,34(6):662-4.
[11] Huang Y,Li J,Meng X M,et al.Effect of triterpene acids of eriobotrya japonica(Thunb.)lindl.leaf on inducible nitric oxide synthase expression in alveolar macrophage of chronic bronchitis rats[J].Am J Chin Med,2009,37:1099-111.
[12] Hall S M,Hislop A A,Wu Z S,et al.Remodelling of the pulmonary arteries during recovery from pulmonary hypertension induced by neonatal hypoxia[J].J Pathol,2004,203:575-83.
[13]谢 冰,叶 纹,沈 玺.转化生长因子-β1对人Tenon囊成纤维细胞表型转化的作用[J].眼科新进展,2006,26(5):344-7.
[13] Xie B,Ye W,Shen X.Effect of transforming growth factor-β1on phenotypic transition of human subconjunctival Tenon's capsule fibroblast[J].Recent Adv Ophthalmol,2006,26(5):344-7.
[14] Riser B L,Denichilo M,Cortes P,et al.Regulation of connective tissue growth factor activity in cultured rat mesangial cells and its expression diabetic glomerulosclerosis[J].J Am Soc Nephrol,2000,11(1):25-38.
[15]黄长海,杨 敏,李惊自,等.结缔组织生长因子通过活化ERK1/2信号通路促成纤维细胞生成[J].中华医学杂志,2005,85:1322-7.
[15] Huang C H,Yang M,Li J Z,et al.Connective tissue growth factor contribute to the growth of myofibroblast by activating ERK1/2 signaling pathway[J].Chin Med J,2005,85:1322-7.
[16]江国林,李 俊,黄 艳,等.丝裂原活化蛋白激酶通路对慢支大鼠肺泡巨噬细胞产生TNF-α的影响及枇杷叶三萜酸的作用机制[J].中国药理学通报,2009,25(5):597-600.
[16] Jiang G L,Li J,Huang Y,et al.Effect of MAPK signal transduction pathway on the expression of TNF-α in alveola R macrophage of chronic bronchitis rats and the target of TAL[J].Chin Pharmacol Bull,2009,25(5):597-600.
[17]杨雅茹,黄 艳,李 俊.TGF-β1介导的Smads与ERK通路在肺纤维化中的作用及相互关系[J].中国药理学通报,2010,26(5):561-3.
[17] Yang Y R,Huang Y,Li J,et al.The relationship between TGF-β1-mediated Smads and ERK in the progression of pulmonary fibrosis[J].Chin Pharmacol Bull,2010,26(5):561-3.
[18]徐 芳,徐启勇,叶燕青.ERK信号通路与肺纤维化中细胞因子相互关系的研究[J].武汉大学学报(医学版),2005,25(5):334-6.
[18] Xu F,Xu Q Y,Ye Y Q.Study on the relationship between ERK signaling pathway and cytokines in pulmonary fibrosis[J].Sect Respir Sys Foreign Med Sci,2005,25(5):334-6.
[19]胡永斌,冯德云,彭劲武,等.转化生长因子-β1和丝裂原活化激酶通路调控人肺成纤维细胞表型[J].中华劳动卫生职业病杂志,2005,23(2):109-12.
[19] Hu Y B,Feng D Y,Peng J W,et al.Transforming growth factor-β1induced phenotypic differentiation ofhuman lung fibroblasts through mitogen activated protein kinase-dependent pathway[J].Chin J Ind Hyg Occup Dis,2005,23(2):109-12.
