五味子甲素对K562/ADR、HL60/ADR、MCF-7/ADR多药耐药逆转机制的研究
2011-02-27秦小清梁宇光高洪志曲恒燕董瑞华吴行伟李海燕刘泽源
秦小清,梁宇光,高洪志,曲恒燕,董瑞华,吴行伟,李海燕,刘泽源
(军事医学科学院附属医院临床药理室,北京 100071)
多药耐药(multidrug resistance,MDR)是恶性肿瘤化疗失败的重要原因之一。绝大多数传统化疗药都对多药耐药肿瘤无效,进而导致化疗失败,成为全世界每年数百万肿瘤患者的死因[1]。20年来,科学家对逆转药开展了广泛深入的研究,其中对30多种不同的P-gp抑制剂做了150多个临床试验,但没有一种P-gp抑制剂被美国FDA批准[2],这些P-gp抑制剂主要缺点是毒副作用大,溶解度差、并且改变化疗药物的药代动力学特征[3],因此,寻找高效低毒的MDR逆转剂有十分重要的意义。
五味子甲素是从五味子果实中分离得到的具有生物活性的木脂素,近年来研究表明五味子甲素有镇咳[4]、抗艾滋病[5]、预防和治疗胃溃疡[6-7]、保肝[8]等药理作用。虽然对其多药耐药方面研究较少,但仍有研究表明五味子粗提物及其有效成分五味子甲素具有逆转多药耐药的效应[9]。研究发现多药耐药除与多药耐药基因mdr1及其产物糖蛋白(P-gp)有关外,多药耐药相关蛋白MRP1与多药耐药也有密切关系,MRP1能将带负电荷的药物分子泵出细胞,而带正电荷的化疗药物须与谷胱甘肽(glutathione,GSH)结合,才能排出胞外,因此减弱P-gp、MRP1的外排功能和降低细胞内GSH含量可能抑制肿瘤细胞的耐药性,本实验中选取P-gp高表达细胞株K562/ADR、MCF-7/ADR和MRP1高表达细胞株HL60/ADR作为研究对象。通过探讨schA对K562/ADR、HL60/ADR、MCF-7/ADR 耐药逆转作用及其逆转机制,为其进一步研究和临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系和细胞培养 人慢性髓系白血病耐药细胞株K562/ADR、人急性粒细胞白血病耐药细胞株 HL-60/ADR、人乳腺癌耐药细胞株 MCF-7/ADR均购自中国医学科学院天津血液研究所。细胞均用含有10%胎牛血清的RPMI1640培养液,在37℃,5%CO2孵育箱中培养,2~3 d换液1次。K562/ADR、MCF-7/ADR细胞培养体系中加入终浓度为0.8 mg·L-1的阿霉素以维持其耐药性,HL-60/ADR细胞培养体系中加入终浓度为0.5 mg·L-1的阿霉素以维持其耐药性。实验前无药培养2周。
1.1.2 试剂 五味子甲素购自成都思科华生物制品有限公司;注射用盐酸多柔比星、注射用柔红霉素、注射用硫酸长春新碱均为浙江海正股份有限公司产品;紫杉醇注射液、氟尿嘧啶注射液均为北京双鹭药业股份有限公司产品;特级胎牛血清为北京元亨金马生物技术开发有限公司产品;RPMI1640培养液为Invitrogen公司产品;鼠抗人P-gp单克隆抗体为eBioscience公司产品;罗丹明123为美国Sigma公司产品;RealMasterMix(SYBR Green)、cDNA第一链合成试剂盒、RNA提取试剂盒均为天根生物技术公司产品;人谷胱苷肽试剂盒为R&D公司产品;引物如下:MDR1上游引物为5'-CCCATCATTGCAATAGCAGG-3',下游引物5'-GTTCAAACTTCTGCTCCTCA-3',片段长:157 bp;MRP1上游引物为5'-GGACCTGGACTTCGTTCTCA-3',MRP1下游引物5'-CGTCCAGACTTCTTCATCCG-3',片段长:292 bp;β-actin上游引物 5'-TGCACAACGGCTCCGGCA-3',β-actin下游引物为 5'-AAGGTGTGGTGCCAGATTTTC-3'。片段长:390 bp。
1.1.3 主要仪器设备 CO2培养箱购自德国Heraeus公司;CliniBio128酶标仪,荷兰雷勃公司产品;多功能显微镜 OLYMPUS产品;高速离心机LDZ4-0.8型,购自北京医用离心机厂;FACSCalibur型流式细胞仪为美国Becton Dikinson公司产品;Real-time PCR仪购自美国罗氏公司。
1.2 方法
1.2.1 MTT法筛选schA的无毒剂量以及检测对耐药细胞的逆转情况 用MTT法检测活细胞数量来反映各化疗药物对肿瘤细胞的生长抑制作用及五味子甲素对各细胞的耐药逆转作用。收集对数生长期的细胞,以每孔 90 μl(K562、K562/ADR、MCF-7、MCF-7/ADR含1×104个细胞;HL60、HL60/ADR含2×104个细胞)接种于96孔培养板中,然后加各种化疗药物 10 μl,作用 48 h 后,每孔加 5 g·L-1MTT 10 μl,37℃ ,孵育 4 h,终止培养,每孔加 10%SDS 100 μl,置摇床低速震荡 10 min,使结晶物充分溶解。在酶标仪550 nm波长处测量和和记录各孔吸光度(OD值)。

1.2.2 流式细胞仪检测schA对各细胞内DNR、罗丹明123胞内蓄积和对细胞表面P-gp蛋白表达的影响 取对数生长期的细胞(密度为5×108cells·L-1)在含有 2 mg·L-1柔红霉素、2 mg·L-1罗丹明123(Rh123)及不同浓度的schA培养基中,37℃ 条件下避光孵育60 min,空白对照组加入等体积的培养液,细胞以冰冷的PBS液洗两遍,以流式细胞仪检测细胞内的平均荧光强度(mean fluorescence intensity,MFI)。取对数生长期的细胞(密度为5×108cells·L-1),在不同浓度schA培养基中37℃条件下避光孵育24 h,冰冷的PBS液洗两遍后,加P-gp单克隆抗体UIC-2,4℃冰孵30 min,PBS液洗两遍后流式检测抗体的荧光强度。柔红霉素、P-gp单克隆抗体流式细胞术激发波长为:488 nm,发射波长为:575 nm;罗丹明123流式细胞术激发波长为:488 nm,发射波长为:538nm。
1.2.3 Real-time PCR法 考察不同剂量的 schA对细胞内mdr1、mrp1 mRNA表达的影响。
采用TRIzol一步法总RNA提取试剂盒提取细胞总RNA。将总RNA逆转录成cDNA,37℃反应60 min。采用染料法(SYBR Green realMasterMix)进行Real-time PCR方法对不同样品中mdr1、mrp1基因表达进行分析,用β-actin为内标,PCR扩增体系:SYBR Green realMasterMix:10 μl,ddH2O:7 μl,正反引物各1 μl,cDNA:1 μl共20 μl。mdr1、mrp1、β-actin反应条件:热启动95℃ 2 min,94℃变性15 s,56℃退火15 s,72℃延伸30 s,共循环30次后绘制溶解度曲线,经多次预试验结合溶解曲线摸索最佳反应条件,采用各自的荧光阈值循环数(CT值),每个样品重复3次,取其平均值,利用2-△△ct方法进行相对定量分析,计算基因表达的变化。
1.2.4 人谷胱甘肽试剂盒检测 schA对 K562/ADR、HL60/ADR细胞内GSH含量的影响 取对数生长期细胞,调细胞浓度为1.0×109cells·L-1,分为细胞无药组及细胞加药处理组。培养4 h后收集细胞,PBS洗涤后悬浮于1 ml PBS中,液氮中反复冻存细胞3次,50 HZ超声破碎细胞,1 500 r·min-1离心10 min后留取上清。实验按试剂盒说明书操作,显色反应后测定吸光度,450 nm波长处测定各孔的吸光度值(OD值),根据标准品的浓度及对应的OD值计算出标准曲线,再根据样品的OD值计算出对应的样品浓度,计算各实验细胞GSH含量,实验重复3次。
2 结果
2.1 schA 对 K562/ADR、HL60/ADR、MCF-7/ADR细胞的无毒剂量筛选为尽量减少schA本身的细胞毒作用,与其他化疗药合用时,schA的剂量范围应设定为:抑制率<10%。SchA对各细胞无毒剂量筛选结果为 K562/ADR:80 μmol·l-1;HL60/ADR:40 μmol·L-1;MCF-7/ADR:60 μmol·L-1。
2.2 schA与各药物联合应用后对 K562/ADR、HL60/ADR细胞的逆转效应MTT实验结果显示,schA逆转了P-gp高表达细胞K562/ADR对DOX、DNR、VCR、PTX 的耐药性(P <0.05),schA 对逆转VCR的耐药效应最强,对逆转PTX的耐药效应较差,而对5-FU没逆转作用,推测5-FU可能不是P-gp的底物(Tab 1)。
在MRP1高表达细胞株HL60/ADR中,schA对嗯环类(DOX、DNR),长春新碱抗肿瘤药物表现很好的耐药逆转效果(P<0.01),这与逆转P-gp高表达细胞株相似,但是对紫杉类及氟尿嘧啶的逆转效果较差,逆转效果明显低于P-gp高表达细胞株,推测紫杉醇,氟尿嘧啶可能不是MRP1的作用底物(Tab 2)。
Tab 1 The reversal folds of schA with DNR,DOX,5-FU,VCR,PTX for 48 h in K562/ADR(±s,n=3)

Tab 1 The reversal folds of schA with DNR,DOX,5-FU,VCR,PTX for 48 h in K562/ADR(±s,n=3)
*P <0.05,**P <0.01 vs control cells
Concentration/μmol·L -1K562/ADR IC50/mg·L -1Reversal fold DNR control 17.7 ±7.2 -DNR+schA 20 0.47 ±0.27** 37.7 schA 50 0.12 ±0.06** 147.5 DOX control 28.9 ±12.5 -DOX+schA 20 1.92 ±0.94** 15.05 schA 50 0.38 ±0.26** 76.1 5-FU control 19.6 ±10.4 -5-FU+schA 20 19.3 ±11.3 1.01 schA 50 18.7 ±9.1 1.04 VCR control 14.58 ±7.3 -VCR+schA 20 0.11 ±0.09** 132.5 schA 50 0.09 ±0.07** 162 PTX control 1.06 ±1 -PTX+schA 20 0.62 ±0.45 1.7 schA 50 0.26 ±0.24*4
Tab 2 The reversal folds of schA with DNR,DOX,5-FU,VCR,PTX for 48h in HL60/ADR(±s,n=3)

Tab 2 The reversal folds of schA with DNR,DOX,5-FU,VCR,PTX for 48h in HL60/ADR(±s,n=3)
**P<0.01 vs control cells
Concentration/μmol·L -1HL60/ADR IC50/mg·L -1Reversal fold DNR control 13.4 ±5.7 -DNR+schA 20 0.91 ±0.43** 14.7 schA 40 0.30 ±0.17** 44.2 DOX control 11.7 ±4.9 -DOX+schA 20 1.19 ±0.64** 9.8 schA 40 0.28 ±0.15** 41.2 5-FU control 4.9 ±1.6 -5-FU+schA 20 4.7 ±2.2 1.04 schA 40 4.6 ±1.8 1.06 VCR control 13.6 ±2.6 -VCR+schA 20 0.57 ±0.23** 23.5 schA 40 0.21 ±0.10** 63.7 PTX control 0.96 ±0.44 -PTX+schA 20 0.9 ±0.32 1.05 schA 40 0.86 ±0.27 1.1

Fig 1 Dose-dependent effects of the schA on the intracellular DNR accumulation in MDR cell(±s,n=3)
2.3 不同浓度schA与柔红霉素(DNR)合用后对各细胞内DNR含量的影响2 mg·L-1DNR与不同浓度的 schA与 K562/ADR、HL60/ADR、MCF-7/ADR在37℃孵育箱共孵育60 min,流式细胞仪结果可看出随着schA浓度的增加,细胞内DNR荧光强度依次增强,而且有明显的剂量依赖性,说明schA能增加DNR在P-gp高表达的和MRP1高表达耐药细胞内的积蓄(Fig 1)。
2.4 不同浓度schA与罗丹明123(Rh123)合用后对K562/ADR、MCF-7/ADR细胞内Rh123含量的影响Rh123 是被公认的 P-gp 的底物,5 μmol·L-1的Rh123与不同浓度的schA共孵育60 min,schA能增加P-gp高表达细胞株K562/ADR、MCF-7/ADR的Rh123蓄积,推测schA是通过影响P-gp蛋白来增加细胞内的药物浓度,由于schA作用时间时间之短(60 min),推测schA是可以通过抑制P-gp功能或改变P-gp结构来增加细胞内药物浓度(Fig 2)。
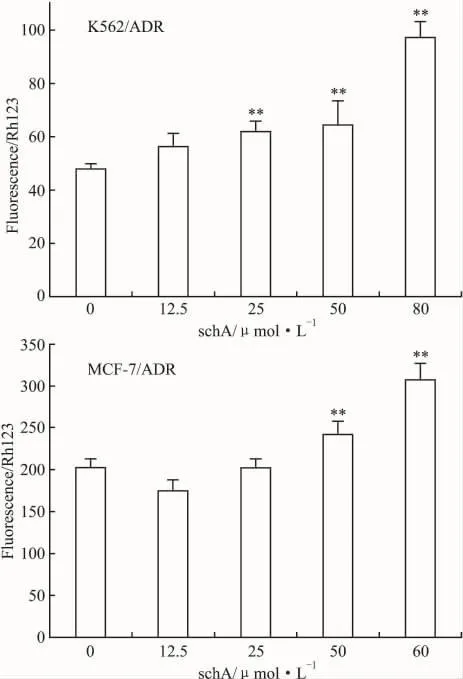
Fig 2 Dose-dependent effects of the schA on the intracellular Rh123 accumulation in K562/ADR,MCF-7/ADR cells by flow cytometry(±s,n=3)
2.5 Sch A对P-gp蛋白表达的影响流式细胞仪检测K562/ADR细胞中P-gp表达的变化,与未经schA作用的K562/ADR相比,随schA剂量增加,P-gp表达水平逐渐下降,而且有明显的剂量依赖性(Fig 3)。

Fig 3 Dose-dependent effects of the schA on the expression of P-gp in K562/ADR cells by flow cytometry(±s,n=3)
2.6 Sch A对K562/ADR细胞内mdr1及HL60/ADR胞内mrp1 mRNA表达的影响无毒剂量的schA分别作用于K562/ADR、HL60/ADR 24 h,通过Real-time PCR仪扩增后,发现随着schA浓度的增加,mdr1、mrp1基因表达与对照组相比随之降低,并呈剂量依赖性(Fig 4)。
2.7 不同浓度 Sch A作用不同时间后 K562/ADR、HL60/ADR细胞内GSH含量的影响实验发现随着 schA浓度的增加可影响 K562/ADR、HL60/ADR细胞内的 GSH含量,推测 schA逆转HL60/ADR细胞的耐药性可能是通过抑制MRP介导的GSH-药物外排泵发挥作用。
Tab 3 Dose-dependent effects of the schA on the GSH content in K562/ADR,HL60/ADR cells by human GSH ELISA kit(±s,n=3)

Tab 3 Dose-dependent effects of the schA on the GSH content in K562/ADR,HL60/ADR cells by human GSH ELISA kit(±s,n=3)
**P<0.01 vs control cells
Group Concentration/μmol·L -1 GSH Concentration/U·L -1 K562/ADR HL60/ADR Control - 187.2 ±16.3 193.0 ±14.2 SchA 10 - 167.3 ±21.6 20 174.6 ±23.4 166.4 ±25.3 40 - 144.6 ±30.5**50 156.3 ±14.1 -80 137.1 ±26.5**-
3 讨论
化疗是恶性肿瘤的主要治疗手段之一,但MDR出现往往导致了化疗的失败。耐药逆转剂的筛选便成为当前的重要研究课题。

Fig 4 Dose-dependent effects of the schA on the expression of MDR1,MRP1 in K562/ADR,HL60/ADR cells by Real-time PCR( ± s,n=3)
本实验已经显示了schA可以作为临床MDR逆转剂的一些重要药理学特征,如:MTT实验结果显示无毒剂量的schA在K562/ADR、HL60/ADR细胞中对作用机制不同的化疗药物 VCR、PTX、DNR、DOX、5-FU显示了不同的逆转效应,结果显示schA与化疗药物合用有效的前提是化疗药物是P-gp、MRP1的底物。无毒剂量的schA可以直接作用于细胞膜的 P-gp、MRP1,抑制 P-gp、MRP1的外排作用。本实验还发现无毒剂量的schA与K562/ADR、HL60/ADR作用后可降低细胞内GSH含量,推测schA可能通过与GSH结合或影响GSH的合成,来降低细胞GSH含量,进而降低由MRP1介导的药物外排。综上所述,schA具备逆转耐药的活性,有可能成为克服肿瘤化疗中多药耐药现象的一种新的解决方案。
[1] Oza A M.Clinical development of P-glycoprotein modulators in oncology[J].Novartis Found Symp,2002,243:103 - 15.
[2] Peer D,Margalit R.Fluoxetine and reversal of multidrug resistance[J].Cancer Lett,2006,237(2):180 -7.
[3] Li X J,Zhao B L,Liu C T,et al.Scavenging effects on active oxygen radicals by schizandrins with different structures and configurations[J].Free Radic Biol Med,1990,9(2):99 -104.
[4] 田仁荣,肖伟烈,杨柳萌,等.红花五味子甲素的分离纯化及其抗 HIV-1活性的研究[J].中国天然药物,2006,4(1):40 -4.
[4] Tian R R,Xiao W L,Yang L M,et al.The isolation of rubrifloralignan A and its anti-HIV-1 activities[J].Chin J Nat Med,2006,4(1):40-4.
[5] Kuo Y H,Kuo L M,Chen C F.Four new C19 homolignans,schiarisanrins A,B,and D and cytotoxic schiarisanrin C,from schizandra arisanensis[J].J Org Chem,1997,62(10):3242 -5.
[6] 倪立东,陈延西.五味子药理作用研究概况[J].暨南大学学报,1996,17(2):125 -7.
[6] Ni L D,Chen Y X.Pharmacological research progress of Fructus schisandrae[J].J Jinan Univ,1996,17(2):125 -7.
[7] 张明华,陈 虹,李灵芝,等.五味子甲素和五味子醇甲对四氯化碳所致肝脏损伤的保护作用[J].武警医学,2002,13(7):395-6.
[7] Zhang M H,Chen H,Li L Z,et al.Deoxyschizandrin and schizandrin protect liver against carbon tetrachloride induced damage[J].Med J Chin People's Armed Police Forces,2002,13(7):395 -6.
[8] Huang M,Jing J,Hua S,et al.Reversal of P-glycoprotein-mediated multidrug resistance of cancer cells by five schizandrins isolated from the Chinese herb Fructus Schizandrae[J].Cancer Chemother Pharmacol,2008,62(6):1015 -26.
