α-synuclein过表达下调Nurr1转录活性的机制研究
2011-02-27苑玉和孙建栋陈乃宏
赵 明,苑玉和,金 金,孙建栋,陈乃宏
(中国医学科学院·北京协和医学院药物研究所,北京 100050)
帕金森病 (Parkinson’s disease,PD)是一种常见的神经退行性疾病,其主要临床表现症状为静止性震颤、运动迟缓和强直[1]。PD患者的典型神经病理学特征为中脑黑质多巴胺能神经元进行性变性缺失,神经元胞质内存在大量的路易小体,而α-突触核蛋白(α-synuclein)是路易小体的主要组成成分[2]。目前已有研究发现[3],α-synuclein 过表达后能够引发多巴胺能神经元凋亡,但是其具体机制尚未完全明确。
核受体相关因子-1(Nurr1)是一种在中脑多巴胺能神经元中表达的核受体转录因子,属于核甾体/甲状腺激素受体超家族成员。Nurr1在多巴胺能系统的发育和功能维持中发挥关键作用,而且与帕金森病发病密切相关[4]。同时一些流行病学研究发现[5],无论是在家族性还是散发性PD中,Nurr1基因异常均为危险因素。
已有研究表明[6-7],多巴胺能神经元过表达 αsynuclein会影响多巴胺合成和转运通路。而Castelo-Branco等[8]在中脑前体细胞研究中发现,GSK3β/β-catenin通路调节着Nurr1转录活性,从而影响前体细胞向神经元的分化。其中 GSK3β(Ser9)磷酸化水平降低和 β-catenin表达水平降低可抑制Nurr1转录活性。
鉴于Nurr1在多巴胺合成和储存的调控中发挥关键作用,我们初步研究了α-synuclein与Nurr1之间的关系,并针对其机制进行初步探讨。
1 材料与方法
1.1 质粒及细胞Nurr1荧光素酶报告基因pGal4-NBRE质粒载体由Thomas Perlmann教授惠赠(瑞典路德维格癌症研究所)[9],其中嵌入Nurr1结合反应元件序列(Nurr1 binding response elements,NBRE),当转录因子Nurr1与其反应元件序列NBRE结合时,即可启动荧光素酶的合成,从而可以通过检测荧光素酶活力反映Nurr1的转录活性。pEGFP-N1-αsynuclein质粒载体为本室构建[10],pEGFP-N1 质粒载体、pRL-TK海肾荧光素酶表达载体和PC12细胞为本室保存。
1.2 试剂胎牛血清购自Hyclone公司,DMEM细胞培养基购自Gibco公司,试验耗材购自Corning公司。双荧光素酶检测试剂盒购自威格拉斯生物有限公司,转染试剂LipofectamineTM2000购自Invitrogen公司。化学发光检测试剂购自普利莱公司。抗αsynuclein,β-actin,p-GSK3β/GSK3β 抗体购自Santa Cruz公司,抗β-catenin抗体购自CST公司。
1.3 仪器ECL检测系统Fuji LAS3000,化学发光酶标检测仪Molecular Device(Lmax),酶标仪MDC SPECTRAMAX 190。
1.4 细胞培养PC12细胞:5%胎牛血清和5%马血清的DMEM培养基,于37℃,5%CO2培养箱中培养。
1.5 双荧光素酶法检测PC12细胞接种培养24 h后,采用转染试剂 LipofectamineTM2000,向 PC12细胞转染双荧光素酶报告基因质粒载体(900ng pGal4-NREB和100ng pRL-TK)以及1 μg测试基因质粒载体(pEGFP-N1或 pEGFP-α-synuclein)。转染 24 h后裂解细胞,根据双荧光素酶检测试剂盒说明书进行检测。
1.6 免疫印迹检测PC12细胞转染24 h后,采用1%NP-40细胞裂解液进行裂解30 min后,于4℃12000 r·min-1下离心30 min。使用BCA定量试剂盒进行蛋白定量后,加入上样缓冲液煮沸变性。30 μg蛋白经15%SDS-PAGE胶分离后转移至PVDF膜上,3%BSA室温封闭2 h,加入一抗4℃过夜,TBS-Tween洗涤3次后加入HRP标记的二抗,室温孵育2 h,再经TBS-Tween洗涤3次后加上ECL发光液进行检测。
1.7 统计学分析所有数据均采用±s表示,t检验进行组间差异显著性分析。
2 结果
2.1 α-synuclein过表达对Nurr1转录活性的影响双荧光素酶检测实验中所用质粒载体如Fig 1A所示,其中报告基因载体为pGal4-NBRE和pRL-TK质粒,测试基因质粒载体分别为pEGFP-N1空载体质粒或 pEGFP-N1-α-synuclein质粒。转染24 h后,进行双荧光素酶活性检测。如 Fig 1B所示,与MOCK组(转染pEGFP-N1空载体)相比,α-synuclein组(转染pEGFP-N1-α-synuclein)Nurr1转录活性明显下降,仅为 MOCK组的45%(P<0.01 vs MOCK group)。
2.2 α-synuclein过表达对Nurr1蛋白表达水平的影响如Fig 2A所示,α-synuclein过表达后Nurr1蛋白表达水平没有明显变化。通过对Fig 2A Western blot结果中Nurr1条带进行灰度扫描后统计,如Fig 2B所示,α-synuclein过表达组与MOCK组之间差异无显著性。这说明α-synuclein过表达对Nurr1蛋白表达水平无影响。
2.3 α-synuclein 过表达对 GSK3β/β-catenin 信号通路蛋白表达的影响GSK3β/β-catenin通路对Nurr1转录活性发挥正向调节作用。GSK3β(Ser9)磷酸化水平和 β-catenin含量降低可抑制Nurr1转录活 性[8]。针对 GSK3β/β-catenin 通路蛋白的Western blot结果显示,α-synuclein过表达后,GSK3β(Ser9)磷酸化水平及β-catenin蛋白含量均下降(Fig 3A)。通过对 Fig 3A中 p-GSK3β及 βcatenin条带进行灰度扫描后统计,如Fig 3B所示,与MOCK组相比,α-synuclein过表达组上述3种蛋白表达水平明显降低,其中GSK3β磷酸化水平下降50%(P<0.01 vs MOCK组),β-catenin含量下降32%(P<0.05 vs MOCK组)。这表明 α-synuclein过表达后明显降低GSK3β磷酸化水平和β-catenin含量,从而可能导致Nurr1转录活性下降。

Fig 1 Effect of α-synuclein overexpression on Nurr1 transcriptional activity in PC12 cells(±s,n=3)
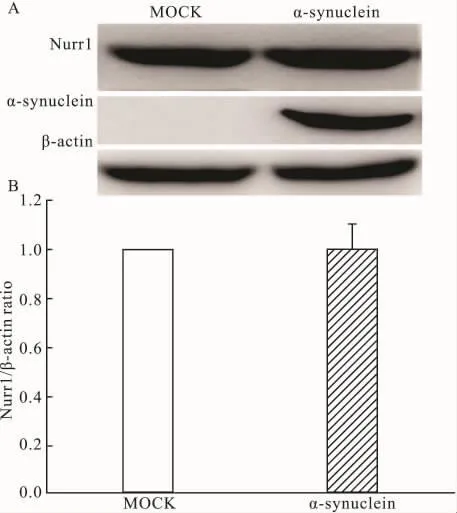
Fig 2 Effect of α-synuclein overexpression on Nurr1 protein expression level in PC12 cells(±s,n=3)

Fig 3 Effect of α-synuclein overexpression on GSK3β/β-catenin pathway in PC12 cells(±s,n=3)
3 讨论
近期研究发现,多巴胺神经元核受体转录因子Nurr1在多巴胺神经元的发育、分化及表型维持中发挥着重要作用[4]。基因敲除研究表明,Nurr1基因敲除纯合子小鼠(Nurr1-/Nurr1-)无法在中脑产生多巴胺能神经元;而Nurr1基因敲除杂合子小鼠(Nurr1+/Nurr1-)与正常小鼠相比则表现出旋转和运动能力明显下降。
Nurr1在多巴胺合成和储存调控中发挥重要作用的蛋白表达,包括酪氨酸羟化酶(TH)、多巴胺转运体(DAT)、囊泡单胺转运体(VMAT2)和芳香氨基酸左旋脱氢酶(AADC)的表达。Lotharius等[6]发现采用在分化型MESC2.10细胞中过表达突变型αsynuclein(A53T)后,细胞内DAT与VMAT2的表达均降低50%左右[6]。Baptista 等[7]发现在神经母细胞瘤细胞中转染野生型或突变型 α-synuclein(A30P/A53T)后,TH mRNA和蛋白表达水平明显降低,芳香族氨基酸脱羧酶mRNA水平明显下降。
本研究发现,α-synuclein过表达使Nurr1转录活性明显下降,这为解释α-synuclein过表达对多巴胺合成和转运通路产生广泛的影响提供了一些证据。但进一步研究发现α-synuclein过表达并未影响Nurr1蛋白表达水平。针对Nurr1转录活性调控的研究表明,在中脑前体细胞中 GSK3β/β-catenin通路调节Nurr1转录活性,从而影响前体细胞向神经元的分化。其中GSK3β(Ser9)磷酸化水平降低和β-catenin蛋白水平下降可抑制 Nurr1转录活性[8]。Kitagawa等[11]发现 β-catenin 与 Nurr1 在多种水平上存在着功能上的相互作用。
不同氨基酸位点磷酸化对其活性具有不同的调节作用。GSK3β蛋白Tyr216位点为兴奋性磷酸化位点,Tyr216位点磷酸化后可激活GSK3β,并导致β-catenin降解。GSK-3β蛋白Ser9位点为抑制性磷酸化位点,Ser9位点磷酸化后可抑制GSK3β活性,从而抑制β-catenin降解。因此,GSK3β(Ser9)磷酸化水平下降使GSK3β蛋白处于激活状态,从而导致β-catenin降解[12]。本研究发现,在过表达 α-synuclein后,GSK3β(Ser9)磷酸化水平降低,同时 βcatenin蛋白水平下降,这可能是导致Nurr1转录活性下调的原因。
近年来许多研究关注GSK3β在神经退行性疾病中的重要作用[13]。已有研究发现[8],提高GSK3β(Ser9)磷酸化水平可增加β-catenin含量,从而上调Nurr1转录活性,增加神经元前体细胞分化为具有多巴胺神经元表型的比例。因此开发针对GSK3β的药物对维持帕金森病多巴胺细胞移植疗法中神经干细胞分化具有重要意义。
综上所述,本研究表明α-synuclein过表达可能通过抑制GSK3β/β-catenin通路,下调Nurr1转录活性,为阐明研究α-synuclein在帕金森氏病发病机制中的作用提供部分理论证据。
[1] Nutt J G,Wooten G F.Diagnosis and initial management of Parkinson's disease[J].N Engl J Med,2005,353:1021 - 7.
[2] Spillantini M G,Schmidt M L,Lee V M,et al.Alpha-synuclein in Lewy bodies[J].Nature,1997,6645:839 -40.
[3] Masliah E,Rockenstein E,Veinbergs I,et al.Dopaminergic loss and inclusion body formation in α-synuclein mice:Implications for neurodegenerative disorders[J].Science,2000,278:1265 -7.
[4] Jankovic J,Chen S,Le W D.The role of Nurr1 in the development of dopaminergic neurons and Parkinson’s disease[J].Prog Neurobiol,2005,77:128 -38.
[5] Le W D,Pan T H,Huang M S,et al.Decreased Nurr1 gene expression in patients with Parkinson’s disease[J].Neurol Sci,2008,273:29 -33.
[6] Lotharius J,Barg S,Wiekop P,et al.Effect of mutant alpha-synuclein on dopamine homeostasis in a new human mesencephalic cell line[J].J Biol Chem,2002,277:38884 -94.
[7] Baptista M J,O'Farrell C,Daya S,et al.Co-ordinate transcriptional regulation of dopamine synthesis genes by alpha-synuclein in human neuroblastoma cell lines[J].J Neurochem,2003,85:957-68.
[8] Castelo-Branco G,Rawal N,Arenas E.GSK-3beta inhibition/beta-catenin stabilization in ventral midbrain precursors increases differentiation into dopamine neurons[J].J Cell Sci,2004,117:5731-7.
[9] Volakakis N,Malewicz M,Kadkhodai B,et al.Characterization of the Nurr1 ligand-binding domain co-activator interaction surface[J].J Mol Endocrinol,2006,37:317 -26.
[10]马开利,苑玉和,胡金凤,等.α-synuclein C端截短体的胞内分布[J].中国药理学通报,2010,26(1):36 -9.
[10] Ma K L,Yuan Y H,Hu J F,Sun J D,et al.Distribution of α-synuclein truncation in cell[J].Chin Pharmacol Bull,2010,26(1):36-9.
[11] Kitagawa H,Ray W J,Glantschnig H,et al.A regulatory circuit mediating convergence between Nurr1 transcriptional regulation and Wnt signaling[J].Mol Cell Biol,2007,27:7486 - 96.
[12] Ter-Haar E,Coll J T,Austen D A,et al.Structure of GSK3β reveals a primed phosphorylation mechanism[J].Nat Struct Biol,2001,8(7):593 -6.
[13] Kaytor M D,Orr H T.The GSK3b signaling cascade and neurodegenerative disease[J].Curr Opin Neurobiol,2002,12:275 - 8.
