杜仲叶多酚的提取及分离工艺研究
2011-02-20董文宾许先猛
董文宾, 许先猛
(陕西科技大学生命科学与工程学院, 陕西 西安 710021)
0 前 言
杜仲(EucommiaulmoidesOliv),我国特有的珍稀濒危保护植物.杜仲中含杜仲胶、京尼平苷、绿原酸、槲皮素、山柰醇等多种活性成分,具有消炎抑菌、抗疲劳、抗衰老、降血压、降血脂、补肾、安胎等诸多功效[1].研究证明[2,3],杜仲皮与叶有着相似的化学成分和药理作用,其各类物质的多酚成分陆续被国内外学者所研究[4,5].有关杜仲叶中的多酚物质研究的报道很少,相关文献大多是对绿原酸的提取和纯化.本论文应用超声法和浸提法对杜仲叶中多酚物质的提取条件进行了考察与优化,并且比较了各自的优缺点,为杜仲叶综合利用提供一定的理论依据,同时对杜仲叶多酚粗提物进行了初步分离纯化,也为多酚类物质的分离纯化工作奠定了一定的基础.
1 实验材料与方法
1.1 材料与仪器
原料:杜仲叶(采自陕西略阳),阴干,粉碎过40目筛.
试剂:没食子酸标准品,贵州遵义佳宏化工有限责任公司,纯度98%;福林酚,美国Sigma公司;无水碳酸钠,分析纯,天津市百世化工有限公司.
仪器:JY92-Ⅱ超声细胞粉碎机,宁波新芝生物科技股份有限公司;754PC型紫外可见分光光度计及722型可见分光光度计,上海光谱仪器有限公司;BS-224型电子天平,德国SARTORIUS公司;微量移液器,芬兰Dragonmed 公司;RE-52AA型旋转蒸发器及SHZ-Ⅲ循环水多用真空泵,上海亚荣生化仪器厂;DZ-1BC真空干燥箱,天津泰斯特仪器有限公司.
1.2 实验方法
1.2.1 工艺流程
杜仲叶→阴干→粉碎过筛→称取→超声提取/浸提→过滤→浓缩→干燥→粗提物
└→吸附→解吸→干燥
1.2.2 操作要点
(1)原料选择.杜仲叶采自陕西略阳.
(2)提取.提取过程中,超声和浸提的热量会使乙醇提取液有不同程度的挥发,对实验结果有一定的影响,因此在实验过程中需制作带孔塑料薄膜对提取容器进行密封.
(3)浓缩.浓缩过程中温度不超过50℃,根据乙醇溶液浓度确定真空度.
(4)吸附.杜仲叶用40%乙醇进行提取,提取液浓缩至适当浓度(不含乙醇),离心,取上清液沿柱壁缓缓加入装有树脂的柱中,至流出液颜色和加入浓缩液颜色基本相同,静置吸附24 h.
(5)解吸附.分别采用不同浓度乙醇对大孔树脂吸附柱进行洗脱.
(6)干燥.真空减压干燥,温度为50℃.
(7)检测.以试剂空白做参比进行吸光度的测定,测定过程中若吸光度过大则进行一定比例的稀释.
1.2.3 单因素实验
超声法选取超声功率、超声时间、乙醇浓度、料液比数等单因素进行实验,考察各因素对多酚得率的影
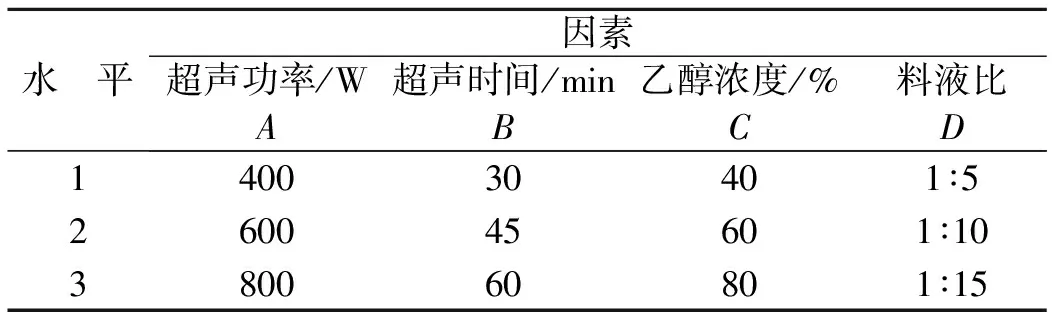
表1 多酚超声法提取实验因素水平表
响;浸提法选取浸提温度、时间、乙醇浓度、料液比等单因素进行实验,考察各因素对多酚得率的影响.
1.2.4 正交试验
本实验采用L9(34)正交表,超声法采用用超声功率、超声时间、乙醇浓度、料液比4个因素做正交试验,各因素选取3个水平,实验因素水平表见表1;浸提法采用浸提温度、浸提时间、乙醇浓度、

表2 多酚浸提法提取实验因素水平表
料液比4个因素做正交试验,选取3个水平,实验因素水平表见表2.
1.2.5 测定方法[6]
(1)标准溶液的制备与标准曲线的制作.准确称取没食子酸标准品0.102 0 g,用蒸馏水溶解并定容至100 mL,制成没食子酸标准储备液.用移液管分别移取1.0、2.0、3.0、4.0、5.0 mL没食子酸标准储备液于100 mL容量瓶中,定容,浓度分别为10、20、30、40、50 μg/mL.
分别取上述不同浓度溶液1 mL加到10 mL容量瓶中,在每个容量瓶中分别加入5.0 mL的10%福林酚试剂,摇匀.反应6 min后,加入4.0 mL 7.5%碳酸钠溶液,加水定容至刻度,摇匀.室温下放置60 min.以试剂空白为参比,在500~900 nm之间扫描最大吸收峰,确定最大吸收波长在766 nm处.在766 nm处测定标准溶液,由浓度对吸光度进行回归求得标准曲线,得到没食子酸浓度C(μg/mL)与吸光度A的关系的回归方程为:y=0.022 2x+0.016 8(R2=0.999).
(2)杜仲叶多酚的测定.吸取1 mL样液,按合适比例稀释后按上述方法测定.以试剂空白作参比测吸光度,根据标准曲线计算样液多酚得率.多酚得率=[m1/(m总×106)]×100%,式中m1=(109.890 1A-0.033 0)×稀释倍数×V提取液,m总为所取原料质量(g).
2 结果与讨论
2.1 单因素实验
2.1.1 超声功率对多酚得率的影响
在超声时间45 min,料液比1∶15,乙醇浓度60%条件下提取两次,超声功率对多酚得率的影响如图1所示.
由图1可以看出,超声功率在200~400 W内,杜仲叶多酚得率随超声功率的增加有所提高;当超声功率大于400 W时,总多酚提取量开始随超声功率的增加而逐渐降低.可能因为随着超声功率增大,当超过400 W时产生的热量(温度超过58 ℃)使杜仲叶多酚物质结构发生变化,从而使多酚得率降低.综合考虑,本实验选择超声功率为400 W.
2.1.2 浸提温度对多酚得率的影响
在浸提时间1 h,料液比1∶15,乙醇浓度60%条件下提取两次,浸提温度对多酚得率的影响如图2所示.

图1 超声功率对多酚得率的影响 图2 浸提温度对多酚得率的影响
由图2可以看出,随着浸提温度的增加多酚得率呈现先增后减的趋势,当浸提温度为60 ℃时多酚得率最高.这可能因为温度过低杜仲叶中的多酚溶出速度较慢,随着温度升高多酚的得率增加,当温度高于60 ℃时多酚结构会发生变化,从而使多酚得率降低.综合考虑,本实验选择浸提温度为60 ℃.
2.1.3 超声及浸提时间对多酚得率的影响
在超声功率400 W,料液比1∶15,乙醇浓度60%条件下提取两次;在料液比1∶15,乙醇浓度60%,浸提温度60 ℃条件下提取两次.超声提取时间及浸提时间对多酚得率的影响如图3所示.

图3 提取时间对多酚得率的影响 图4 乙醇浓度对多酚得率的影响
由图3可以看出,超声法和浸提法随着提取时间的延长多酚的得率呈现上升趋势,其中超声时间超过45 min时多酚得率下降.产生这种现象的原因可能有:(1)超声法提取时间超过45 min后超声产生的热量(温度超过58 ℃)使杜仲叶多酚物质结构发生变化,从而使多酚得率降低;(2)浸提法提取温度在60 ℃温度下,随着时间的延长杜仲叶中多酚的溶出量越多,但多酚得率增加不明显.综合考虑,超声提取实验选择超声时间45 min,浸提时间选择60 min为宜.
2.1.4 乙醇浓度对超声法和浸提法提取多酚得率的影响

图5 料液比对超声法及浸提法提取多酚得率的影响
在超声功率400 W,料液比1∶15,超声时间45 min条件下提取两次;在料液比1∶15,浸提时间1 h,浸提温度60 ℃条件下提取两次.乙醇浓度对超声法及浸提法提取多酚得率的影响如图4所示.
由图4可以看出,超声法和浸提法中随着提取溶液乙醇浓度的增加多酚得率呈现先增后减的趋势,其中超声法乙醇浓度达到40%时多酚得率最大,浸提法乙醇浓度为60%时多酚得率最大.这可能是因为多酚中包含多种极性和非极性物质,随着乙醇浓度的增加多酚提取的总量呈现先增后减的趋势.综合考虑,超声提取实验选择40%乙醇,浸提乙醇浓度选择60%乙醇为最佳条件.
2.1.5 料液比对超声法和浸提法提取多酚得率的影响
在超声功率400 W,乙醇浓度40%,超声时间45 min条件下提取两次;在乙醇浓度60%,浸提时间1 h,浸提温度60 ℃条件下提取两次.料液比对超声法及浸提法提取多酚得率的影响如图5所示.
由图5可以看出,随着溶剂量的增加,多酚得率也随之增高,但增高幅度较小.综合考虑提取成本,本实验采用料液比1∶15为宜.
2.2 提取最佳工艺的选择
我们对影响多酚得率的几个因素作了正交试验,以期从多个因素中找出影响实验结果的各因素的主次顺序以及最优的水平组合,实验结果见表3.
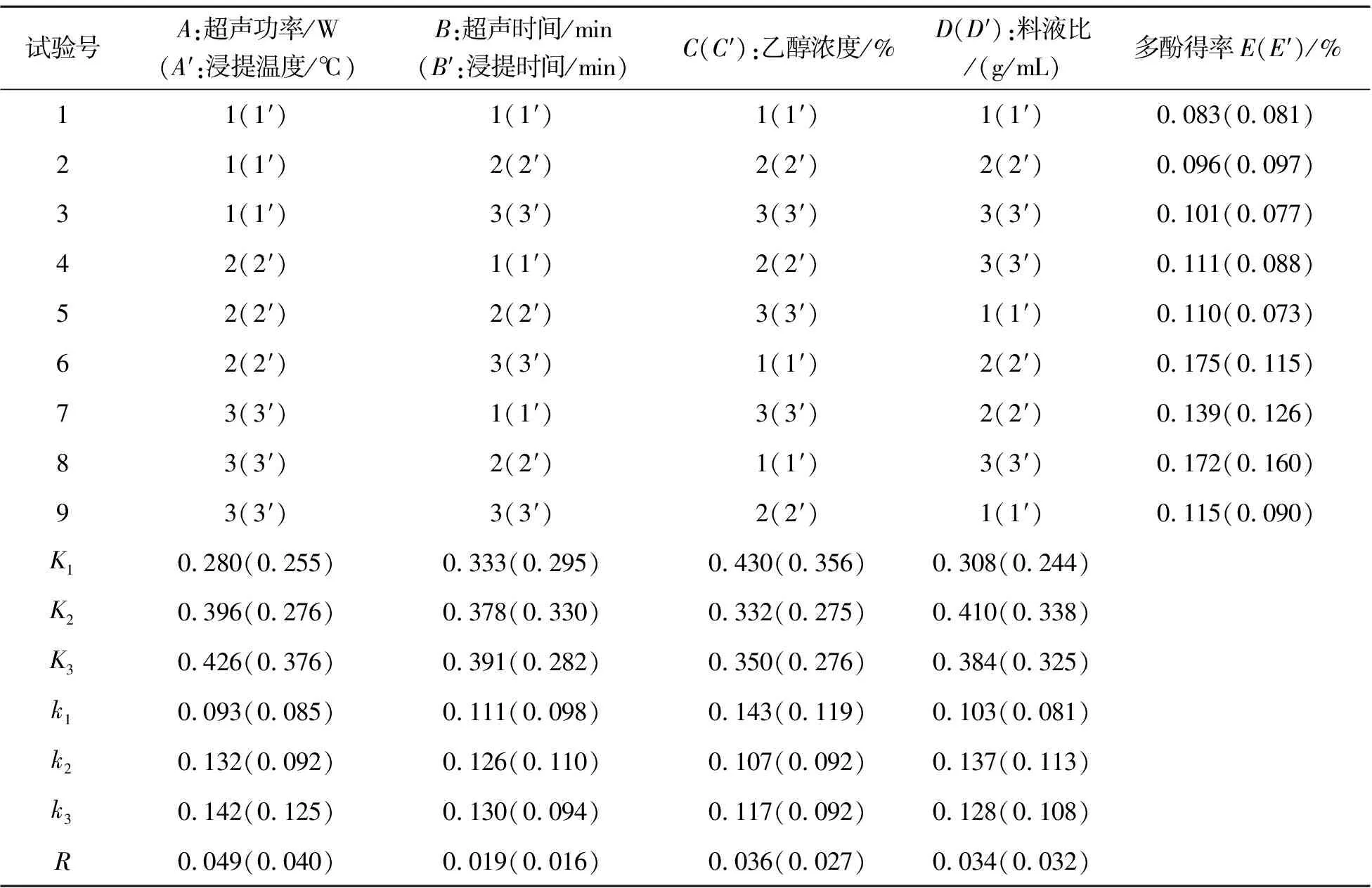
表3 正交试验结果与极差分析
注平行试验3次,结果取平均值.
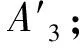
2.3 多酚粗提物初步分离纯化
2.3.1 大孔树脂的筛选
树脂预处理[3]:分别选用树脂LX-38、S-8、LS-300、LS-46、XDA-8、D-101B、LX-9、LX-60、LX-8、LS-806、LS-306、LSA-21,取适量(30 g)用1mol/L的NaOH溶液浸泡4 h,用纯净水洗至中性,然后用1 mol/L的HCl浸泡24 h,用纯净水冲洗至中性,用70%乙醇浸泡24 h备用.

图6 大孔树脂筛选结果
没食子酸吸附:将预处理好的不同种类树脂置于250 mL锥形瓶中,分别加入10 mL标准溶液及90 mL水,密封,于30 ℃、无光条件下,70 r/min摇床吸附12 h,过滤得到吸附饱和的大孔树脂.
没食子酸解吸:将过滤后的大孔树脂置于250 mL锥形瓶中,分别加入100 mL 40%乙醇溶液,密封,于30 ℃、无光条件下,70 r/min摇床解吸30 min,过滤,测定解吸液中没食子酸的吸光度并计算出解吸液中没食子酸的质量,结果如表4.
由图6可以看出,XDA-8大孔树脂对没食子酸吸附效果最好,吸附量=[解吸没食子酸质量(g)/添加没食子酸质量(g)]×100%,经计算达43.92%,因此本实验选用XDA-8大孔树脂对酚类物质粗提物进行初步的分离纯化.
2.3.2 酚类物质提取物初步分离、纯化
多酚粗提物吸附:取经预处理XDA-8大孔树脂适量,湿法装柱(2 cm×30 cm)至2/3柱高度,用纯净水冲洗至流出液不含有乙醇.将杜仲叶40%乙醇提取液浓缩至适当浓度(不含乙醇),离心,取上清液沿柱壁缓缓加入装有树脂的柱中,至流出液颜色和加入浓缩液颜色基本相同,静置吸附24 h.
多酚解吸附:分别用水、20%乙醇、40%乙醇、60%乙醇、80%乙醇、无水乙醇对吸附后大孔树脂进行洗脱,每次洗脱至洗脱液无色,最后测定洗脱液中多酚的吸光度,进一步测定经初步分离、纯化后多酚的含量([溶液中多酚质量(g)/洗脱液干重(g)]×100%)分别为:3.41%、11.35%、2.94%、2.38%、1.35%、0.23%.结果表明:20%乙醇洗脱液中多酚含量较高,其为多酚进一步分离、纯化提供了一定的基础.
3 结论
(1)超声法提取杜仲叶中多酚的最佳工艺为:A3B3C1D2,即在提取功率800 W,超声波提取时间60 min,乙醇浓度40%,料液比1∶10 g/mL的条件下提取两次,多酚得率为0.175%.
(3)XDA-8大孔树脂对没食子酸的吸附效果较好,吸附量为43.92%.
(4)大孔吸附树脂对提取物进行初步分离纯化,20%乙醇洗脱液中多酚的含量最高为11.35%.
(5)经长期放置的杜仲叶中多酚含量较低,这可能是多酚中含有光敏、热敏及对氧气敏感成分,所以作为多酚提取原料的杜仲叶应避光、真空、阴凉条件下保存.
参考文献
[1] 邓素兰,余继宏,管 林,等.杜仲不同部位总黄酮含量的测定[J].生物质化学工程,2007,41(3):37-38.
[2] 叶文峰.杜仲叶中化学成分、药理活性及应用研究进展[J].林产化工通讯,2004,38(5):40-43.
[3] 管淑玉,苏薇薇.杜仲化学成分与药理研究进展[J].中药材,2003,26(2):124-129.
[4] 李 华,王蔚新,袁春龙,等.葡萄籽多酚提取物的提取工艺研究[J].食品研究与开发,2005,26(6):69-72.
[5] 热依木古丽·阿布都拉,刘 力,仲 婕,等.石榴花中多酚物质的纯化工艺研究[J].中国中药杂志,2009,34(17):27-30.
[6] GB/T 8313-2008.茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京:中国标准出版社,2008.
