一种拮抗HIV-1并靶向DC的融合基因的设计及表达鉴定
2011-02-09赵萌徐青于继云余云舟
赵萌,徐青,于继云,余云舟
1 北京交通大学生命科学与生物工程研究院,北京 100044
2 军事医学科学院基础医学研究所,北京 100850
3 军事医学科学院生物工程研究所,北京 100071
HIV (Human immunodeficiency virus) 属于慢病毒属,是一种潜伏期极长的逆转录病毒,它可以通过感染 CD4+T细胞、巨噬细胞和树突状细胞 (DC)等使机体免疫系统受损,最终导致患者艾滋病(AIDS) 的发生。艾滋病的蔓延对全世界人类健康和社会经济的发展构成了巨大的威胁,而目前尚无能够彻底治疗艾滋病的药物和预防的疫苗。HIV通过一系列连续的过程进入宿主细胞,HIV病毒主要表面蛋白gp120首先与细胞表面的分子CD4结合,使HIV外膜复合物发生结构改变,然后与细胞表面的趋化因子辅助受体CCR5或CXCR4结合,使病毒与宿主细胞膜接近和融合[1-2]。近些年在对于艾滋病人的治疗中发现HIV-1抗原刺激DC所诱导的免疫可以控制血浆病毒载量并有效杀伤 HIV-1感染的细胞,并且研究发现成熟的DC可以增强机体T细胞对于HIV-1的免疫应答[3]。Flt3-L可以极大刺激DC增殖、分化和成熟,在 DC靶向疫苗的研究中可以增强DC对HIV抗原递呈作用[4-5]。趋化因子Mip-3α直接参与了DC细胞和T细胞的定向迁移,近期的研究发现Mip-3α还具有抗 HIV-1活性[6-7]。本研究中,首先设计了一个包含CD4和CCR5与gp120结合的主要功能结构区及Flt3-L和Mip-3α分子的融合基因,目的是通过融合基因表达的CD4和CCR5与HIV表面蛋白gp120的双重结合,捕获病毒分子,从而阻断病毒进入靶细胞内,然后通过Mip-3α对DC的趋化作用,将捕获的病毒分子靶向 DC,从而抑制和清除病毒。其次我们体外合成了全长的基因分子,并分别构建了包含 pABK-CKR5-CD4/ Flt3-L-Mip-3α (pABK-HIV-MF) 和pABK-CKR5-CD4 (pABK-HIV-MT) 的真核表达载体。pABK-HIV-MF表达的是全长的融合基因,而构建 pABK-HIV-MT的目的是辅助性检测 CKR5和 CD4的融合蛋白与gp120在体外是否能够有效结合。最后,我们在真核细胞中成功地表达了所构建的载体,为下一步研究融合蛋白对HIV-1的拮抗及靶向DC清除作用奠定了基础。
1 材料与方法
1.1 材料
人胚肾 293细胞、真核表达载体 pABK和pVAX-1-s-CD4为本实验室保存;大肠杆菌DH5α感受态细胞购自天根公司。
1.2 方法
1.2.1 pABK-HIV-MT和pABK-HIV-MF真核表达载体的构建
全长融合基因序列由北京擎科生物技术公司合成,合成的基因DNA连接在T-EASY载体上。扩增HIV-MT和 HIV-MF融合基因的上游引物均包含BamHⅠ酶切位点,下游引物均包含XbaⅠ的酶切位点,引物均由生工生物工程上海有限公司合成,引物序列参照表1。PCR、质粒提取、DNA酶切、连接和转化等操作方法参照相关试剂说明书和《分子克隆实验指南》[8]。实验中的连接酶,DNA限制性内切酶BamHⅠ和XbaⅠ购自New England Biolabs公司;2×Pfu PCR MasterMix,转染用小量及中量质粒提取试剂盒购自天根公司。
1.2.2 细胞培养和转染
人胚肾 293细胞的培养使用 Freestyle™293 Expression Medium (Gibico),待细胞密度生长至1×109个/L时,转染质粒。转染试剂使用293fectin™(Invitrogen),按试剂盒说明进行操作。
1.2.3 RT-PCR检测HIV-MF在细胞内转录
转染 48 h后收获转染 HIV-MF质粒的人胚肾293细胞,每孔加入TRIzol试剂提取细胞总RNA。取细胞总RNA 5 µL,按照Invitrogen SuperScript™III Reverse Transcriptase (Invitrogen) 的产品说明进行反转录实验。引物序列参照表1,其中GAPDH特异性上下游引物和Oligo(dT)20购自东洋纺公司。
1.2.4 间接免疫荧光
转染后24 h,取转染质粒的人胚肾293细胞悬液1 mL移入6孔板,4 ℃、4 000 r/min离心5 min,沉淀细胞,在−20 ℃用5%醋酸 (溶于甲醇) 固定细胞;1% BSA (含0.5% Triton-100) 孵育10 min,PBS洗3次;1% BSA封闭1 h后,加入1∶250稀释的兔抗人CD4一抗 (Santa Cruz),37 ℃孵育1 h;PBS洗3次后,加溶于1%伊文氏蓝及1% BSA中1∶200稀释的 FITC-山羊抗兔二抗 (中杉金桥),37 ℃孵育0.5 h,PBST洗3次;在荧光镜下观察并照相。
1.2.5 ELISA
转染后72 h,取细胞悬液,离心,分别分离上清与细胞沉淀。上清使用0.45 µm滤膜过滤后可直接作样品,细胞总蛋白的提取参照细胞裂解液(Promega) 说明书。将蛋白样品分别与 PBS等体积混合后,加入96孔板中,每孔100 µL,每组样品设2个平行,4 ℃包被过夜后,2% BSA封闭2 h;PBS洗2次后,每孔加入100 µL的1∶100稀释兔抗人CD4一抗,37 ℃孵育1 h;PBST洗4次后,每孔加入50 µL的1∶2 000稀释HRP-山羊抗兔二抗 (中杉金桥),37 ℃孵育1 h;PBST洗4次,PBS洗1次后OPD室温显色10 min,用BioRad酶联仪检测492 nm和630 nm的A值。
1.2.6 Western blotting
转染后 72 h,收集细胞,采用细胞裂解液(Promega) 提取胞内总蛋白。将蛋白样品与电泳上样缓冲液混合后沸水煮5 min,立即置于冰上5 min,短暂离心。细胞总蛋白的上样量为每泳道20 µg,10% SDS-PAGE胶分离样品,200 mA湿转2 h至PVDF膜上;室温封闭2 h后,将膜与5%脱脂奶粉1∶5 000稀释的鼠抗 His标签一抗 (中杉金桥) 和1∶10 000稀释的鼠抗β-Tubulin一抗 (Abmart) 4 ℃共同孵育过夜;PBST洗膜3次,将膜与1:10 000稀释的 HRP-山羊抗鼠二抗 (Santa Cruz) 室温孵育1 h,PBST洗膜3次后;加入ECL试剂,室温反应5 min,暗室曝光,显影,定影。
2 结果
2.1 HIV-1拮抗并靶向 DC的融合基因的设计和合成
本实验中我们设计了一个能够捕获HIV-1并靶向DC的融合基因,包含CD4等4个分子,其中CD4和CCR5能够与HIV-1特异性结合,可以阻断HIV的膜蛋白gp120与靶细胞表面受体结合,而Mip-3α分子可以募集DC,Flt3-L分子则能够刺激DC的增殖。在4个不同的分子间,加入了连接序列,避免所表达分子间的相互作用。另外,为了方便融合蛋白的检测和纯化,我们在融合基因 3末端加入了 6个组氨酸构成的标签。在GenBank中获取了对应基因的核酸序列,各序列详细信息见表 2。融合基因全长2 232 bp,序列的一级结构分析 (www.expasy. org) 表明融合基因对应蛋白的分子量约84 kDa。

表1 引物序列Table 1 Primer sequences

表2 HIV-MF融合基因中各组分信息Table 2 Information of each component in HIV-MF

图1 HIV-MF融合基因结构Fig. 1 Component included in HIV-MF.
2.2 真核表达载体的鉴定
电泳结果显示,重组质粒 pABK-HIV-MT和pABK-HIV-MF用BamHⅠ和XbaⅠ酶切后,条带分别与载体和目的片段大小一致 (图 2)。测序分析表明重组质粒序列正确,表明重组质粒构建成功。
2.3 HIV-MF的转录结果

图2 重组质粒pABK-HIV-MT和pABK-HIV-MF的酶切鉴定Fig. 2 Digestion of pABK-HIV-MT and pABK-HIV-MF. M: DNA marker; 1: pABK-HIV-MT plasmid; 2: pABK-HIV-MT digested with BamH I/Xba I; 3: pABK-HIV-MF plasmid; 4: pABK-HIV-MF digested with BamH I/Xba I.
用重组质粒pABK-HIV-MF转染人胚肾293细胞,RT-PCR检测重组质粒在细胞中的转录。pABK-HIV-MF重组质粒在2 244 bp左右有扩增条带,转染 pABK-HIV-MF组和 pABK空载体组有GAPDH的扩增条带,以水为模板的空白对照组和未添加反转录酶处理的所有样品 (图略) 均无对应扩增条带,表明pABK-HIV-MF在细胞中得到了特异的转录。
2.4 融合基因表达的间接免疫荧光检测结果
间接免疫荧光检测结果显示阳性对照 (转染pVAX-1-s-CD4真核表达载体) 及转染 pABKHIV-MT和pABK-HIV-MF的人胚肾293细胞在镜下观察有染色 (图 4),而未转染重组质粒组没有染色,表明融合基因HIV-MT和HIV-MF在细胞中得到了特异表达。

图3 HIV-MF融合基因的RT-PCR产物Fig. 3 RT-PCR product of HIV-MF. M: DNA marker; 1: amplification of water by GAPDH primer; 2: amplification of water by specific primer; 3: amplification of pABK group by GAPDH primer; 4: amplification of pABK group by specific primer; 5: amplification of pABK-HIV-MF group by GAPDH primer; 6: amplification of pABK-HIV-MF group by specific primer.
2.5 融合基因表达的ELISA检测结果
因为真核表达载体pABK中带有一段信号肽,可以使得表达的蛋白分泌到细胞外,所以细胞上清中会有表达的蛋白。我们采用间接ELISA法进一步验证融合基因HIV-MT和HIV-MF在细胞内和培养上清中的表达情况。通过包被细胞总蛋白和培养上清,用CD4作为一抗孵育,每个样品组设2个平行孔。同时设置多组对照组:一抗对照 (不加二抗只加一抗),二抗对照 (不加一抗只加二抗),阴性对照(未转染组)。如图5所示,转染pABK-HIV-MT和pABK-HIV-MF的培养上清和细胞内总蛋白CD4抗体检测结果呈阳性,未处理组和所有对照组呈阴性,表明融合蛋白在人胚肾 293细胞中得到了特异表达,并且分泌到了细胞外。
2.6 HIV-MF的Western blotting结果
为了进一步检测HIV-MF在人胚肾293细胞中的表达及估计其蛋白分子量的大小,我们用抗 His标签和抗β-Tubulin内参抗体对转染HIV-MF真核表达载体后人胚肾 293细胞的胞内总蛋白进行了Western blotting分析,结果显示转染HIV-MF真核表达载体组存在特异性条带和内参条带,而对照组只见内参条带 (图6),其结果确定了HIV-MF融合基因在人胚肾293细胞中获得了正确的表达。
3 讨论
目前美国FDA批准用于治疗HIV-1的药物主要是逆转录酶抑制剂和蛋白酶抑制剂,这两种药物在使用中均有不良反应,很难抑制病毒的复制,且极易导致病毒变异,出现耐药。而HIV进入/融合抑制类药物由于不受耐药性影响,成为非常有吸引力的药物研制方向。HIV通过外膜蛋白 gpl20与靶细胞表面的CD4受体及趋化因子受体CCR5和CXCR4结合进入细胞,因此与 gpl20结合的高度保守区域为 HIV进入/融合抑制类药物作用提供了靶点。其中,PRO542是由CD4的Dl~D2区和天然抗体IgG2的保守区融合而成的重组蛋白,正处于Ⅱ期临床研究阶段。另一种抗CD4的单克隆抗体Ibalizumab可阻断HIV-1与细胞表面受体CD4结合,在一期临床实验中也获得了较好的抗病毒效应。而 Maraviroc作为第一个CCR5拮抗剂已于2007年8月被美国FDA批准上市[9-10],随访结果显示Maraviroc具有良好的安全性和抗病毒效应[11]。
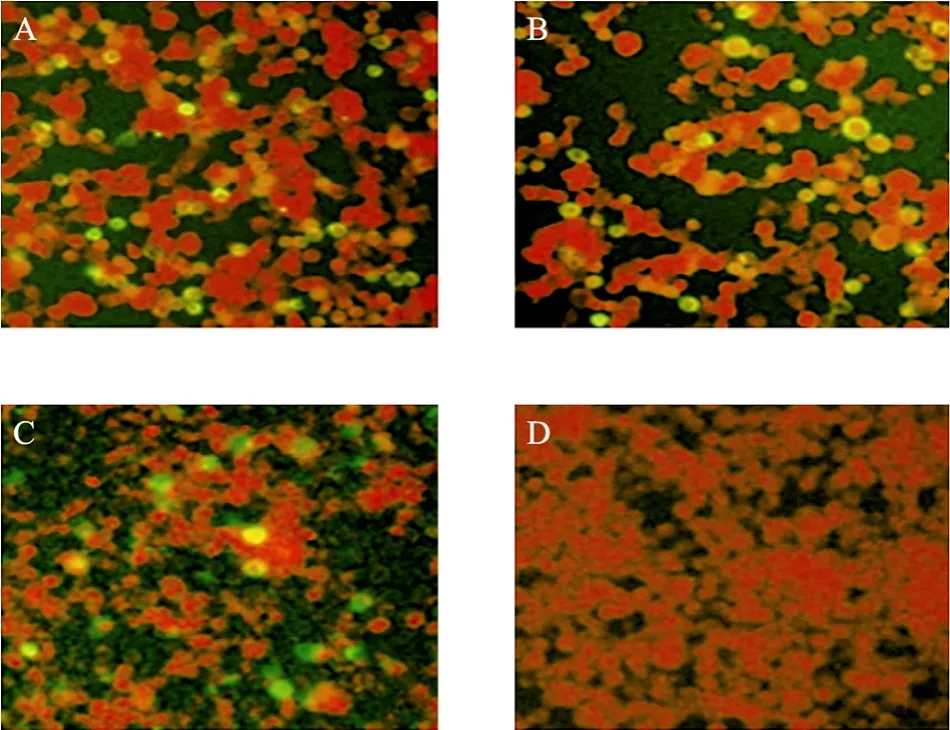
图4 融合基因的间接免疫荧光检测结果Fig. 4 Immunofluorescent assay of the fusion gene expressing in cells. (A) Transfected with plasmid pABK-HIV-MT. (B) Transfected with plasmid HIV-MF. (C) Transfected with plasmid pVAX-1-s-CD4 (positive control). (D) Untreated group (negative control).

图5 融合蛋白表达的ELISA检测结果Fig. 5 ELISA analysis of the fusion gene in cells. 1: culture medium of HEK293 transfected with plasmid pABK-HIV-MT; 2: culture medium of HEK293 transfected with plasmid pABK-HIV-MF; 3: intracellular protein of HEK293 transfected with plasmid pABK-HIV-MT; 4: intracellular protein of HEK293 transfected with plasmid pABK-HIV-MF; 5: untransfected group.

图6 融合蛋白HIV-MF表达的Western blotting鉴定Fig. 6 Western blotting of fusion protein HIV-MF in cells. 1: intracellular protein of HEK293 transfected with plasmid pABK-HIV-MF; 2: untreated group.
根据上述的研究结果,本研究中我们设计的融合基因HIV-MF理论上可以通过CD4和CCR5与HIV表面蛋白gp120的双重结合,捕获病毒分子,然后通过Mip-3α对DC的趋化作用,将捕获的病毒分子靶向DC,从而抑制和清除病毒,而Flt3-L分子则可以刺激DC的增殖、分化和成熟,增强DC对HIV抗原递呈作用。本研究采用多种不同的方法来检测HIV-MF在细胞中的表达情况,不同的检测方法得到了一致的结果,说明含融合基因的真核表达载体已被成功构建并在细胞中获得了正确的表达,为研究融合蛋白对HIV-1的的拮抗及靶向DC的作用奠定了基础。下一步我们将纯化融合蛋白HIV-MT和 HIV-MF,首先在体外检测它们是否可与 gp120结合,然后验证其对HIV的捕获以及HIV-MF分子是否可以募集,并刺激DC的增殖和分化。
REFERENCES
[1] Yu Y, Xiao GF, Li M, et al. Molecular mechanism of the entry of HIV-1 into cells and the related drug research. Prog Biochem Biophys, 2003, 30(1): 13−18.余勇, 肖庚富, 李敏, 等. 人类免疫缺陷病毒-1进入细胞的分子机制及相关药物的研究. 生物化学与生物物理进展, 2003, 30(1): 13−18.
[2] Weber J. The pathogenesis of HIV-1 infection. Br Med Bull, 2001, 58(1): 61−72.
[3] Huang XL, Fan Z, Borowski LA, et al. Dendritic cells reveal a broad range of MHC class I epitopes for HIV-1 in persons with suppressed viral load on antiretroviral therapy. PLoS One, 2010, 5(9): e12936.
[4] Bozzacco L, Trumpfheller C, Huang Y, et al. HIV gag protein is efficiently cross-presented when targeted with an antibody towards the DEC-205 receptor in Flt3 ligand-mobilized murine DC. Eur J Immunol, 2010, 40(1): 36−46.
[5] Gamvrellis A, Leong D, Hanley JC, et al. Vaccines that facilitate antigen entry into dendritic cells. Immunol Cell Biol, 2004, 82(5): 506−516.
[6] Yue HL, Peng DZ. Structure and function of CCL20. Immunol J, 2004, 20(3): 100−102.岳海岭, 彭代智. CCL20的结构与功能. 免疫学杂志, 2004, 20(3): 100−102.
[7] Ghosh M, Shen Z, Schaefer TM. CCL20/MIP3α is a novel anti-HIV-1 molecule of the human female reproductive tract. Am J Reprod Immunol, 2009, 62(1): 60−71.
[8] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989.
[9] Kuritzkes DR. HIV-1 entry inhibitors: an overview. Curr Opin HIV AIDS, 2009, 4(2): 82−87.
[10] Alkhatib G. The biology of CCR5 and CXCR4. Curr Opin HIV AIDS, 2009, 4(2): 96−103.
[11] Hardy WD, Gulick RM, Mayer H, et al. Two-year safety and virologic efficacy of maraviroc in treatmentexperienced patients with CCR5-tropic HIV-1 infection: 96-week combined analysis of MOTIVATE 1 and 2. J Acquir Immune Defic Syndr, 2010, 55(5): 558−564.
