载脂蛋白J及补体C3在大鼠脑出血模型中表达的实验研究
2011-02-09郑晓梅李小刚
郑晓梅,刘 亮,李小刚
(1.四川省泸州市人民医院神经内科 646000;2.泸州医学院附属医院神经外科 646000;3.泸州医学院附属医院神经内科,四川泸州 646000)
脑出血(intracerebral hemorrhage,ICH)是神经系统多发病,严重威胁人类健康。补体激活所致的炎症反应和细胞凋亡在ICH继发性损伤中的作用日益受到重视[1]。载脂蛋白 J(apolipoprotein J,ApoJ)是一种多功能糖蛋白,参与补体调控、细胞凋亡及DNA修复等多种生理功能[1]。目前,国内外对ApoJ在ICH过程中所起作用的报道不多。有学者认为在阿尔茨海默病及脑梗死等疾病中,A poJ有神经元保护作用,ApoJ可清除阿尔茨海默病患者脑组织中沉积的β-淀粉样蛋白而延缓老年性痴呆[2]。既往研究表明,补体系统参与了ICH后的神经元死亡。ApoJ作为公认的补体调节因子,是否通过抑制ICH后的补体激活来阻止补体介导的神经元死亡,是本研究的切入点。本文通过探讨ApoJ在ICH过程中的作用机制,为临床治疗提供实验依据。
1 材料与方法
1.1 主要试剂与仪器 RT-PCR试剂盒购自大连宝生物工程有限公司。WDT-V型鼠脑立体定向仪购自西安西北光电仪器厂。
1.2 动物分组与建模 Sprauge-Daw ley(SD)大鼠150只(鼠龄 3~4个月、体质量 250~350 g)购自泸州医学院动物中心,合格证号:川医动字2401115。将SD大鼠随机分为3组:正常对照组(n=10)、假手术组(n=70)及 ICH组(n=70);假手术组与ICH组(出血量为50μL)分别按假手术术后时间及出血后时间分为 3、6、12 h以及1、3、5、7 d等7个亚组(n=10)。采用参考文献[3]的实验方法,通过脑立体定向仪将自体血注入尾状核,制作大鼠ICH模型。根据Bederson等[4]的评定方法将神经功能缺损程度分为4级,将手术后2 h大鼠神经功能缺损程度达1、2、3级判断为建模成功。假手术组穿刺留针后取出,穿刺留针过程与手术组相同。
1.3 脑组织含水量测定 采用干湿质量法,各组在规定时间点处死大鼠,收集血肿周围的脑组织,质量约200mg,100℃烘烤24 h,烘烤前、后用天平称量。含水量=(湿质量-干质量)/湿质量×100%。
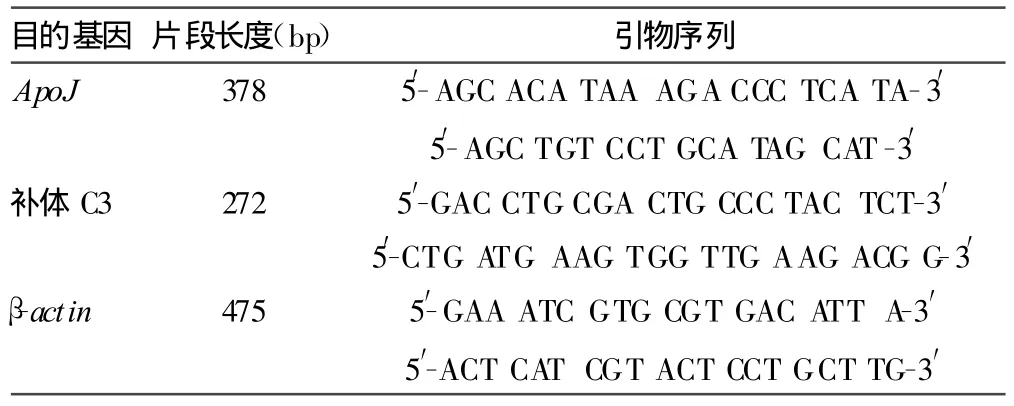
表1 ApoJ、补体C3及β-actin m RNA的引物序列
1.4 RT-PCR检测 分别取各组脑组织匀浆,按一步法总RNA提取试剂盒说明书提取总 RNA,合成 cDNA,然后用PTC 220型PCR热循环仪扩增cDNA,引物序列见表1。β-actinmRNA作为内参。将PCR产物进行琼脂糖凝胶电泳,应用Eagle EyeⅡ型图像分析处理系统对电泳带进行扫描,根据各条带光密度值,计算ApoJ、补体C3 mRNA表达的相对水平。
1.5 统计学处理 应用SPSS17.0统计软件进行方差分析和相关性分析,计量数据用±s表示,组间比较采用单因素方差分析(one-way ANOVA)多个样本均数的两两比较法,组内各时间点比较采用t检验,相关分析应用Pearson相关系数法,以P<0.05为差异有统计学意义。
2 结 果
2.1 脑组织含水量的动态变化 在3 h至7 d各时间点,ICH组的脑组织含水量明显高于相应时间点的正常对照组及假手术组(P<0.05),其中以 ICH 3 d组的脑组织含水量最高,见表2。
表2 各组大鼠不同时间点脑组织含水量比较(±s,%)
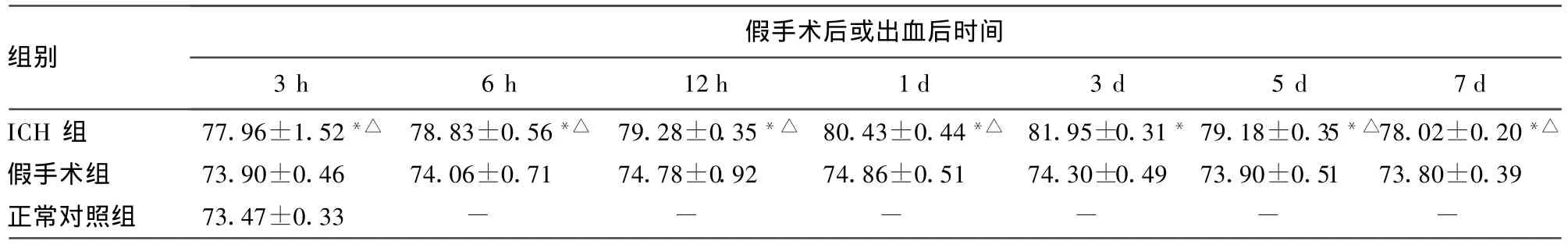
表2 各组大鼠不同时间点脑组织含水量比较(±s,%)
*:P<0.05,与假手术组及正常对照组比较;△:P<0.05,与ICH 3 d组比较;-:表示此项无数据。
假手术后或出血后时间组别3 h 6 h 12 h 1 d 3 d 5 d 7 d ICH 组 77.96±1.52*△ 78.83±0.56*△ 79.28±0.35*△ 80.43±0.44*△ 81.95±0.31*79.18±0.35*△78.02±0.20*△假手术组 73.90±0.46 74.06±0.71 74.78±0.92 74.86±0.51 74.30±0.49 73.90±0.51 73.80±0.39正常对照组 73.47±0.33 - - - - - -
表3 各组大鼠不同时间点脑组织补体C3 mRNA的表达水平比较(±s)

表3 各组大鼠不同时间点脑组织补体C3 mRNA的表达水平比较(±s)
*:P<0.05,与假手术组及正常对照组比较;△:P<0.05,与ICH 3 d组比较;-:表示此项无数据。
假手术后或出血后时间组别3 h 6 h 12 h 1 d 3 d 5 d 7 d ICH 组 0.19±0.01△ 0.24±0.05*△ 0.36±0.08*△ 0.52±0.05*△ 0.71±0.05* 0.52±0.04*△ 0.34±0.05*△假手术组 0.18±0.01 0.18±0.01 0.19±0.01 0.19±0.01 0.19±0.01 0.18±0.01 0.18±0.01正常对照组 0.18±0.01 - - - - - -
表4 各组大鼠不同时间点脑组织ApoJ m RNA的表达水平比较(±s)
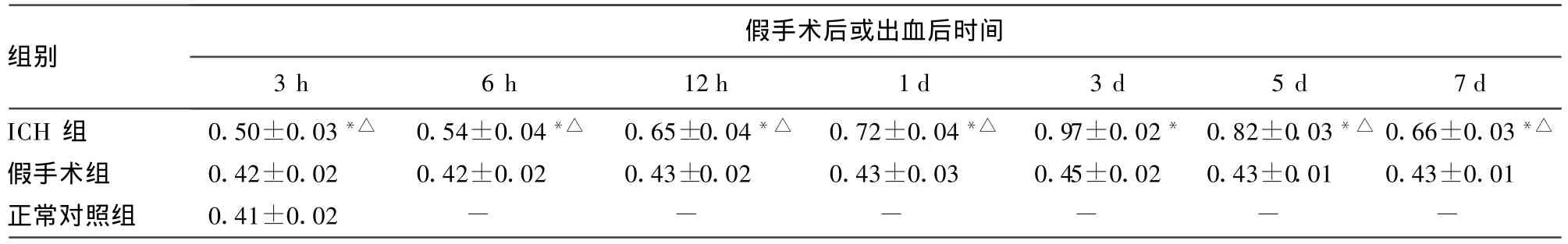
表4 各组大鼠不同时间点脑组织ApoJ m RNA的表达水平比较(±s)
*:P<0.05,与假手术组及正常对照组比较;△:P<0.05,与ICH 3 d组比较;-:表示此项无数据。
假手术后或出血后时间组别3 h 6 h 12 h 1 d 3 d 5 d 7 d ICH 组 0.50±0.03*△ 0.54±0.04*△ 0.65±0.04*△ 0.72±0.04*△ 0.97±0.02* 0.82±0.03*△ 0.66±0.03*△假手术组 0.42±0.02 0.42±0.02 0.43±0.02 0.43±0.03 0.45±0.02 0.43±0.01 0.43±0.01正常对照组 0.41±0.02 - - - - - -
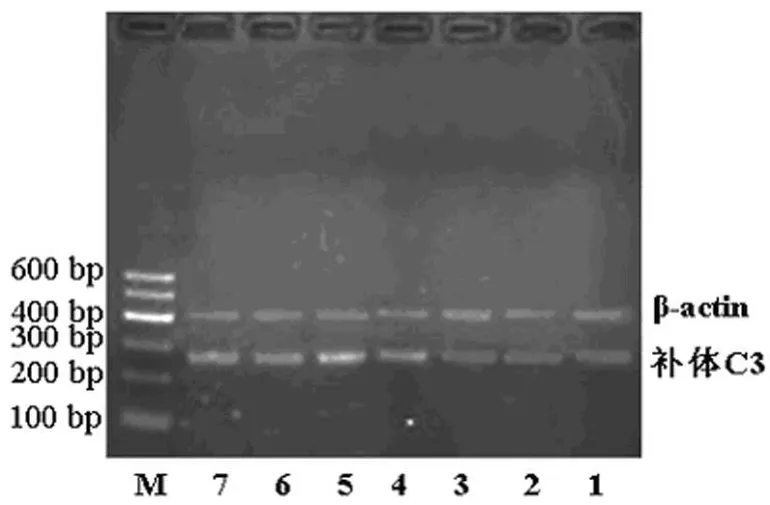
图1 ICH组大鼠脑组织补体C3mRNA的电泳图
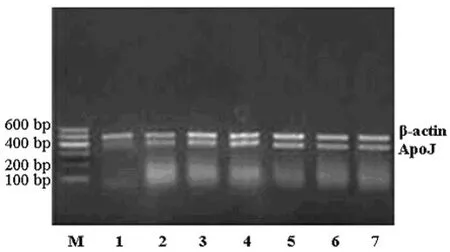
图2 ICH组大鼠脑组织ApoJ mRNA的电泳图
2.2 补体C3 mRNA的表达 在各时间点,正常对照组及假手术组大鼠脑组织的补体C3 mRNA呈低水平表达;除外ICH 3 h组,ICH组各时间点补体C3 m RNA表达明显高于相应时间点的正常对照组及假手术组(P<0.05);ICH 3 d组补体C3mRNA的表达水平最高,见表3、图1。
2.3ApoJmRNA的表达 在各时间点,正常对照组及假手术组大鼠脑组织ApoJmRNA呈低水平表达;ICH组ApoJmRNA表达明显高于正常对照组及假手术组(P<0.05),ICH 3 d组Apo JmRNA的表达水平最高,见表4、图2。
2.4 相关性分析 应用Pearson相关系数法分析ICH组各检测指标间的相关性。补体C3、Apo Jm RNA的表达水平与血肿周围脑组织含水量呈正相关(R=0.758,P<0.05;R=0.702,P<0.05),提示ICH后脑水肿与补体系统有关,Apo J蛋白可能间接参与脑水肿的形成,见图3、4;ApoJmRNA与补体C3 mRNA的表达水平呈正相关(R=0.908,P<0.05),提示ICH后ApoJ参与了补体调控,见图5。
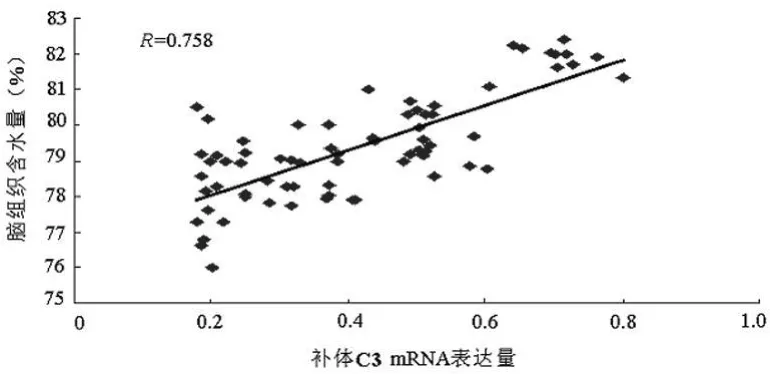
图3 补体C3mRNA表达水平与血肿周围脑组织含水量的关系
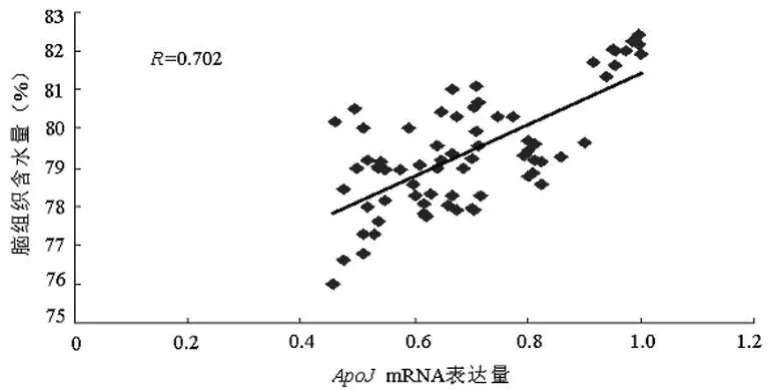
图4 Apo J mRNA表达水平与血肿周围脑组织含水量的关系
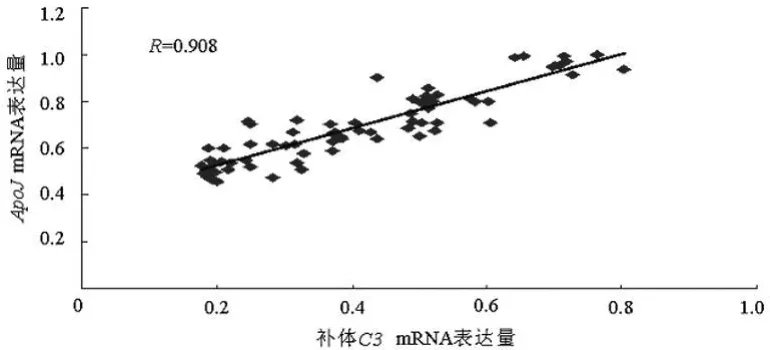
图5 ApoJ mRNA与补体C3m RNA表达水平的关系
3 讨 论
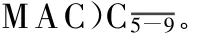
ApoJ是杂二聚体糖蛋白,由α、β链组成,分布于血浆高密度脂蛋白(high density lipoprotein,HDL)2及 HDL3中,与含Apo-A I和胆固醇转移蛋白活性的HDL亚型关系密切。ApoJ与Apo-A I一起形成 HDL复合物,参与脂质转运、补体功能调节等多种生理功能[11]。正常中枢神经系统的神经元及星形胶质细胞可低水平表达ApoJm RNA[12],而当细胞受损时,其表达可能增加。Nuutinen等[13]认为位于细胞核的ApoJ可诱导细胞凋亡,而当促凋亡蛋白Bax表达增加时,位于细胞线粒体的ApoJ表达增加,呈聚集状态,发挥保护细胞的作用。K im等[14]认为分泌型ApoJ通过抑制DNA合成而阻止受损血管平滑肌细胞的过度增殖,减少TNF-α诱导的凋亡,促进内皮细胞一氧化氮合酶的表达。李艳玲和何志义[15]认为,在大鼠脑梗死后,ApoJ的表达代偿性增加以抑制补体活性,从而抑制补体介导的神经元死亡,发挥神经元保护作用。然而,Hakkoum等[16]发现在脑缺血的体外模型中,A poJ可加重受损细胞死亡。
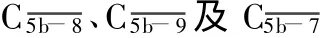
本实验还发现,ApoJmRNA表达上调在ICH后先于补体C3 mRNA的表达上调,这可能源于机体因ICH损伤而产生的内源性应激反应,其机制还有待进一步阐明。
综上所述,ApoJ作为 MAC抑制剂,在 ICH过程中,通过抑制补体系统的激活而减轻脑水肿、保护神经元。根据Apo J在ICH后的变化规律以及ApoJ作为内源性补体抑制剂,它能否成为临床上监测脑水肿程度的间接指标、在治疗脑损伤过程中发挥重要作用还有待进一步研究。
[1] Shannan B,Seifert M,Leskov K,et al.Challenge and prom ise:roles for clusterin in pathogenesis,progression and therapy o f cancer[J].Cell Death Differ,2006,13(1):12-19.
[2] Lambert JC,Heath S,Even G,etal.Genome-w ide association study identifies variants at CLU and CR1 associated with A lzheimer's disease[J].Nat Genet,2009,41(10):1094-1099.
[3] Xue M,Del Bigio MR.Intracerebral in jection of auto logous whole blood in rat:time course of inflammation and cell death[J].Neurosci Lett,2000,283(3):230-232.
[4] Bederson JB,Pitts LH,TsujiM,et al.Ratm iddle cerebral artery occlusion:evaluation of themodel and development of a neurologic exam ination[J].Stroke,1986,17(3):472-476.
[5] 崔洁,王景周,宋钦,等.脑出血大鼠脑水肿与血浆肿瘤坏死因子关系的研究[J].重庆医学,2007,36(13):1244-1245.
[6] 周志强,赵立波,王凤英,等.rh EPO抑制大鼠脑出血后炎症反应与增强 LIV IN的表达[J].重庆医学,2009,38(9):1067-1070.
[7] 孟凡超,娄季宇,杨宵鹏,等.实验性脑出血大鼠脑水肿的动态变化[J].中国实用神经疾病杂志,2006,9(3):67-69.
[8] 张军,张国华,林杰.补体C3和 C4在脑出血后血肿周围组织水肿形成过程中的作用[J].中国全科医学,2008,11(5A):741-743.
[9] XiG,H ua Y,Keep RF,etal.System ic complement depletion dim inishes perihematomal brain edema in rats[J].Stroke,2001,32(1):162-167.
[10]H omeister JW,Lucchesi BR.Com p lement activation and inhibition in myocardial ischemia and reperfusion injury[J].Annu Rev Pharmacol Toxicol,1994,34:17-40.
[11]陈海峰,浦晓东.载脂蛋白J在心血管疾病中的研究进展[J].国外医学心血管疾病分册,2005,32(6):332-334.
[12]W iggins A,Shen P,Gund lach A.Delayed,but prolonged increases in astrocy tic clusterin(Apo J)m RNA exp ression follow ing acute cortical spreading depression in the rat:evidence for a role of clusterin in ischem ic tolerance[J].Brain ResMo l Brain Res,2003,114(1):20-30.
[13]Nuutinen T,Suuronen T,Kauppinen A,et al.Clusterin:a forgotten p layer in A lzheimer's disease[J].Brain Res Rev,2009,61(2):89-104.
[14]Kim HJ,Yoo EK,Kim JY,et al.Protective role of clusterin/apo lipop rotein J against neointimal hyperp lasia via antiproliferative effect on vascular smooth muscle cells and cy top rotective effec t on endothelial cells[J].A rterioscler Thromb Vasc Biol,2009,29(10):1558-1564.
[15]李艳玲,何志义.大鼠脑梗死模型中载脂蛋白Jm RNA表达的研究[J].辽宁医学院学报,2008,29(4):308-310.
[16]Hakkoum D,Imhof A,Vallet PG,et al.Clusterin increases post-ischem ic damages in organotypic hippocampal slice cultures[J].JNeurochem,2008,106(4):1791-1803.
[17]Calero M,Rostagno A,Matsubara E,etal.Apolipoprotein J(clusterin)and A lzheimer's disease[J].M icrosc Res Tech,2000,50(4):305-315.
