耐晒1∶2铬络合交联染料合成与应用
2011-02-08周雷云唐炳涛张淑芬
周雷云, 唐炳涛, 张淑芬
(大连理工大学精细化工国家重点实验室,辽宁大连 116024)
0 引 言
活性染料是目前使用量最大的一类染料,它们在染色后可以与纤维素纤维以共价键结合,彻底解决了染色纤维的湿处理牢度问题.但是活性染料在使用过程中容易水解,致使染料的大量浪费以及染色废水对环境的污染[1].交联染料[2]是一种新型染料,它的分子中含有可交联基团,通过交联剂可以与纤维的可交联基团反应形成共价键,解决了活性基团的水解问题,同时又使纤维获得良好的湿处理牢度.本课题组成功合成了聚丙烯酰胺交联染料、聚乙烯胺交联染料[3]以及多乙烯多胺交联染料[4],这些染料由于分子结构中含有多个可交联氨基基团,大大提高了其在纤维上的利用率,并表现出良好的湿处理牢度.但是染色结果发现某些结构的多乙烯多胺交联染料染色纤维后,光稳定性有所下降.
金属络合染料是由酸性媒介染料进一步发展而形成的含金属染料[5],是羊毛、丝绸和聚酰胺纤维等着色光牢度最好的染料品种.目前商品化的金属络合染料的中心金属主要是Cr3+、Co2+、Cu2+等,其中铬络合染料的品种最多,研究非常成熟.在某些结构的偶氮染料中引入金属离子后,金属离子的配位效应能够使染料的日晒牢度明显提高[6、7].为了解决多乙烯多胺交联染料日晒牢度下降的问题,本文根据铬络合染料的合成条件,将金属铬离子引入到o,o′-二羟基偶氮交联染料中,期望能合成出一类具有多个可交联氨基的铬络合染料,以获得高固色率和高光稳定性.为了合成金属络合交联染料,本文选择结构中含有磺酸基的o,o′-二羟基偶氮酸性染料,通过对磺酸基进行化学反应,引入含多个可交联基团的四乙烯五胺,合成交联染料母体;然后利用交联染料母体偶氮基及其邻位2个羟基可与金属离子形成配位的特点,与铬离子发生络合反应合成铬络合交联染料.
1 实 验
1.1 主要试剂和仪器
实验中所用四乙烯五胺、无水碳酸钠、二氯亚砜、氢氧化钠、亚硝酸钠、N,N-二甲基甲酰胺、丙酮等均为市售分析纯试剂;浓盐酸为化学纯试剂;醋酸铬为50%的溶液;2-氨基-4-磺酸基苯酚、2-氨基-4硝基苯酚和吡唑啉酮染料中间体为工业品;交联剂2-氯-4,6-二(氨基苯-4′-β-磺酸酯乙基砜)-1,3,5-均三嗪(DAST)自制.实验所用主要仪器有UV3100紫外-可见分光光度计(日本SHIMADZU公司)、FT/IR-460型红外光谱仪(美国NICOLET)、核磁共振仪(美国Varian INOVA 400 NMR)、HP1100高效液相色谱/质谱联用仪(美国惠普公司)、Analyst 700原子吸收光谱(Perkin Elmer公司).
1.2 合成实验
(1)染料1a、2a的合成
将2-氨基-4-磺酸基苯酚(9.45 g,0.05 mol)和碳酸钠(5.0 g)溶于50 m L水(50℃)中,将此溶液慢慢加入10.8 m L含有10 g碎冰的浓盐酸(36%)中,保持反应温度维持在0~5℃,往反应体系中慢慢加入7 m L的亚硝酸钠(3.5 g,0.051 mol)溶液.滴加完后搅拌30 min.用淀粉碘化钾试纸检验终点(微变蓝).过量的亚硝酸钠用尿素破坏.将1-苯基-3-甲基-5-吡唑啉酮(8.7 g)和氢氧化钠(10 m L,20%)溶于80 m L的去离子水中.降温至0~10℃,往里慢慢滴加重氮盐,并维持p H在8~9,加完后反应4 h.反应终点用渗圈法检测.反应完成后用溶液体积10%的NaCl进行盐析,然后减压抽滤.产品在红外灯下干燥.得到染料1a 14.85 g,产率94.4%.染料经乙酸钾-乙醇法提纯.1H NMR(DMSO-d6,400 MHz)δ:2.35(s,3 H),6.90~6.92(d,1 H),7.20~7.24(m,1 H),7.31~7.34(d,1 H),7.44~7.48(m,2H),7.88(s,1H),7.92~7.93(d,2H),10.83(s,1H),13.66(s,1 H).MS(API-ES,负模式)m/z:373([M-H]-).
按照合成染料1a的方法合成了染料2a,其产率为93.5%.染料经乙酸钾-乙醇法提纯.1H NMR(DMSO-d6,400 MHz)δ:2.33(s,3H),6.25~6.27(d,1H),7.64~7.66(d,2H),7.79~7.82(m,1 H),7.90~7.92(d,2H),8.14(s,1H),13.61(s,1H).MS(APIES,负模式)m/z:418([M-H]-).
(2)染料1b、2b的合成
染料1b的合成方法如文献[8]所述.用TLC(硅胶G,V(异丁醇)∶V(正丙醇)∶V(乙酸乙酯)∶V(水)=20∶40∶10∶30)检测反应终点.Rf,1b=0.84(Rf,1a=0.54).产率是96.6%.染料用甲苯重结晶.1H NMR(DMSO-d6,400 MHz)δ:2.35(s,3H),6.91~6.93(d,1H),7.22~7.24(m,1 H),7.31~7.34(d,1H),7.44~7.48(m,2H),7.88(s,1H),7.92~7.94(d,2 H),10.84(s,1 H),13.05(s,1 H).MS(APIES,负模式)m/z:391([M-H]-).
染料2b的合成方法及终点检测如上所述.产率为92.3%.Rf,2b=0.88(Rf,2a=0.68).1H NMR(DMSO-d6,400 MHz)δ:2.35(s,3H),7.16~7.19(d,1H),7.68~7.70(d,2H),7.87~7.89(d,2H),7.95~8.02(m,1H),8.34(s,1H),12.20(s,1 H),13.61(s,1 H).MS(API-ES,负模式)m/z:436([M-H]-).
(3)染料1c、2c的合成
染料1c、2c的合成方法按照文献[4]所述.1c产率为84%,2c产率为89%.1c的MS(API-ES,正模式)m/z:546.3([M+H]+),2c的MS(APIES,负模式)m/z:589.3([M-H]-).
(4)铬络合交联染料1d、2d的合成
将染料1c(5.4 g,0.01 mol)溶于50 m L水中,加入20%NaOH调节反应体系的p H为9.然后加入Cr(OAc)3(2.29 g,0.005 mol)和20 m L水.保证其p H为6左右,升温至90℃条件下搅拌5 h.反应结束后,用饱和碳酸钠调节p H为6,加入溶液体积10%的NaCl使染料析出.经过减压抽滤,得到红色的1∶2型铬络合交联染料1d,产率为85.1%.染料用乙酸钾-乙醇法提纯.
染料2d的合成方法同染料1d.产率为83%.
1.3 染色和牢度测试
1.3.1 染 色
(1)浸染染色
丝绸和羊毛的浸染染色在平动式常温染色仪(型号XW-PDR-25×12,靖江市新旺染整设备厂)上完成.取0.02 g交联染料(色度2%)溶于30 m L水中,调节p H到4.分别称取1.00 g丝绸和羊毛,水煮后晾干,将丝绸和羊毛分别浸入到染液中.在30℃保温30 min后,以2℃/min的速率分别升到80℃(丝绸)和100℃(羊毛),并保温1 h.染色结束后,将染色纤维取出在室温下晾干.分别将染色残液转移到容量瓶中定容,测定其吸光度.交联染料在丝绸和羊毛上的竭染率E的计算公式为

式中:A0、A1分别为初始染浴和染色残液吸光度;n0、n1分别为初始染浴和染色残液的稀释倍数;V0、V1分别为初始染浴和染色残液稀释后的体积.
(2)交联固色
调节交联剂DAST溶液(10%,20 m L)的p H到6,将染色后纤维浸入溶液中,每次浸3 min,经过两浸两轧后将布样在50℃下焙烘10 min.然后将布样在质量分数为0.2%的皂液中于100℃下煮10 min,再用清水洗涤后烘干.将交联残液、皂煮液及水洗液转移至容量瓶中定容,并测定其吸光度.交联率C和固色率F的计算公式如下:

式中:A2为固色后皂煮液及水洗液的吸光度;n2为固色后皂煮液及水洗液的稀释倍数;V2为固色后皂煮液及水洗液稀释后的体积.
1.3.2 牢度测试 染色纤维的牢度测试参照国标,耐洗色牢度的测定参照GB/T 3921—97,摩擦色牢度的测定参照GB/T 3920—97,日晒色牢度的测定参照GB/T 8427—98.
2 结果与讨论
2.1 交联染料母体1c、2c的合成与表征
交联染料母体1c、2c通过三步法合成(见图1),首先通过重氮偶合法制得含有磺酸基的o,o′-二羟基染料1a、2a;然后以SO2Cl为溶剂、DMF为催化剂对染料中的磺酸基进行氯化合成出具有反应活泼性的磺酰氯基;最后将磺酰氯基与四乙烯五胺发生胺解反应合成出含有多个可交联氨基和亚氨基的交联染料母体1c、2c.利用IR(见表1)、1H NMR和MS(见表2)对磺酸基染料和磺酰氯染料的结构进行表征;利用IR(见表1)和MS(见表2)对交联染料母体的结构进行表征.
(1)磺酸基染料1a、2a的结构表征
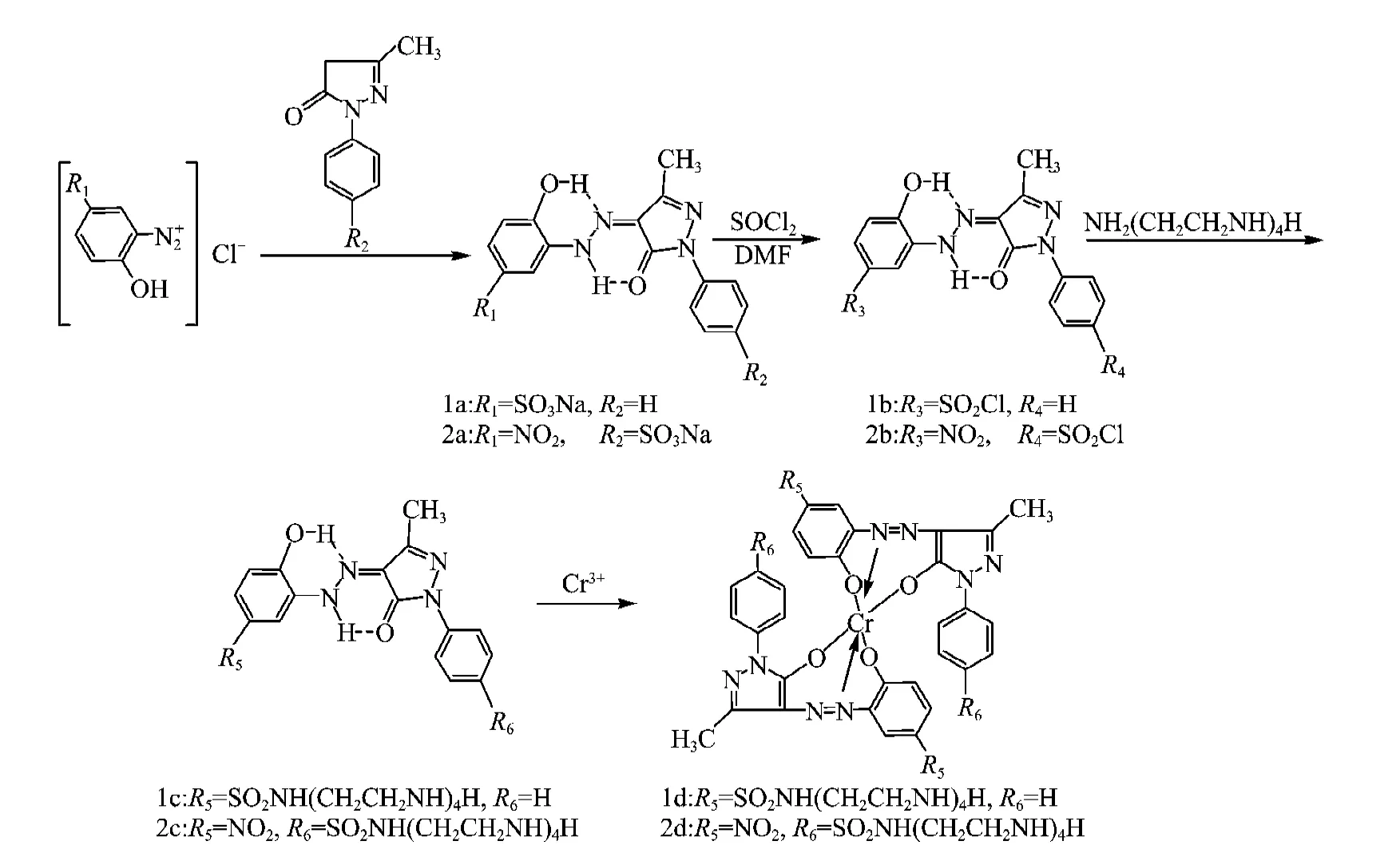
图1 铬络合交联染料的合成Fig.1 Synthesis of Cr-complexed crosslinking dyes
根据文献[9~11]报道,吡唑啉酮类染料主要以醌腙体结构稳定存在.染料1a分子中的偶氮基邻位含有2个羟基,可以发生偶氮-醌腙异构反应,其异构反应如图2所示.染料1a可能以3种偶氮-醌腙异构体的形式存在,为一种偶氮-醇式Ⅰ和2种醌腙-酮式Ⅱ、Ⅲ.染料1a的IR谱图中(见表1),在1 652和3 058 cm-1处分别出现了受氢键影响向低波数移动的吡唑啉酮环上羰基和芳香仲胺上N—H的伸缩振动峰,3 429 cm-1处出现了苯环上酚羟基的伸缩振动峰,1 251 cm-1处有苯环上C—O的特征吸收峰.在1a的1H NMR数据中,10.83×10-6和13.66×10-6处分别出现了羟基上活泼氢的质子峰和醌腙体亚氨基的质子峰.综合IR和1H NMR分析可以推断,染料1a以醌腙-酮式Ⅱ的形式存在,吡唑啉酮上的羰基与亚氨基质子以氢键结合,苯环上的羟基与C N上的N原子以氢键结合,分别形成了两个六元环,染料以非常稳定的醌腙异构体形式存在.

表1 铬络合交联染料及其染料中间体的红外数据(KBr,cm-1)Tab.1 IR spectra data of the Cr-complexes and their corresponding intermediate dyes(KBr,cm-1)

表2 染料中间体的质谱数据Tab.2 Mass spectra data for intermediate dyes

图2 染料1a的偶氮-醌腙异构互变Fig.2 Azo-hydrazone tautomerism of dye 1a
从表1中可看出,染料2a在1 645和3 097 cm-1处分别出现了受氢键影响向低波数移动的吡唑啉酮环上羰基和芳香仲胺上N—H的伸缩振动峰,3 445 cm-1处出现了苯环上酚羟基的伸缩振动峰,在1 273 cm-1处有苯环上C—O的特征吸收峰.在染料2a的1H NMR数据中,13.61×10-6处出现了醌体亚氨基的质子峰.综合IR和1H NMR分析可以推断,在染料2a中,吡唑啉酮环上的羰基与亚氨基质子以氢键结合,形成稳定的六元环.苯环上的酚羟基可能由于结构中硝基的影响而形成分子间氢键,在1H NMR谱图中没有出现信号.
(2)磺酰氯基染料1b、2b的结构表征
从表1中可看出,两支磺酰氯基染料出现了在1 650 cm-1附近羰基的特征吸收峰,以及分别在1 370和1 170 cm-1附近的磺酰氯基团中S O的不对称和对称伸缩振动峰.通过IR、MS和1H NMR分析,证明了染料1b和2b的结构正确性.同时,从1H NMR中可以发现两支染料存在羟基质子峰和醌体亚氨基质子峰.综合IR和1H NMR分析可推断,两支染料以醌腙-酮式Ⅱ的形式存在,也说明了相应反应物的结构中由于存在稳定的六元环,在氯化反应中降低了羟基的反应活性,氯化试剂仅对磺酸基作用使之生成了磺酰氯基.
(3)交联染料母体1c、2c的结构表征
从表1中可看出,两支交联染料母体原本位于1 370和1 170 cm-1附近的磺酰氯基团中SO的不对称和对称伸缩振动峰在胺解后分别移到了1 330~1 340 cm-1和1 148~1 156 cm-1,表明磺酰氯发生氨基反应生成了磺酰胺.同时位于3 400~3 450 cm-1附近的吸收峰强度明显增强,这是四乙烯五胺中多个氨基所致.在1 650 cm-1附近有吡唑啉酮环上羰基的伸缩振动峰,说明交联染料母体结构以醌腙体结构存在.
2.2 铬络合交联染料的合成与结构表征
两支交联染料母体与醋酸铬分别反应,合成了可交联的铬络合染料1d和2d.
金属络合偶氮染料的结构可以通过质谱法来表征,Sokolowska-Gajda等[6、7]用快原子轰击质谱(FAB)鉴定了1∶2型磺酰胺金属络合偶氮染料的结构,但是该方法给出的信息较复杂,影响了谱图的解析.随着软离子化技术的不断完善,电喷雾质谱被证实是最有效表征中性金属络合染料的分析方法[12].采用电喷雾质谱分析本文所合成的铬络合交联染料发现,由于含有四乙烯五胺,谱图出现无数峰,无法解析.为了表征染料结构,本文利用红外光谱(见表1)来研究络合前后基团特征吸收峰的变化,用原子吸收光谱(见表3)来测定染料中铬离子的含量,以此间接推断络合物的结构.
从表1中可看出,交联染料母体位于1 650 cm-1附近的吡唑啉酮环上的羰基吸收峰在络合后消失,而相应的在1 200 cm-1附近出现了吡唑啉酮环上C—O的伸缩振动峰.这说明交联染料母体在络合反应时,其醌腙体先向偶氮体发生异构,生成o,o′-二羟基偶氮结构,然后羟基和偶氮基再与铬离子发生配位反应.因此在络合产物的红外谱图中,没有发现反应物醌腙体结构中羰基的特征吸收峰,只发现了相应的C—O单键的吸收峰.红外光谱证明了络合反应的进行.
铬的核外电子排列为1s22s22p63s23p63d54s1.当其转变为三价铬离子时,其电子结构为1s22s22p63s23p63d3,此外层电子排列由3d2、4s1及4p3杂化成d2sp36个空轨道,从而保证可与6个中性分子或基团形成配位,因此铬离子与染料配体可在不同条件下形成1∶1型和1∶2型络合物[5].表3列出了染料用原子吸收光谱测得的铬离子含量.从表中可以看出,测得的染料中铬离子含量接近于1∶2型配位体.结合红外和原子吸收数据最终确定了1d、2d染料为1∶2型络合染料.

表3 原子吸收光谱测得的铬络合染料中铬离子含量Tab.3 Cr levels in Cr-complexed dyes by atomic absorption analysis
2.3 交联染料的可见光谱研究
铬络合交联染料及其相应的交联染料母体的可见光谱如图3所示.

图3 交联染料的可见光谱图Fig.3 Visible spectra of crosslinking dyes
从图中可发现,与交联染料母体相比,铬络合染料的最大吸收波长均发生了明显红移.这是因为铬离子与羟基上的氧原子连接,干扰了染料发色体中的π电子密度的分布,使氧原子更加容易给出孤对电子而进入π电子体系.给电子能力的增强,使染料产生了红移现象[13].表4列出了各支交联染料的最大吸收波长和摩尔消光系数.从表中可以看到,染料络合后的最大吸收波长和摩尔消光系数均比相应的交联染料母体有所增加.

表4 交联染料的可见光谱数据Tab.4 Visible spectra data of crosslinking dyes
2.4 染色和牢度性能
表5列出了铬络合交联染料及其相应的交联染料母体在丝绸和羊毛上的染色性能.从表5中发现,两支铬络合交联染料在丝绸和羊毛上的竭染率可分别达到96%和94%,与其相应的交联染料母体相当.染料对纤维的亲合力有两种来源,分别是染料对纤维的直接性以及染料和纤维之间的电荷差异.在这里,一方面络合染料相对分子质量较大,结构中含有多个氨基、亚氨基等极性基团,对纤维具有较强的亲合力.另一方面,丝绸和羊毛的等电点分别为3.9和4.5[14],当染色p H为4~5,蛋白质纤维在等电点以上染色时,纤维带负电荷,染料中的氨基吸附正电荷而显正性;染料正电荷与纤维负电荷形成盐键结合,正负电荷吸引使染料更快、更多地上染到纤维上.因此铬络合交联染料在丝绸和羊毛上的竭染率很高.

表5 交联染料在丝绸和羊毛上的染色性能Tab.5 Dyeing performance of crosslinking dyes on silk and wool
纤维染色结束后用交联剂DAST作为桥基将交联染料以共价键的形式固色到染色纤维上.结果发现,络合交联染料的交联率均高于相应的交联染料母体,这是因为前者对纤维具有更高的亲合力,固色时不易从纤维上解吸下来;同时分子结构中含有多1倍的氨基和亚氨基,交联固色时通过交联剂与纤维结合的几率更高,因此具有更高的固色率.
铬络合交联染料及其相应的交联染料母体在丝绸和羊毛上的各项牢度如表6所示.结果发现交联染料母体经过与铬离子络合后,日晒牢度可以明显提高2-3级,水洗牢度和摩擦牢度达到可使用标准.
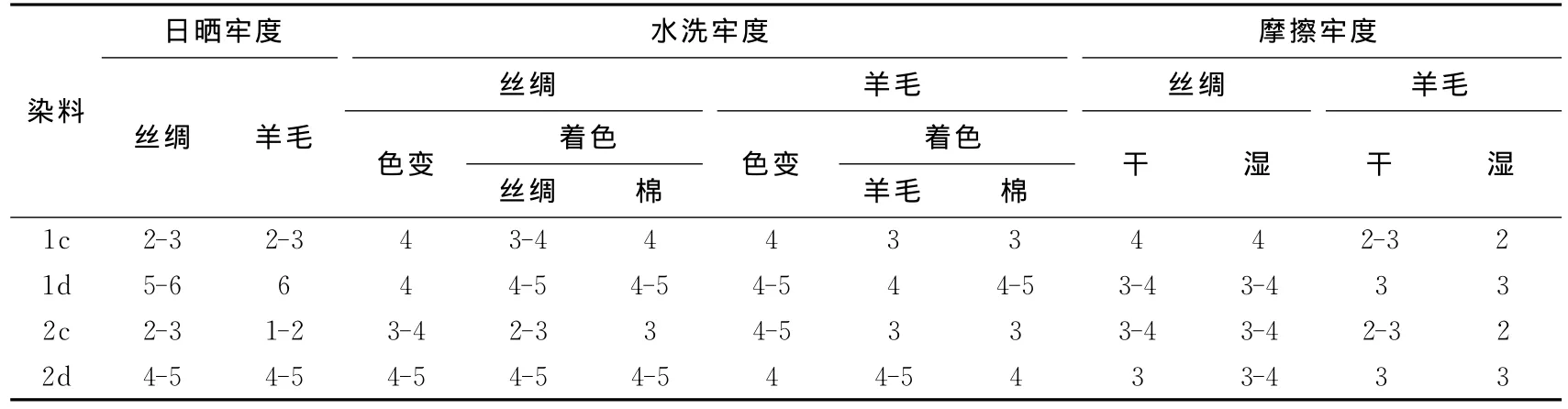
表6 交联染料在丝绸和羊毛上的牢度性能Tab.6 Fastness properties of crosslinking dyes on silk and wool
3 结 论
本文通过四步法合成了两支含有可交联多胺基团的铬络合交联染料,并用无盐浸染的清洁染色工艺在丝绸和羊毛上进行染色,以交联剂为桥基以共价键的结合方式连接到纤维上.铬络合交联染料在丝绸和羊毛上的竭染率可以分别达到96%和94%,交联率均可达到97%.通过考察染色纤维的各项牢度发现,交联染料分子中引入铬离子,可使其日晒牢度提高2-3级,其水洗牢度和摩擦牢度均达到可使用标准.
[1]KELSHAW P.The future for west European dyestuff manufacturers[J].Journal of the Society Dyers and Colourists,1998,114(2):35-37
[2]LEI X P,LEWIS D M,SHEN X M,etal.Crosslinking nucleophilic dyes on wool[J].Dyes and Pigments,1996,30(4):271-281
[3]TANG B T,ZHANG S F,YANG J Z,etal.Synthesis and dyeing performance of a novel yellow crosslinking polymeric dye[J].Coloration Technology,2004,120(4):180-183
[4]LI Y L,ZHANG S F,YANG J Z,etal.Synthesis and application of novel crosslinking polyamine dyes with good dyeing performance[J].Dyes and Pigments,2008,76(2):508-514
[5]周春隆.酸性染料及酸性媒介染料[M].北京:化学工业出版社,1989
[6]SOKOLOWSKA-GAJDA J,FREEMAN H S,REIFE A.Synthetic dyes based on environmental considerations,Part I:Iron complexes for protein and polyamide fibers[J].Textile Research Journal,1994,64(7):388-396
[7]SOKOLOWSKA-GAJDA J.Photodegradation of some 1∶2 metal-complexed azo dyes in an amide environment[J].Dyes and Pigments,1998,36(2):149-159
[8]TANG L J,ZHANG S F.Synthesis of chlorosulfonyl-containing pyrazolone azo compounds with thionyl chloride-DMF system[J].Chinese Journal of Chemical Engineering,2004,12(5):719-722
[9]CHEON Kap-soo,PARK Y S,KAZMAIER P M,etal.Studies of azo-hydrazone tautomerism and H-bonding azo-functionalized dendrimers and model compounds[J].Dyes and Pigments,2002,53(1):3-10
[10]YASUDA H,MIDORIKAWA H.The structure of 2-pyrazolin-5-one dyes[J].Journal of Organic Chemistry,1966,31(6):1722-1725
[11]BASAIF S A,HASSAN M A,GOBOURI A A.AlCl3-catalyzed diazocoupling of 1-(aryl/hetaryl)-3-phenyl-1 H-pyrazol-2-in-5-ones in aqueous medium.Synthesis of hetaryl-azopyrazolones and their application as disperse dyes[J].Dyes and Pigments,2007,72(3):387-391
[13]格里菲思J.颜色与有机分子结构[M].北京:化学工业出版社,1985
[14]张壮余,吴祖望.染料应用[M].北京:化学工业出版社,1991
