眼针疗法对脑缺血再灌注大鼠脑源性神经营养因子表达的影响*
2011-02-06王守岩孙宏伟张立德关洪全
高 原 王 哲 王 健 于 丹 王守岩 孙宏伟 张立德 关洪全
辽宁中医药大学(辽宁沈阳110847)
脑梗死占脑血管病发病率80%左右,病死率、复发率和致残率均高。在我国,其死亡率仅次于恶性肿瘤,严重危害人类的健康[1]。我们以往研究和临床观察证实眼针治疗中风病疗效肯定,尤其是急性期效果显著,但其是否对卒中后脑可塑性有益尚未见报道。为此,我们通过眼针疗法对缺血再灌注脑皮质中脑源性神经营养因子(BDNF)表达的影响研究,探讨其对大鼠脑缺血再灌注后脑可塑性的作用及可能机制,为眼针治疗脑缺血性疾病提供实验依据。
1 材料与方法
1.1 实验动物 健康SD大鼠32只,雌雄不拘,体质量(280±20)g,由北京维通利华实验动物中心提供。适应性喂养1周,自由饮水、摄取标准颗粒饲料,室内温度22℃,相对湿度45%。将大鼠随机分为正常对照组、假手术组、模型组、眼针组,每组8只。
1.2 试药 实时定量PCR试剂盒购自TaKaRa大连宝生物。BDNF引物由北京华大基因公司合成。亲和纯化兔抗鼠BDNF多克隆抗体、即用型SABC免疫组化染色试剂盒及DAB染色试剂均购自武汉博士德生物工程有限公司。
1.3 模型制备与评价 模型组及眼针组参照文献[2],采用改良的线栓法复制大鼠大脑中动脉缺血再灌注损伤模型。模型成功标准:大鼠于缺血2h后进行再灌注,再灌注24h后进行神经功能缺损评分,参照Zea Longa 5分制评分标准:0分为无症状;1分为不能完全伸展对侧前爪;2分为向对侧转圈;3分为向对侧倾倒;4分为不能自发行走,意识丧失。评分为1~3分者纳入实验组,未达标准者排除。假手术组术式同模型、眼针组,区别在于钓鱼线插入深度为0.5~1cm,其他同手术组。正常组未处理。
1.4 眼针取穴及刺法 眼针组:用31号13mm毫针,于大鼠眶周2mm处针刺,定位参照人体取穴方法,取肝区、上焦区、下焦区、肾区针刺。手法:平刺,进针3mm。留针20min,留针10min时用刮柄进行刮针1次,刮针5下。治疗时机:眼针组于脑缺血再灌注即刻、12h及取材前30min,分别进行眼针治疗。

图1 大鼠眼针取穴部位示意图
1.5 标本采集与检测
1.5.1 脑皮质BDNF蛋白表达(免疫组化SABC法)检测 10%水合氯醛(3.5mL/kg)腹腔麻醉,开胸暴露心脏,先以 0.9%氯化钠注射液 200mL灌至无血色后,再更换4%多聚甲醛200mL进行灌注。开颅取脑,后固定于同一固定液中6h,脑组织取材参照脑立体定位图谱,以Bregma点前后各0.2mm为取材区间,常规脱水、石蜡包埋。将包埋的蜡块作5μm切片,免疫组化按试剂盒操作。BDNF以细胞膜或细胞浆出现清晰棕褐色颗粒为阳性。使用BI2000医学图像分析系统对采集的图像测定阳性反应物的灰度,每例动物随机取3~4张切片,且各组所选部位相同。
1.5.2 脑皮质 BDNF蛋白表达(Western blot法)检测 于缺血再灌注24h后对大鼠给予10%水合氯醛腹腔注射麻醉后断头取出右侧大脑皮质,按脑组织净重∶裂解液=1∶10的比例,加入相应体积的裂解液,pH为7.5,将样品剪碎后匀浆、离心、上清即为总蛋白。兔抗鼠 BDNF 一抗(1∶500);O-dianidine,β-naphthyl acid phosphate显色;扫描仪扫描NC膜,分析结果。
1.5.3脑皮质BDNFmRNA表达检测 采用实时定量RT-PCR方法。 BDNF 上游引物:5′ATGGGTTACACGAAGGA 3′;BDNF 下游引物:5′GCCCGAACATACGATT 3′。 β-actin 为内参,其上下游引 物 分 别 为 :5′CGTGCGTGACATTAAAGAG 3′,5′TTGCCGATAGTGATGACCT 3′。所有的产物在ABIPrism 7500 HT序列检测系统中运行。读取CT值,以管家基因β-actin为内参,以扩增倍数作为比较的依据,△CT=CT目的基因-CTβ-actin,△△CT=△CT实验-△CT对照,扩增倍数=2-△△CT。将所扩增的PCR产物同时进行溶解曲线分析。
1.6 统计学处理 采用SPSS 10.0统计软件分析,数据以(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组神经功能缺损评分比较 模型组和眼针组大鼠均出现不同程度的神经功能障碍,如提尾时左侧前肢不能伸直,行走向对侧旋转或倾倒等;假手术组大鼠无神经功能障碍表现。缺血再灌注24h后,模型组大鼠神经功能缺失症状明显加重,与造模后即刻神经功能缺损程度评分无差异。眼针组大鼠经眼针治疗后与造模后即刻神经功能缺损程度评分有差异(P<0.01)。
表1 各组脑缺血再灌注损伤24h后神经缺损程度评分比较 (分,±s)

表1 各组脑缺血再灌注损伤24h后神经缺损程度评分比较 (分,±s)
与本组再灌注后即刻比较,△P<0.01;与同一时间点模型组比较,*P<0.01。
组 别 n正常组 8再灌注后即刻-24h假手术组 8模型组 8---2.625±0.9161眼针组 82.625±0.9161 3.125±0.6409△1.500±0.5345*
2.2 眼针对大鼠脑缺血再灌注24h后脑皮质BDNF蛋白表达的影响 免疫组化方法检测结果:图2、表2。正常组大鼠和假手术组大鼠均有多量BDNF阳性染色,模型组大鼠BDNF的阳性表达显著降低。模型组大鼠脑皮质BDNF表达明显低于正常组大鼠和假手术组大鼠(P<0.01)。眼针组大鼠脑皮质BDNF表达明显高于模型组大鼠,有显著差异(P<0.01)。

图2 各组脑组织切片图(×400)
Western blot方法检测结果:见图3、表2。模型组大鼠脑皮质BDNF蛋白表达强度明显低于正常组大鼠和假手术组大鼠,眼针组大鼠脑皮质BDNF蛋白表达明显强于模型组,均有显著差异(P<0.01)。
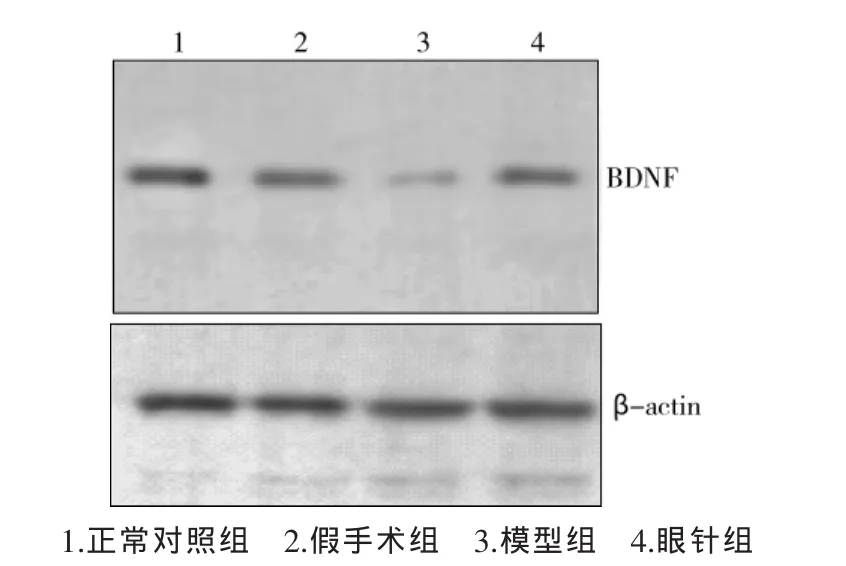
图3 脑组织BDNF蛋白表达电泳图
表2 各组脑缺血再灌注24h后脑皮质BDNF蛋白表达比较 (±s)

表2 各组脑缺血再灌注24h后脑皮质BDNF蛋白表达比较 (±s)
与模型组比较,*P<0.05,**P<0.01。
组 别 n正常组 8 Western BDNF灰度值0.7124±0.0234**0.6990±0.0381**0.3677±0.0280 0.6795±0.0374**免疫组化BDNF灰度值161.3377±11.8654**假手术组 8模型组 8 154.2837±14.8198**122.0856±10.5518眼针组 8143.3383±13.2793**
2.3 眼针对大鼠脑缺血再灌注24h后脑皮质BDNFmRNA表达的影响 见图4。BDNF基因扩增产物大小为86bp,β-actin基因扩增产物为132bp。模型组脑组织BDNFmRNA表达较正常组、假手术组减少,眼针组表达较模型组增高(P<0.01)。
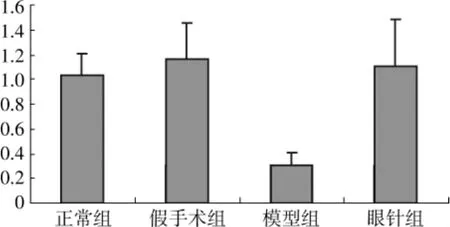
图4 各组大鼠脑皮质BDNFmRNA表达的比较
3 讨 论
眼针疗法是辽宁中医学院彭静山教授经过20余年的潜心研究,以中医脏腑经络理论为基础,结合全息论、五轮八廓学说,华佗的观眼察病方法,通过长期临床实践而创立的一种微针疗法,单纯眼针治疗可收到明显的患肢主动抬高的即效应。眼睛通过纵横交错,网络全身的经络与脏腑及其他器官保持密切的联系。脑缺血再灌注损伤与肝、肾二脏阴阳失调以及经络血脉逆乱有关。眼针通过刺激上、下焦区而疏通上、下肢气血,促进肢体功能恢复,刺激肝、肾区调解脏腑阴阳而治病之根本,故疗效显著。
BDNF产生于中枢神经系统的神经元及星形胶质细胞,在脑内分布最为广泛,对发育中的交感、运动、感觉神经元的存活、分化和增殖,以及防止运动神经元的退行性变有促进作用[3-4],还具有抗凋亡作用[5]。BDNF是一类调节神经系统发育、成熟、维持神经元功能的天然蛋白质,是唯一不断地在中枢神经系统和周围神经组织中表达的神经营养因子,是神经细胞发育成熟过程中促进和维持细胞生长、存活和分化的依赖因子,同时也是神经元受损时,保护其存活和促进其再生的必须因子。有研究显示[6],脑缺血后机体可通过促进内源性BDNF的表达,提高神经元抵抗缺血损伤的能力,促进受损神经元的修复和再生,是机体的一种自我保护机制。但本研究中显示,当脑缺血再灌注24h后未见脑皮质BDNF表达增加反而下降,因为脑损伤后BDNF代偿性分泌增加水平有限,且持续时间亦较短,提示机体的自身代偿能力是有限的,推测这种代偿机制可能发生在24h之内。因此如何有效地利用并促进内源性BDNF的表达,可能是治疗缺血性神经损伤的有效途径之一。本实验结果表明正常组大鼠脑皮质有较多量的BDNF的表达,模型组大鼠脑皮质BDNF的表达下调,眼针组大鼠脑皮质中BDNF的表达较模型组明显上调,促进神经元缺血再灌注损伤后的修复,使大鼠神经功能缺损症状得到一定的缓解。
通过刺针眼穴肝区、上焦区、下焦区、肾区治疗后可以有效地利用并促进内源性BDNF的表达,从而发挥对脑细胞损伤的保护作用,为临床上进一步应用眼针治疗缺血性脑血管疾病奠定理论基础。
[1] Zhang JT.The progress of study on neuropharmacology[M].Beijing:people′sMedicalPublishing House,2002:49-50,66-79.
[2] 马贤德,孙宏伟,柴纪严,等.线栓法制备大鼠脑缺血再灌注模型的方法研究[J].中华中医药学刊,2009,27(6):1200-1201.
[3] Ying SX,Cheng JS.Effectof electro-acupuntureon c-fos expression in gerbilhippcampusduring transientglobal ischemia[J].Acupuncture Electro-therapeuticsRes,1994,19(6):207-213.
[4] Tsukahara T,YoneKawa Y,Tanaka K.The role of brain derived neurotrophic factor in transientfore brain ischemia in the rat brain[J].Neurosurgery,1994,34(5):323-331.
[5] Pringle A K,Sundstrom LE,Wild G J.Brain derived neurotrophic factor,but not neitrophin-3,prevents ischemia induced neuronal cell death in orgenotypic rathippocampus slice cultures[J].NeurosciLett,1996,211(15):203-206.
[6] 张永全,莫国焕,陈明,等.三七总皂苷对脑缺血再灌注大鼠BDNF表达的影响[J].中成药,2008,30(7):958-961.
