仿刺参皂苷类化合物的电喷雾负离子质谱裂解规律研究
2011-02-02于林芳陈士国王静凤李兆杰薛长湖
于林芳,徐 杰,陈士国,薛 勇,王静凤,李兆杰,薛长湖
(中国海洋大学,食品科学与工程学院,山东青岛 266003)
仿刺参皂苷类化合物的电喷雾负离子质谱裂解规律研究
于林芳,徐 杰,陈士国,薛 勇,王静凤,李兆杰,薛长湖
(中国海洋大学,食品科学与工程学院,山东青岛 266003)
采用电喷雾-四极杆-飞行时间质谱(ESI-Q-TOF MS)在负离子检测方式下,对仿刺参中4种皂苷类成分的裂解途径进行研究。通过 ESI-MS产生的[M-H]-获得相应化合物的相对分子质量信息,对[MH]-进行碰撞诱导解离(CID)获得相应化合物的裂解途径信息。研究发现,4种皂苷化合物的 ESI-MS/MS裂解规律相同,首先断裂苷元上的18(20)内酯键,然后连续丢失糖链的末端单糖,最后生成苷元的特征碎片离子m/z423,这些特征有助于皂苷类化合物的结构解析。
仿刺参;皂苷;质谱;裂解规律
海参皂苷是棘皮动物海参体内所特有的一类三萜皂苷,由苷元和寡糖链两部分组成,苷元均为羊毛甾烷的衍生物,寡糖链一般由2~6个单糖组成,常见的单糖有木糖(Xyl)、奎诺糖(Qui)、葡萄糖(Glc)、甲基葡萄糖(MeGlc)和甲基木糖(MeXyl),其化学结构较复杂,且呈现多样性[1]。研究表明,海参皂苷具有抗真菌、抗病毒、细胞毒活性、免疫调节等广泛的药理活性[2-6]。仿刺参(A postichopus japonicusSelenka)在食用海参中品质最好,具有较高的食用和药用价值[7],因此,对仿刺参体内皂苷的结构研究具有重要意义。
由于皂苷类化合物具有极性大、难挥发、相对分子质量大等特点,因此分离纯化及结构测定具有一定的难度。目前,已有文献[8-10]报道采用质谱技术对皂苷类结构的研究,但对海参皂苷的质谱研究鲜有报道。本工作探讨仿刺参体内皂苷类成分的质谱裂解规律,应用电喷雾负离子模式对分离得到的皂苷单体进行二级质谱研究,分析讨论4种皂苷的主要特征碎片离子,发现并总结裂解规律,为进一步研究其他具有相似结构的皂苷类化合物提供依据。
1 试验部分
1.1 主要仪器与装置
Ultima GLOBAL Q-TOF质谱仪:美国Waters公司产品,配有电喷雾离子源(ESI)及Masslynx 4.1工作站。
1.2 主要材料与试剂
海参皂苷 (holotoxinA1、holotoxinB1、holotoxin A和cladoloside B):由本实验室从仿刺参中提取制备并纯化,其化学结构式示于图1;乙腈(色谱纯):美国 Muskegon公司产品;超纯水:美国Millipore公司产品。
1.3 试验条件
电喷雾离子化,负离子模式检测,毛细管电压3.0 kV,锥孔电压35 V,碰撞诱导解离(CID)能量50 eV,离子源温度80℃,干燥气温度150℃,质量扫描范围m/z200~2 000,雾化气(N2)流速15 L/h,干燥气(N2)流速250 L/h,碰撞气为氩气,直接进样法进样。

图1 4种皂苷的化学结构式Fig.1 Chemical structures of four triterpene glycosides
2 结果与讨论
2.1 一级质谱分析
4种皂苷结构相似,仅糖链上的单糖组成及数量有差别,在电喷雾质谱中均以[M-H]-准分子离子形式存在,几乎没有碎片离子,易于确定化合物的相对分子质量。4种皂苷的一级质谱图示于图2。
2.2 二级质谱裂解规律分析
为了研究分子结构与裂解途径之间的关系,分别对4种皂苷类化合物的[M-H]-准分子离子峰进行CID分析。由于4种化合物具有基本骨架相同、结构相似的特点,通过比较结构信息和质谱信息,发现它们在软电离状态下均存在中性丢失和一系列糖苷键断裂的裂解碎片。

图2 4种皂苷的负离子ESI-MS图Fig.2 ESI-MS spectra of four triterpene glycosides in negative mode
2.2.1 Holotoxin A1的二级质谱分析 Holotoxin A1的准分子离子[M-H]-为m/z1 391,通过适当调整碰撞解离电压,在一定气体碰撞能量下进一步碎裂,生成一系列糖苷键断裂产生的碎片离子,holotoxin A1的二级质谱及裂解模式示于图3。在MS/MS谱图中,m/z1 347离子为[M-H]-失去44 u产生的碎片,推测可能为苷元上18(20)内酯键断裂后,丢失中性CO2片段生成的。该离子首先碎裂失去β糖链末端的MeGlc(176)和 Xyl(132),生成碎片离子m/z1 171(Y3β)和m/z1 039(Y2β);进一步丢失α糖链末端的MeGlc(176)和 Glc(162),生成碎片离子m/z863(D2β-1α)和m/z701(D2β-2α);继续丢失 Qui(146)和 Xyl(132)后,生成m/z555(D1β-2α)离子和苷元的特征碎片离子m/z423(Y0),这也证实了中性CO2的丢失发生在苷元上。图3a中未归属的碎片峰由其他次要的糖链断裂模式生成,由于主要断裂方式的碎片峰丰度较高,其他碎片峰并不影响判断,因此没有进一步归属。
2.2.2 Holotoxin B1的二级质谱分析 Holotoxin B1与holotoxin A1结构上的区别仅在于α糖链末端的单糖,选定holotoxin B1的准分子离子峰m/z1 378进行碰撞,其主要二级裂解途径与holotoxin A1相同,示于图4。首先断裂苷元上的18(20)内酯键,生成丰度较高的m/z1 333离子,该离子先丢失β糖链末端的MeGlc(176)和 Xyl(132),生 成m/z1 157(Y3β) 和m/z1 025(Y2β)离子;再连续丢失α糖链末端的2个Glc(162),生成与holotoxin A1相同的m/z863(D2β-1α)和m/z701(D2β-2α)离子 ;最终丢失 Qui(146)和 Xyl(132)后,生成m/z423(Y0)的特征苷元碎片。图4中也有其他次要的糖链裂解途径生成的碎片峰,可见,虽然糖苷键断裂方式多样,但β糖链末端的MeGlc更易于断裂丢失,因此该裂解方式生成的碎片峰丰度均较高。
2.2.3 Holotoxin A的二级质谱分析 在一定的气体碰撞能量下,对holotoxin A的准分子离子m/z1 421进行CID碎裂,其二级质谱图示于图5。m/z1 421离子也首先断裂苷元上的18(20)内酯键,生成m/z1 377离子,由于α和β糖链末端均为MeGlc(176)和 Glc(162),断裂生成的碎片离子相同,根据2.2.1和2.2.2的结果,推测m/z1 377离子首先丢失β糖链末端的MeGlc(176)和 Glc(162),生成m/z1 201(Y3β)和m/z1 039(Y2β)离子 ;再丢失α糖链末端的 MeGlc(176)和 Glc(162),生成m/z863(D2β-1α)和m/z701(D2β-2α)离子 ;最后丢失 Qui(146)和 Xyl(132),生成m/z423(Y0)的特征苷元碎片。由于α和β糖链末端的2个单糖相同,断裂生成的碎片离子相同,因此该MS/MS谱图比较简单,其他碎片峰较少。

图3 Holotoxin A1的二级质谱图(a)及裂解模式图(b)Fig.3 ESI-MS/MS spectra of holotoxin A1(a)and fragmentation pattern(b)

图4 Holotoxin B1的二级质谱图Fig.4 ESI-MS/MS spectra of holotoxin B1

图5 Holotoxin A的二级质谱图Fig.5 ESI-MS/MS spectra of holotoxin A
2.2.4 Cladoloside B的二级质谱分析 Cladoloside B的糖链由5个单糖组成,选定cladoloside B的准分子离子峰m/z1 215进行碰撞,其二级质谱示于图 6。该离子断裂苷元上的18(20)内酯键丢失中性CO2片段,生成丰度较高的m/z1 171离子;然后失去β糖链末端的MeGlc(176)和 Xyl(132),生成m/z995(Y3β)和m/z863(Y2β)离子;再丢失α糖链末端的 Glc(162),生成m/z701(D2β-1α)离子 ;最后丢失 Qui(146)和 Xyl(132),生成m/z423(Y0)的特征苷元碎片,裂解模式与前3种皂苷相同。
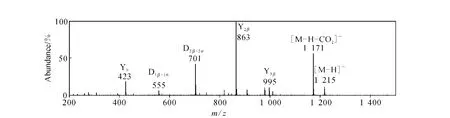
图6 Cladoloside B的二级质谱图Fig.6 ESI-MS/MS spectra of cladoloside B
3 结论
采用电喷雾飞行时间质谱法对仿刺参中4种皂苷类化合物的质谱裂解途径进行研究,分析了主要的特征碎片离子、裂解模式及相应的ESI-MS/MS图谱特征。4种皂苷类化合物的裂解途径相似,均首先丢失中性分子CO2,然后丢失β糖链末端的2个单糖,再丢失α糖链末端的单糖,最后依次丢失 Qui和 Xyl,生成m/z423的苷元片段。这些碎片特征将为具有相似结构特征的皂苷类化合物苷元及糖链的结构解析提供重要依据。
[1]孙 鹏,易杨华,李 玲,等.海参皂苷的生源分类和化学结构特征(楯手目)[J].中国天然药物,2007,5(6):463-469.
[2]ANISIMOV M M,PROKOFIEVA N G,KOROTKIKH L Y,et al.Comparative study of cytotoxic activity of triterpene glycosides from marine organisms[J].Toxicon,1980,18(2):221-223.
[3]KALININ V I,PROKOFIEVA N G,LIKHATSKAYA G N,et al.Hemolytic activities of triterpene glycosides from the holothurian order Dendrochirotida:Some trends in the evolution of this group of toxins[J].Toxicon,1996,34(4):475-483.
[4]KUMAR R,CHATURVEDI A K,SHUKLA P K,et al.Antifungal activity in triterpene glycosides from the sea cucumberActinopyga lecanora[J].Bioorganic&Medicinal Chemistry Letters,2007,17(15):4 387-4 391.
[5]J IN J,SHASTINA V,SHIN S,et al.Differential effects of triterpene glycosides,frondoside A and cucumarioside A2-2 isolated from sea cucumbers on caspase activation and apoptosis of human leukemia cells[J].FEBS Letters,2009,583(4):697-702.
[6]DANG N H,THANH N V,KIEM P V,et al.Two new triterpene glycosides from the vietnamese sea cucumber holothuria scabra[J].Arch Pharm Res,2007,30(11):1 387-1 391.
[7]廖玉麟.中国动物志棘皮动物门海参纲[M].北京:科学出版社,1997:154.
[8]LIU S Y,CUI M,LIU Z Q,et al.Structural analysis of saponins from medicinal herbs using electrospray ionization tandem mass spectrometry[J].J Am Soc Mass Spectrom,2004,15(2):133-141.
[9]GUO M Q,SONG F R,BAI Y,et al.Rapid analysis of a triterpenoid saponin mixture from plant extracts by electrospray lonization tandem mass spectrometry[J].Anal Sci,2002,18(4):48-484.
[10]MADL T,STERK H,MITTELBACH M,et al.Tandem mass spectrometric analysis of a complex triterpene saponin mixture ofChenopodium quinoa[J].J Am Soc Mass Spectrom,2006,17(6):795-806.
Study on the Fragmentation Pathways of Triterpene Glycosides from Apostichopus japonicus Selenka by Negative Electrospray Ionization Mass Spectrometry
YU Lin-fang,XU Jie,CHEN Shi-guo,XUE Yong,WANGJing-feng,LI Zhao-jie,XUE Chang-hu
(College ofFood Science and Technology,Ocean University of China,Qingdao266003,China)
The fragmentation pathways of four triterpene glycosides fromA postichopus japonicusSelenka were investigated in negative ion mode by ESI-Q-TOF MS.The[M-H]-ions were observed by ESI-MS,from which the molecular weights were obtained.The collision induced dissociation(CID)data of the[M-H]-ions provide fragmentation pathways of the triterpene glycosides.Results show that four compounds have the same fragmentation pathway.The cleavage is initiated by a loss of 18(20)-lactone residue from the aglycon,then consecutively loses monosaccharide residue of sugar chain,and finally yields a signature ion peak atm/z423.These characteristic fragmentations will be helpful in identifying the structures of triterpene glycosides.
A postichopus japonicusSelenka;triterpene glycosides;mass spectrometry;fragmentation pathways
薛长湖(1964~),男(汉族),江苏兴化人,从事水产品加工、水产化学研究。E-mail:xuech@ouc.edu.cn
O 657.63
A
1004-2997(2011)02-0077-05
2010-05-07;
2010-07-22
国家自然科学基金(31000795),海洋公益性行业科研专项(201105029),国际科技合作项目(2010DFA31330)资助
于林芳(1985~),女(汉族),山东烟台人,硕士研究生,从事天然产物提取纯化研究。E-mail:yulinfang77@yahoo.cn
