尼莫地平对耳蜗缺血再灌注损伤的保护作用
2011-01-23夏树前龚树生李娇张富刚
夏树前 龚树生 李娇 张富刚
内耳动脉似弹簧螺旋样走行,血流经过这种极端弯曲的血管后,一方面变得缓慢而平稳,另一方面,弹簧样结构是保持局部血流自我调节稳定的生理结构基础,再加上血管路径较长,易发生血流淤滞和脂质沉积,故易发生阻塞。疑为缺血引起的内耳病变,经颞骨解剖观察,仅少数出现完全动脉阻塞的病理变化,可能为一过性内耳血流受阻后又部分或完全恢复,即发生了缺血再灌注。组织器官缺血再灌注损伤中均发现有钙离子内流,细胞钙超载,从而导致细胞凋亡,抑制钙离子内流以期抑制细胞凋亡是目前研究的热点。尼莫地平作为钙离子拮抗剂,在心脑等器官缺血再灌注损伤中具有良好的保护作用,本研究旨在探讨尼莫地平对耳蜗缺血再灌注损伤的保护作用及可能机制。
1 材料与方法
1.1实验动物与分组 选取42只豚鼠,雌雄不拘,随机分为:实验组18只,尼莫地平干预组18只,对照组6只。实验组与干预组按ABR检测时间及断头取听泡时间又分为再灌注1、2和6 h 3个时间点,每一时间点6只豚鼠。对照组6只豚鼠不造模,作为空白对照。
1.2实验仪器及试剂 激光多普勒血流量仪(Periflux System 5000,Perimed,瑞典),视窗版perisoft软件分析数据,ABR检测仪(Bio-logic Systems 美国)。FeCl3(三氯化铁,天津化学试剂三厂),分析纯,配成40%水溶液;尼莫地平(德国拜耳股份有限公司),用量为0.5 mg/kg。
1.3实验方法
1.3.1缺血再灌注模型的制备 实验组与干预组豚鼠腹腔注射6%水合氯醛0.6 ml/100 g,麻醉后动物仰卧于手术台,头架固定头部,颈前正中气管切开,插管,自主呼吸。自气管旁进路,分离附着于颅底的肌肉组织,暴露枕部颅底,于右侧颅底用电钻磨开一约2 mm×4 mm骨窗,刺破硬、软脑膜,暴露小脑前下动脉。将浸有5 μl 40%FeCl3的滤纸覆盖于小脑前下动脉上,5分钟后撤除滤纸,生理盐水冲洗局部。连续记录耳蜗血流量(cochlear blood flow,COBF)变化,30分钟后COBF不再下降并稳定,标志血栓形成。干预组在应用FeCl310分钟前经颈外静脉注射尼莫地平0.5 mg/kg,实验组注射等量生理盐水,正常对照组不注射任何药物。小脑前下动脉血栓形成后,生理盐水稀释尿激酶至1×104U/ml,干预组和实验组于颈外静脉给予尿激酶4 000 U/kg缓慢推注,30分钟后COBF不再上升且稳定,标志血栓溶解、血流再灌注。
1.3.2耳蜗血流量测量方法 打开右侧听泡,暴露耳蜗,三维固定仪固定激光多普勒流量仪探针型探头,使探头尖端轻轻接触耳蜗底回外侧壁,测量耳蜗血流,稳定三分钟后连续记录,结果以PSW软件分析数据输出。
1.3.3ABR检测方法 干预组和实验组分别在缺血前、再灌注1、2、6 h时行ABR检测,对照组行一次ABR检测。同上法麻醉豚鼠,电极皆用直径0.38 mm、长13 mm的针灸针,记录电极置于双侧耳廓前缘连线中点的头顶皮下,参考电极置于同侧耳垂皮下,鼻尖部接地。刺激声为click,升降时间1 ms,平台期10 ms,交替波,带宽为100~1 500 Hz,刺激重复率为11次/秒,平均叠加300次,扫描时间10 ms,间期100 μs,声刺激强度以120 dB SPL开始,每10 dB一档减至阈值上下,然后5 dB一档升降确定阈值,以能引出明确的可重复波Ⅲ的最小刺激声强度作为阈值。
1.3.4耳蜗基底膜铺片及荧光染色 各组于ABR测试完毕后,断头取听泡,经4%多聚甲醛室温固定1小时后,于10 mmol/L PBS(pH7.4)中分离基底膜,平铺于玻片上,将浓度为10 μg/ml Hoechest33342 荧光染料 25 μl滴加在每一只标本上,避光30分钟,PBS冲洗三遍后,50%甘油封片,共聚焦显微镜下观察细胞核形态学变化。
1.3.5免疫组织化学染色观察螺旋神经节凋亡因子Casepase-3变化 10%水合氯醛溶液腹腔注射30 mg/kg,仰卧固定,开胸暴露心脏,灌流冲洗,随后灌注4%多聚甲醛磷酸缓冲液(pH 7.4)500 ml。将豚鼠迅速断头,快速取出耳蜗,在蜗顶钻孔并挑破圆窗膜和卵圆窗,用上述固定液重复进行耳蜗灌流至少5 次后,放入相同固定液中,4 ℃过夜。修剪后置入10%乙二胺四乙酸二钠充分脱钙3周左右,梯度酒精脱水,常规石蜡包埋,耳蜗中轴5 μm连续切片。Caspase-3免疫组化染色:耳蜗组织切片常规脱蜡至水,3%H2O2孵育10 min,蒸馏水冲洗。滴加抗原修复液1~3滴,孵育10 min,,蒸馏水冲洗。10%正常羊血清封闭20 min;实验组和干预组滴加兔多抗Caspase-3抗体(1:200),4 ℃过夜,对照组用正常羊血清代替一抗;加生物素标记二抗,37 ℃孵育30 min;PBS漂洗三次,滴加链酶亲和素-生物素-过氧化物酶复合物(SABC)反应液1~2滴,37 ℃二氨基联苯胺(DAB)显色; Mayer苏木素复染,梯度酒精脱水,透明、封片,显微镜(10×40)视野观察照相。以上试剂均由北京中山公司提供。
1.3.6图像分析处理 Caspase-3染色切片由新9.0版HPIAS-100高清晰度彩色病理图像免疫组化测量系统,在40倍视野下,每张切片随机取5个视野,测量每组螺旋神经节细胞的平均吸光度。各组动物于400倍光镜下在耳蜗底回末段和第二回起始段分别取三个视野计数缺损内毛细胞(缺失和损伤细胞),并计算内毛细胞缺损率(缺失加损伤细胞核与原有细胞核的比例)。
1.4统计学方法 全部数据经SPSS11.5统计包处理。采用重复测量资料方差分析进行统计。
2 结果
2.1耳蜗血流量监测 各组耳蜗血流量见表1,可见,栓塞30分钟时实验组和干预组耳蜗血流量较各组缺血前及对照组明显降低,再灌注后耳蜗血流量又有所回升,但仍较缺血前低,说明造模成功。耳蜗缺血再灌注前后,实验组与干预组耳蜗血流量差异无统计学意义(P>0.05)。
2.2ABR检测结果 各组ABR阈值变化见表2,可见,缺血前实验组、干预组、对照组的ABR阈值差异无统计学意义(P>0.05),再灌注后干预组ABR阈值较实验组明显降低(P<0.01),较对照组和缺血前仍明显升高(P<0.01)。
表1 各组不同时间点耳蜗血流量
表2 各组不同时间点ABR阈值
注:*与缺血前及实验组同时间点比较,P<0.01
2.3耳蜗基底膜铺片及荧光染色 对照组各回均有整齐排列的三排外毛细胞和一排内毛细胞,毛细胞无缺失,实验组和干预组外毛细胞未见明显的细胞核形态异常,内毛细胞均有不同程度的丢失及细胞核形态异常,各回基底膜中内毛细胞的损伤以底回为最,其次为第二回(图1)。各组各时间点内毛细胞缺损率见表3,实验组与干预组在同一时间点差异均有统计学意义(P<0.01)。
2.4螺旋神经节细胞Casepase-3免疫组化染色 实验组螺旋神经节细胞胞质内有染色程度不同的棕黄色颗粒分布,并随时间的延长逐渐增加,以再灌注6 h最多,干预组各时间点SGC有少量细胞质棕黄色颗粒分布,表达趋势同实验组,对照组染色阴性(图2)。图像分析各组平均吸光度值见表3,干预组和实验组各个时间点差异有统计学意义(P<0.01)。

表3 各组各时间点内毛细胞缺损率和耳蜗螺旋神经节细胞Caspase-3平均吸光度值
注:*与实验组比较,P<0.01
3 讨论
内耳缺血或栓塞可影响内耳的功能,自身免疫性疾病、感染、噪声、耳毒性药物等也可引起内耳缺血或缺血再灌注,从而引起内耳毛细胞和神经节细胞凋亡,导致耳聋或眩晕。
耳蜗由基底动脉的分支小脑前下动脉供血,小脑前下动脉属于终末动脉,无侧枝循环,发生阻塞时,不能由其他动脉的供血加以补偿,因而易造成耳蜗缺血。相对于部分研究者[1]通过栓塞双侧椎动脉,以微动脉夹钳夹—松开一侧颈总动脉来完成耳蜗缺血再灌注的造模方法, 本实验用FeCl3诱导小脑前下动脉血栓形成,以尿激酶溶解,更符合生理实际,并通过激光多普勒检测耳蜗血流的变化,客观地反映了耳蜗缺血再灌注变化过程。本实验结果显示,使用FeCl330分钟时,耳蜗血流量显著降低;再灌注1 h后,耳蜗血流量有所回升,动物ABR反应阈急剧升高,表明造模成功、可靠。
DNA荧光染料(PI或Hoechest33342)是一种快速、简便、可靠的方法,可用于定量检测坏死和凋亡的毛细胞[2]。而Casepase-3是casepase家族中重要一员,一般认为它是细胞凋亡过程中最重要的终末剪切酶,是细胞凋亡的执行者[3],它的出现标志着细胞凋亡。因此,本试验选取DNA荧光染料染色和Casepase-3免疫组化法分别观察耳蜗缺血再灌注过程中毛细胞和螺旋神经节细胞变化。结果显示,实验组外毛细胞核几乎无形态学上的变化,部分内毛细胞核固缩、缺失。Taniquchi[4]通过对豚鼠耳蜗缺血再灌注实验发现,耳蜗缺血再灌注30 min后即有内毛细胞核固缩,再灌注1 h即有核缺失,并且在24 h之内随时间延长缺失率上升,与本实验结果一致。本研究实验组缺血再灌注1、2、6 h螺旋神经节细胞均有大量Casepase-3表达,并且随着时间的延长而增加,表明在耳蜗缺血再灌注条件下,螺旋神经节细胞内促凋亡因素极为活跃,说明耳蜗缺血再灌注早期,内毛细胞和螺旋神经节细胞发生凋亡。
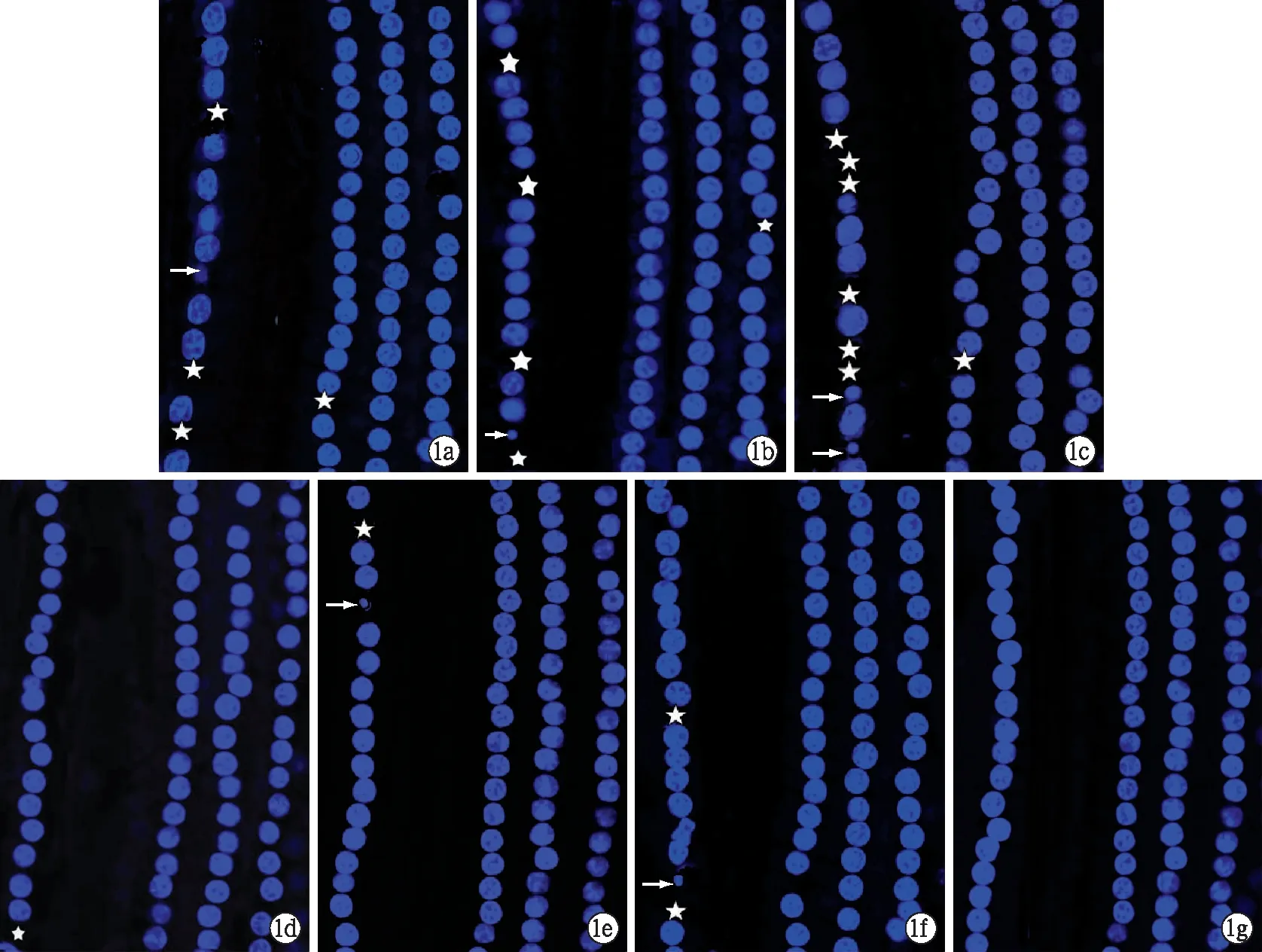
图1 各组耳蜗毛细胞核Hochest33342染色 a、b、c分别为实验组再灌注后1、2、6 h毛细胞核Hochest33342染色,d、e、f分别为对干预组再灌注后1、2、6 h毛细胞核 Hochest33342染色;g为正常对照组。 ★表示细胞核缺失,(→)表示细胞受损(细胞核固缩)。(共聚焦显微镜×400)
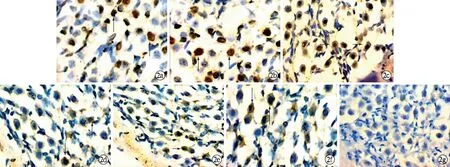
图2 各组螺旋神经节细胞Caspase-3免疫组织化学染色 a、b、c为实验组1、2、6 h螺旋神经节Caspase-3免疫组织化学染色,d、e、f为干预组1、2、6 h,g为正常对照组。箭头表示Caspase-3免疫组织化学染色阳性细胞(SABC×400)
关于耳蜗缺血再灌注的损伤机制,目前尚无定论。研究表明,耳蜗Cort器、螺旋神经节细胞中存在亲离子谷氨酸受体AMPA(α-氨基羟甲基恶唑丙酸),Corti器中AMPA受体位于内毛细胞和传入神经树突之间的轴突上,缺血再灌注后,刺激耳蜗内毛细胞和邻近的支持细胞释放大量的谷氨酸,激活AMPA受体,引起内毛细胞钙离子内流[5~7]。耳蜗螺旋神经节细胞除存在AMPA受体外,还存在ryanodine受体及 ryanodine受体门控的钙池,这种钙池有助于与听觉神经传导通路有关的钙离子信号传导[8],缺血时,内流的钙离子激活ryanodine受体,导致钙池钙离子释放[9]。另外,耳蜗缺血再灌注还可引起细胞膜钙离子ATP酶(PMCA)失活,不能有效地泵出钙离子[10]。通过上述机制,最终引起细胞内钙超载,从而导致细胞发生凋亡。
以往使用尼莫地平对心脑等器官缺血再灌注的研究表明,尼莫地平对缺血再灌注的作用为:①抑制钙离子内流,减轻线粒体钙超载,抑制线粒体氧化磷酸化藕联,从而恢复ATP生成[11];②减轻细胞内乳酸酸中毒:当细胞内pH值下降和钙积聚时,细胞通过钠—氢泵和钠—钙交换排出钙离子,因钙离子内流被抑制,使钠-钙交换减少,钠—氢交换相对增加,而排出更多氢离子;而对线粒体功能的保护亦抑制了乳酸的生成[12]。Schnee等[13]研究离体耳蜗外毛细胞钙离子电流时发现,尼莫地平可部分阻断海龟耳蜗毛细胞电压依赖性钙电流,减轻细胞内钙离子负荷,其抑制率与尼莫地平浓度有关。本实验干预组使用尼莫地平后,内毛细胞缺失减少,螺旋神经节Casepase-3表达下调,ABR反应阈较实验组明显降低,表明作为一种L型电压门控性钙通道阻滞剂,尼莫地平可能通过抑制钙离子内流从而直接或间接抑制促凋亡基因的表达,最终对缺血再灌注后的耳蜗起到有效的保护作用。
钙通道阻滞剂尼莫地平作为降压和扩管药物,应用于心脑血管疾病方面取得了良好的疗效,目前在耳科应用方面,大部分人仍然把它作为改善内耳血供的药物使用。但有学者[14]在豚鼠耳蜗缺血后使用尼莫地平,发现其并不能改善耳蜗血流,据此认为内耳缺血时不宜使用尼莫地平。本试验结果也证实尼莫地平无法有效的增加耳蜗血流,但并不能由此否定其对耳蜗缺血再灌注损伤的保护作用。另外,尼莫地平的浓度可能也是一个关键因素,有报道一定量尼莫地平会导致血管内皮细胞损伤,从而加重缺血再灌注时耳蜗细胞的损伤。本实验所用尼莫地平的浓度参阅多篇文献,并在预试验中反复试验,确保了作为保护剂的合理浓度。至于尼莫地平干预组与正常对照组ABR反应阈之间仍有统计学差异,表明尼莫地平还不能对缺血再灌注损伤起到完全预防保护作用,其机制尚有待进一步研究。
4 参考文献
1 吴昊,周维镕,徐彬.脉鼠耳蜗微循环障碍模型的实验研究[J].南通医学院报,2003,23:246.
2 Tabuchi K,Pak K,Chavez E, et al.Role of inhibitor of apoptosis protein in gentamicin-induced cochlear hair cell damage[J].Neuroscience,2007 ,12,149:213.
3 Mizutairi K, Matsunaqa T,Kamiya K,et al.Caspase inhibitor facilitates recovery of hearing by protecting the cochlear lateral wall from acute cochlear mitochondrial dysfunction[J].J Neurosci Res,2008,86:215.
4 Taniquchi M ,Hakuba N,Koqa K,et al.Apoptotic hair cell death after transient cochlear ischemia in gerbils[J].Neuroreport,2002,13:2 459.
5 Osborn KD, Zaidi A, Mandal A,et al. Single-molecule dynamics of the calcium-dependent activation of plasma-membrane Ca2+-ATPase by calmodulin[J]. Biophys J,2004, 87: 1 892.
6 Rizzuto R, Pozzan T. Microdomains of intracellular Ca2+: Molecular determinants and functional consequences[J].Physiol Rev,2006,86: 369.
7 Rachel T, Morton-Jones R T.Ca2+entry via AMPA-type glutamate receptors triggers Ca2+induced Ca2+release from ryanodine receptors in rat spiral ganglion neurons[J].Cell Calcium, 2008,43 : 356.
8 Morton-Jones RT,Cannel MB, Jeyakumar LH,et al. Differential expression of ryanodine receptors in the rat cochlea[J]. Neuroscience, 2006,137:275.
9 Erausquin GA. Transactivation of cell death signals by glutamate transmission in dopaminergic neurons[J]. Crit Rev Neurobiol,2004, 16:107.
10 Verkhratsky A. Physiology and pathophysiology of the calcium store in the endoplasmic reticulum of neurons[J]. Physiol Rev,2005,85:201.
11 Johnson JE Jr, Perkins GA, Giddabasappa A.Spatiotemporal regulation of ATP and Ca2+dynamics in vertebrate rod and cone ribbon synapses[J].Mol Vis,2007,13:887.
12 Dietz RM, Kiedrowski L, Shuttleworth CW.Contribution of Na+/Ca2+exchange to excessive Ca2+loading in dendrites and somata of Ca1 neurons in acute slice Hip[J].Pocampus,2007,17:1 049.
13 Schnee ME,Ricci AJ. Biophysical and pharmacological characterization of voltage-gated calcium currents in turtle auditory hair cells[J]. J Physiol,2003,549(Pt 3):697.
14 马英蓉,李学佩,赵一鸣,等.尼莫地平对正常和椎基底动脉供血障碍时耳蜗血流的影响[J].临床耳鼻咽喉科杂志,2002,16:174.
