鼓室注射Gd-DTPA后内耳MRI增强强度与造影剂浓度关系体外试验初步探讨
2011-01-23华清泉董昶刘阳林伟孙建军
华清泉 董昶刘阳 林伟 孙建军
梅尼埃病是一种以膜迷路积水为基本病理改变的特发性内耳疾病,由于目前的临床检查对其诊断价值的特异性不高且无法行内耳活检,故其诊断主要依据病史及典型症状。目前对梅尼埃病客观诊断研究的热点是鼓室局部注射核磁造影剂后扫描区分显影内、外淋巴液,从而从影像学角度直接观察内淋巴是否积水。2004年Duan[1]首次通过豚鼠圆窗膜局部浸润核磁造影剂的方式观察内耳增强显影,绘制了耳蜗各阶内的图像信号强度随时间变化图。受此实验启发,若能获得图像增强信号强度与造影剂浓度间的某种相关关系,即能将增强信号强度-时间变化图转化为造影剂在内耳的浓度-时间变化图。本实验通过体外试验探索磁共振信号增强强度与造影剂浓度间的关系,从而为鼓室局部注射造影剂后的内耳药物代谢特征研究提供依据。
1 材料与方法
1.1试剂及仪器 钆喷酸葡胺(Gd-DTPA)注射液(马根维显:德国拜耳公司,0.5 mmol/ml);生理盐水;15 ml离心管;加样枪;恒温水箱;GE 3.0T核磁共振仪及膝关节线圈;泡沫试管固定架等。
1.2不同浓度钆喷酸葡胺溶液的配制 浓度设计按两组进行,即分别以1.5 mmol/L(临床应用增强较理想浓度)为中心分别按等差(0.25 mmol/L递增)及等比数列(1:2倍增)配制两组Gd-DTPA浓度组:①0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25、2.5、2.75 mmol/L;②0.046 875、0.093 75、0.187 5、0.375、0.75、1.5、3.0、6.0、12、24、48 mmol/L;另增加1只空白对照管,共21只试管(浓度重复仅配一只试管)。
1.3核磁扫描 将各离心管外壁擦干置于泡沫试管架中固定后,将试管架置于膝关节线圈中心;核磁扫描在3.0 T核磁扫描仪(美国GE通用电气公司)下进行。使用3D-T1 FSE序列(Fast Spin Echo Sequence),扫描参数如下:TE(effective)=33.9 ms,TR=520 ms,带宽(bandwidth)=50 kHz,扫描层厚=1.2 mm,层距=0.9 mm,FOV=8*4 cm,矩阵=256*224,激励次数(NEX)=6,使用脂肪抑制、ZIP 512及ZIP*4重建技术,共重建32层,扫描时间为5分1秒。
1.4数据计算及统计学方法 使用GE工作站对核磁图像行信号强度的提取,ROI(region of interest)选择各离心管横截面中心部位,直接读取各离心管信号强度(signal intensity,SI,以灰度值表示);使用Excel(Microsoft office 2003)对数据进行统计,以造影剂浓度为横轴,SI为纵轴绘出散点图并分别进行两变量的相关与回归分析,使用SPSS17.0行回归方程的方差分析。
2 结果
离心管核磁扫描结果见图1。完成图像信号提取记录结果分别见表1、表2。以两组造影剂浓度(mmol/L)为横轴,以SI为纵轴绘出散点图后发现:在浓度递增组,当造影剂浓度≤1 mmol/L时SI呈线性增加,在1~1.5 mmol/L范围内SI不增反而轻度下降,浓度在1.5~2.0 mmol/L时SI再次上升,2.0~2.75 mmol/L范围内再次下降;在浓度倍增组,当造影剂浓度≤0.75 mmol/L时SI呈线性增加,当浓度继续倍增时SI快速下降。初步推测在造影剂较低浓度范围内(≤1 mmol/L),SI与其呈线性关系。
提取两组中造影剂浓度小于1 mmol/L的SI (不包括空白对照管)再次分别绘制散点图(图2,并示决定系数r2与回归方程)后发现,随着造影剂浓度的增加,磁共振信号强度随之呈线性增加。SI与造影剂浓度关系计算得出决定系数r2=0.96并得出回归方程Y=23 388X+8 120.1(F=138.07,P<0.01),证明两者的相关性良好,两者之间存在线性关系。

图1 离心管扫描MRI图像
编号1为空白盐水对照,2为浓度为0.25 mmol/L的稀释造影剂,余浓度依次为0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25、2.5、2.75、0.046 875、0.093 75、0.187 5、0.375、3.0、6.0、12、24和48 mmol/L
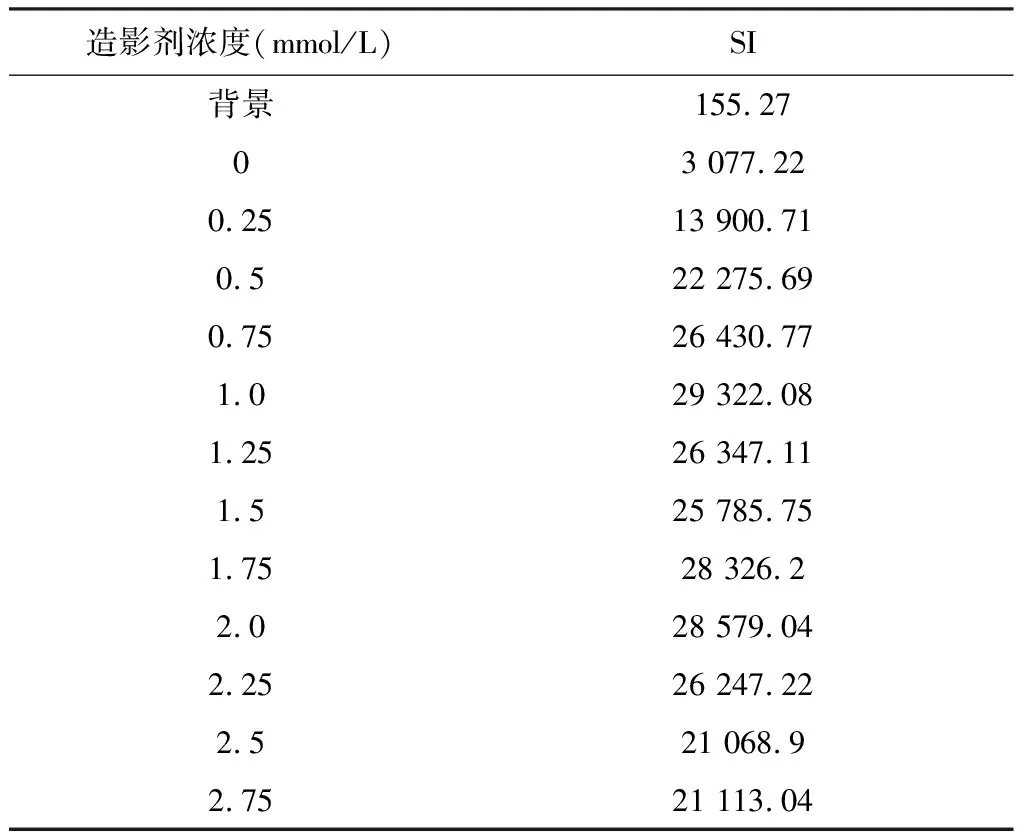
表1 浓度递增组SI
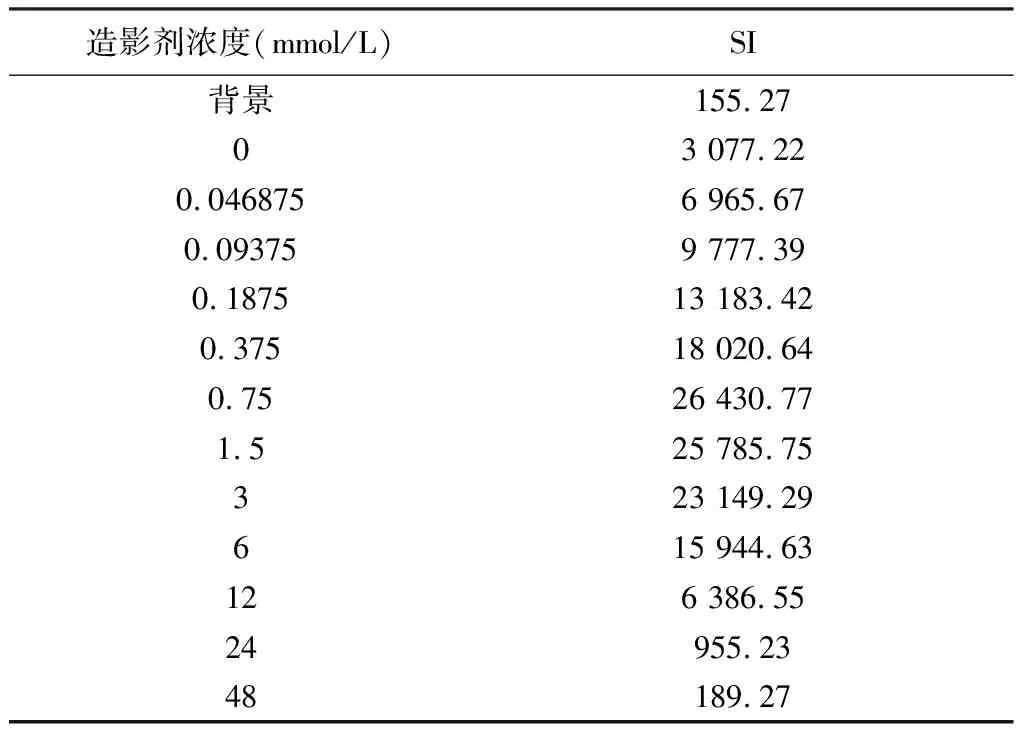
表2 浓度倍增组SI
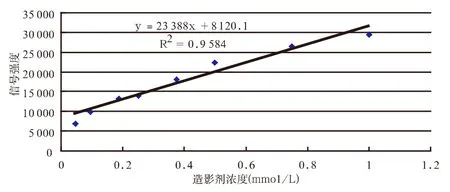
图2 SI与造影剂浓度线性关系,并示回归方程与决定系数
3 讨论
传统研究鼓室局部给药后的内耳药物代谢动力学的方法主要分如下几类:①将药物与免疫、放射性或荧光分子结合后局部注射,取出听泡后制作内耳切片,然后使用免疫组织(细胞)化学[2,3]、放射自显影[3]等技术来半定量的研究药物在内耳的分布;②鼓室给药后通过抽取淋巴液,使用高效液相色谱[4]、放射性免疫测定法[5]等微量检测法直接测定药物浓度;③耳蜗内植入探针进行实时监测[6]。但传统的方法存在着如下不足:第一类测定方法仅是半定量的研究,其次由于制作切片过程中固定剂(如石蜡)的置换作用无法获得尚存于淋巴液中的药物,观察到的只是进入内耳各细胞及细胞间隙中的药物分布信息,另外此方法所获得的仅是离体的断层信息;第二类方法则受淋巴液量微少、抽取过程极易受血液及脑脊液污染的影响,其结果的可靠性显著降低,另外尚有研究表明药物在耳蜗中存在着梯度分布现象[7],直接测定浓度将无法观察到梯度分布;第三类方法则是通过实时监测耳蜗植入探针内溢出的淋巴液来测定药物浓度,由于外淋巴液量微少、所取样本中的药物并非生理性的药物清除,因而此法并不能完全显示出外淋巴液药物动力学的规律[8]。受研究手段限制,至今尚无一种能同时满足活体、动态、实时、可重复、连续观察、非侵袭性的研究方法。
自2007年日本学者Nakashima[9]首次通过内耳核磁增强显影观察到梅尼埃病患者的内淋巴积水以来,至今全世界学者已行内耳增强显影数百上千例,虽未见相关副反应报道,但经鼓室给药作为一种新型给药途径(相比常规静脉注射)其在内耳的代谢特点尚未被研究。不仅仅是Gd-DTPA,由于技术手段的限制至今尚无一种药物的内耳代谢特性被完全了解,致使鼓室给药治疗内耳疾病受到了极大的限制。DTPA(二乙基三胺五乙酸)为高效螯合物,与Gd3+结合不仅降低了游离钆离子的毒性、增加了其水溶性,而且使其弛豫性更强。学者们利用DTPA的特性将其与药物或生物大分子结合,如脱氧葡萄糖[10]、单抗[11]、叶酸[12]等结合后再与钆离子螯合后来进行核磁的靶向性显影研究,市面上亦出现专门提供Gd-DTPA标记的试剂盒(BioPAL公司)。虽目前尚未见Gd-DTPA与内耳疾病治疗相关药物如庆大霉素、地塞米松等药物耦合的报道,但相信技术上应该不难实现。由此可见,使用Gd-DTPA标记药物分子同时具有进行药物代谢动力学研究的潜在价值。
总结本次实验存在的不足和需要进一步深入研究的内容如下:①因本实验为体外实验,仅单纯研究生理盐水配制的不同浓度的造影剂与图像增强信号间的关系,内耳外淋巴液环境中的各种离子、蛋白质,淋巴液周围组织(如蜗壳的骨质)是否会对体外试验所得线性关系产生影响需进一步探明;②Gd-DTPA浓度与灰度值之间转换存在着应用范围,即在浓度在0~1 mmol/L范围内时线性关系才存在,在内耳浓度积聚超过此浓度有无弥补的转换方法;③将Gd-DTPA标记于药物分子后,各种药物分子是否会对Gd-DTPA的弛豫缩短效应产生影响也需要进一步研究证明。
总之,利用核磁造影剂的示踪剂特性及核磁图像灰度与浓度之间良好的线性关系建立起来的内耳药物代谢动力学研究是继传统内耳药物代谢方法研究后的又一尝试,动物实验结果及其临床推广将会为鼓室给药途径治疗内耳疾病提供理论支撑及依据。
4 参考文献
1 Duan M, Bjelke B, Fridberger A, et al. Imaging of the guinea pig cochlea following round window gadolinium application[J]. Neuroreport, 2004, 15: 1 927.
2 Hargunani CA,Kempton JB,DeGagne JM,et al.Intratympanic injection of dexamet- hasone: time course of inner ear distribution and conversion to its active form[J]. Otol Neurotol,2006,27:564.
3 Roehm P, Hoffer M, Balaban C. Gentamicin uptake in the chinchilla inner ear[J]. Hearing Res,2007,230:43.
4 Yang J,WU H,Zhang P,et al. The pharmacokinecit profiles of dexamethasone and methylprednisolone concentration in perilymph and plasma following systemic and local administration[J]. Acta Oto-Laryngologica,2008,128:496.
5 Ozluoglu LN, Yilmaz I, Akkuzu B, et al. Buffered papaverine facilitates passage of intratympanic dexamethasone to the inner ear[J].Acta Oto-Laryngologica,2006, 126:1 260.
6 Salt AN, Kellner C, Hale S. Contamination of perilymph sampled from the basal cochlear turn with cerebrospinal fluid[J]. Hearing Res,2003,182:23.
7 Salt AN. Dexamethasone concentration gradients along scala tympani after applic- ation to the round window membrane[J]. Otol Neurotol,2008,29:401.
8 孙建军,冯红云.内耳疾病的局部给药研究[J].中国医学文摘耳鼻咽喉科学,2007,22:81.
9 Nakashima T, Naganawa S, Sugiura M, et al. Visualization of endolymphatic hydrops in patients with Meniere's disease[J]. Laryngoscope, 2007, 117: 415.
10 黄占文,张伟,陈跃.磁共振对比剂Gd-DTPA-DG的制备及动物实验研究[J].重庆医学,2010 39:2 866.
11 刘岘,许乙凯,叶靖.Gd-DTPA标记单克隆抗体对荷人肝癌裸鼠的MR成像研究[J].临床放射学杂志,2005,24:730.
12 万丹晶,钟高仁,朱建华,等。叶酸受体靶向磁共振对比剂157Gd-DTPA-Folate增强裸鼠肿瘤信号的初期评估[J].核技术,2006,29:605.
