回声定位蝙蝠耳蜗听黄斑区毛细胞形态研究
2011-01-23李胜利赵谦任田英张少强闫利英刘思伟王婉莹朱宏亮
李胜利 赵谦 任田英 张少强 闫利英 刘思伟 王婉莹 朱宏亮
全世界蝙蝠种类繁多,有1 100多个品种,占地球上哺乳动物的五分之一以上,大多数蝙蝠依靠回声定位进行导航和捕食,其最显著的特征是具有敏锐的听觉和纤细调谐分析多普勒频移回声(CF2)的功能。因此,其耳蜗明显出现了有别于非回声定位蝙蝠和哺乳类动物的特化现象,集中表现在耳蜗基底膜上和(中枢)下丘出现极度扩展从而得到极度表达的区域,被称之为“声黄斑” (acoustic fovea)[1~5],也有作者称之为“听黄斑”(auditory fovea)[6~8],Russell等[9]曾测定髯蝠称之为耳蜗斑(cochlear fovea)。普遍认为哺乳类动物的耳蜗外毛细胞(OHC)胞体运动和/或纤毛束运动在耳蜗放大器机制中起重要作用[10],而蝙蝠的OHC却不具备耳蜗放大器功能,恰好相反,它在最佳频率起限制和阻抗基底膜放大的作用。有关回声定位蝙蝠耳蜗的盖膜(tectorial membrance ,TM)和基底膜(basilar membrane, BM)及附着结构与听黄斑的生理关系已进行了较多研究[3,7,9,11~15],但对听黄斑区的毛细胞超微结构研究较少[4,16~19]。为探讨回声定位蝙蝠与哺乳动物耳蜗机制上差异的原因,本研究观察了蹄蝠、菊头蝠和犬吻蝠耳蜗毛细胞形态的超微结构,以了解回声定位蝙蝠听黄斑区的毛细胞形态特征,现报告如下。
1 材料与方法
1.1实验材料 从陕西柞水县溶洞捕捉百余只蝙蝠,品种经中国科学院动物研究所鉴定有三种:蹄蝠(Hipposiderid)、菊头蝠(Rhinolophus)和犬吻蝠(Molossidae)。用12只C57小鼠、20只豚鼠和6只棕色田鼠耳蜗作为对照。蝙蝠捕获时间及观察品种和数量见表1。

表1 不同时间观察的蝙蝠的种类、数量和性别
1.2听功能检测 三种蝙蝠各取10只分别测试ABR,实验动物麻醉后,置于屏蔽室内,颅顶为记录电极,参考电极在测试耳乳突部,接地电极接鼻尖。以镀有银化物的专用电极刺入约0.5 mm,保证针刺电极的极间电阻在1 kΩ左右(不超过3 kΩ),由RA4LI模块自带电阻检测显示。
蝙蝠在实验过程中被固定于屏蔽室内的记录台上,并保证受测耳与喇叭的位置固定距鼓膜2~3 cm。Tucker-Davis Technologies TDT System Ⅲ用于听觉刺激信号的发送和采集。
本仪器配置TDT RP2.1 实时信号处理器,刺激声为TDT软件自带的Black man短纯音修改的2 ms短纯音(tone burst),以每秒21.01次刺激率由Tucker-Davis Technologies TDT System Ⅲ的RX5模块产生,经RP2.1模块在PA5衰减后由TDT ED1 Electrosatatic Speaker Driver驱动静电场扬声器发声,频率范围2~100 kHz,分别为2、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60、64、68、72、76、80、84、88、92、96和100 kHz,由TDT PA5以 5 dB梯度强度从100 dB向0 dB自动衰减,前置放大增益100 k,RX5-2 数字滤波。带通滤波100~3 000 Hz,叠加500~1 000次,纯音刺激间期2 ms,上升和下降时间1 ms,以波Ⅰ、Ⅱ和Ⅴ的出现或消失(<1 μV)为标志波进行测试。信号的叠加在TDT硬件系统和BiosigRP帮助下进行。
1.3耳蜗电镜标本制作及观察方法 在检测听功能后,将处于麻醉状态的蝙蝠快速断头处死,取出双侧听泡,在手术显微镜下暴露出耳蜗,用细钢针挑破蜗顶和耳蜗底回圆窗及卵圆窗,快速灌入2.5%戌二醛PBS 液,4 ℃固定4 h ,1.0%锇酸固定2 h,PBS 洗涤后在手术显微镜下去除耳蜗骨壳、盖膜及部分血管纹组织,充分暴露出Corti器上的基底膜内外毛细胞。梯度乙醇脱水,临界点干燥,喷金,定位后扫描电镜(SEM)标本在VegaC Tescan(捷克,SEM MAG: 49X)和高分辨SEM-3010(日立)上观察;透射电镜样品用EPON618平板包埋,LDB5型超薄切片机切片,醋酸铀及硝酸铅复染,日立680型电镜观察。
观察方法:按照Kössl和Vater观察髯蝠的方法[15,17],从耳蜗基底到顶端的距离,将耳蜗分为SI区(sparsely innervated,SI)和CF2区(second harmonic constant-frequency component of the echolocation call,CF2)及沟回区(Hook),将基底膜分成基底、顶回和斑区(foveal)片段,进行光镜和电镜观察。观察耳蜗听黄斑的位置,即从耳蜗基底端向顶端的20%~45%为观察SI区位置,由46%~75%为观察CF2区的位置,整个SI区和CF2区均为听黄斑区(图1),其它部位观察用于对照。
1.4统计学方法 使用GraphPad.Prism5统计软件,应用Newman-Keuls Multiple Comparison Test对数据进行单因素方差分析和t检验,比较数据的可信区间。
2 结果
2.1三种正常回声定位蝙蝠ABR测试结果 在2~12 kHz,三种回声定位蝙蝠的ABR反应阈均较高,在35 dB SPL以上;犬吻蝠的ABR反应最敏感,其波幅最大及调谐最敏锐频率在20~28 kHz范围,其反应阈在10 dB SPL左右;菊头蝠的ABR反应最敏感和波幅最大及调谐最敏锐频率在83~86 kHz范围内;蹄蝠的ABR反应最敏感和波幅最大及调谐最敏锐频率在60~62 kHz范围内;由图2可以看到三种蝙蝠的听黄斑最敏锐调谐频率位置和ABR反应阈及频率位置。
2.2扫描电镜观察耳蜗听黄斑区毛细胞形态
2.2.1中蹄蝠耳蜗听黄斑区毛细胞形态观察 三种回声定位蝙蝠的耳蜗相比,蹄蝠的耳蜗最大,其次是菊头蝠,犬吻蝠耳蜗最小,但耳蜗均呈2.5回的螺旋状。蹄蝠耳蜗沟回即最基底部的外毛细胞(OHC)排列成三排,第二排和第三排间距较近,排列紧密,第一排与第二排间距相对较宽。三排OHC听黄斑的最敏锐调谐频率分别为菊头蝠83~86 kHz;蹄蝠60~62 kHz;犬吻蝠20~28 kHz的静纤毛束呈“V”字型,开角较大,纤毛很短约0.8 μm。内毛细胞(IHC)表皮板大而相互分离,静纤毛根数少而纤毛较长(图3)。第一排OHC和IHC间距较大(图3a),SI区的三排OHC排列与沟回相似,静纤毛依然很短;而IHC的表皮板更相互分离而独立,但纤毛根数增加,长度减少,排列较直。第一排OHC和IHC间距较小(图3b)。CF2区的三排OHC间距缩小,排列紧密,静纤毛束“V”字型开角变小,静纤毛仍然很短;IHC的静纤毛明显增多,长度较OHC的要长,排列成眉形(图3c)。耳蜗顶回的三排OHC排列松散,静纤毛较长,“V”字型开角较小;IHC的表皮板相互连接,静纤毛长而根数最多,紧密排列成排(图3d)。扫描电镜观察中蹄蝠耳蜗毛细胞体(图4),可见顶回的OHC短小而呈球形或短柱状(图4a);SI区的OHC细胞体呈细颈瓶状,特点是细胞核上部窄细,细胞核部膨大,外被邓特氏细胞杯包裹,核下部缩小,整体呈纺锤状,而并非哺乳动物的长柱状形态(图4b);CF2区OHC亦呈现和SI区相似的形状(图4c),但不如SI区的显著,基底沟回的OHC细胞体更小,呈短球状(图4d)。

图1 蝙蝠耳蜗电镜观察示意图[15,17]
扫描电镜下观察的蝙蝠耳蜗SI、CF2和沟回部位(a);蝙蝠耳蜗镜下基底膜各部位的观察示意图(b);蝙蝠耳蜗各部位到基底的距离和范围示意图(c)

图2 三种回声定位蝙蝠ABR反应阈各频率分布图
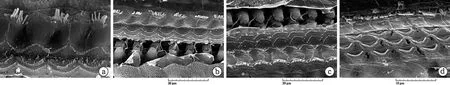
图3 中蹄蝠耳蜗扫描电镜观察
耳蜗沟回、SI区、CF2区和顶回的OHC和IHC的超微结构形态。第一排OHC和IHC间距较大,OHC表皮板呈细长的月牙状(a);SI区的第一排OHC和IHC间距较缩小(b)。CF2区的三排OHC间距和IHC的静纤毛明显增多(c)。耳蜗顶回的三排OHC排列(d)
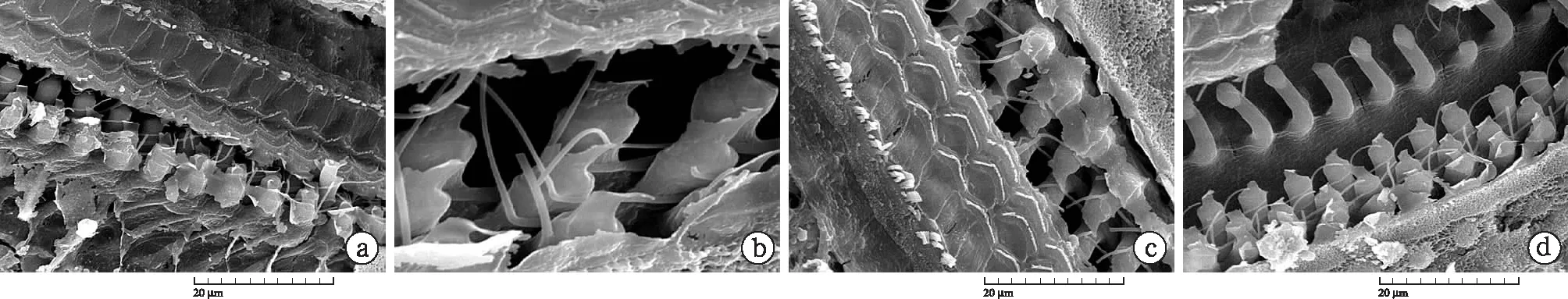
图4 扫描电镜观察中蹄蝠耳蜗毛细胞胞体
可见顶回的OHC短小而呈球形或短柱状(a);SI区的OHC细胞体呈细颈瓶状,特点是细胞核上部窄细,细胞核部膨大,外被邓特氏细胞杯包裹,核下部缩小,整体呈纺锤状,而并非哺乳动物的长柱状形态(b);CF2区OHC亦呈现和SI区相似的形状(c),但不如SI区的显著。基底沟回的OHC细胞体更小,呈短球状(d)
2.2.2大蹄蝠耳蜗听黄斑区毛细胞特征 本研究观察的所有蝙蝠中,大蹄蝠的体型最大,耳蜗亦最大。耳蜗听黄斑的SI区和CF2区的OHC呈最典型的纺锤状(图5a、b),尤其是CF2区的OHC细胞体的纺锤状更显著,IHC的静纤毛较长(图5c)。
大蹄蝠CF2区的内外毛细胞高分辨扫描电镜下超微结构可见CF2区的三排OHC和一排IHC(图6),IHC的静纤毛较OHC的明显长(图6a),IHC的静纤毛排列成两排,纤毛长而根部非常细,而上部较粗,顶端更粗,外排纤毛有数根断掉(图6b);OHC表皮板呈细长的“V”型,三排OHC静纤毛长度相仿,纤毛短而排列成十分整齐的三行,由内向外梯度升高,三行静纤毛相互密切靠拢,由其顶连接和侧连接相互连接在一起(图6c、d)。
2.2.3菊头蝠耳蜗听黄斑区毛细胞形态观察 与蹄蝠耳蜗相比,菊头蝠耳蜗较小。耳蜗SI区的毛细胞呈典型的纺锤状;而CF2区和基底沟回基本呈短球状或短柱状(图7)。

图5 大蹄蝠耳蜗听黄斑的SI区和CF2区的OHC
呈最典型的纺锤状,OHC2~3排的指状突尤其长(a、b),尤其是CF2区的OHC细胞体的纺锤状更显著,IHC的静纤毛较长(c)

图6 大蹄蝠耳蜗CF2区观察高分辨扫描电镜
IHC的静纤毛较OHC的明显长(a),IHC的静纤毛排列成两排,纤毛长而根部非常细,而上部较粗,顶端更粗,外排纤毛有数根断掉(b);OHC表皮板呈细长的"V"型,三排OHC静纤毛长度相仿,纤毛短而排列成十分整齐的三行,由内向外梯度升高,三行静纤毛相互密切靠拢,由其顶连接和侧连接相互连接在一起(c、d)

图7 菊头蝠耳蜗各区毛细胞形态
SI区的OHC细胞体呈典型的纺锤状;而CF2区亦呈短球状、短柱状。顶部OHC细胞体呈长柱状。基底部OHC排列紧密,细胞体呈短柱体(a);耳蜗黄斑区OHC细胞体呈典型的纺锤型,静纤毛较短(b、e);第二谐振区OHC细胞体呈短柱状(c、f);耳蜗顶部OHC呈长柱状(d)
2.2.4犬吻蝠、小鼠和豚鼠耳蜗各区毛细胞形态 与蹄蝠和菊头蝠耳蜗相比,犬吻蝠的耳蜗更小。犬吻蝠和豚鼠耳蜗扫描电镜图见图8。犬吻蝠耳蜗顶部OHC的电镜图见图9。
回声定位蝙蝠犬吻蝠耳蜗SI区与C57小鼠耳蜗相对应的部位对比观察,可见回声定位蝙蝠的SI区OHC胞体均呈纺锤状(图10a~c),而C57小鼠耳蜗相对应部位的OHC均呈长柱状或试管状(图10d~f)。OHC形态表现出回声定位蝙蝠与哺乳动物的明显差异。
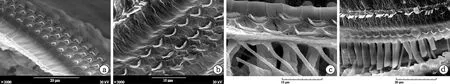
图8 犬吻蝠、豚鼠的耳蜗扫描电镜图
可见在与蝙蝠听黄斑相对应位置的OHC结构呈现出典型的哺乳类动物形态,OHC排列分散,三排OHC间距相近,静纤毛较长(a、b犬吻蝠);细胞体形态亦呈典型哺乳动物的长柱状,三排OHC指状突平行(c、d豚鼠)

图9 犬吻蝠顶部OHC电镜图
静纤毛较长,表皮板呈肾型(a),SI区静纤毛较前稍短,表皮板呈肾型(b),CF2区OHC静纤毛短(c),以上区域三排OHC的排列较分散;而基底部静纤毛最短,三排OHC排列紧密,OHC细胞体呈短柱状,表皮板呈细长“V”型(d)

图10 回声定位蝙蝠耳蜗SI区与C57小鼠耳蜗相对应的部位对比观察
可见回声定位蝙蝠的SI区OHC胞体均呈纺锤状(a~c);而C57小鼠耳蜗相对应的部位的OHC均呈长柱状或试管状,第三排OHC的指状突明显与网状板连接(d~f)。
2.3透射电镜观察耳蜗听黄斑区毛细胞形态 透射电镜下可见三种蝙蝠的耳蜗外毛细胞体均不呈现大多数哺乳类动物耳蜗外毛细胞的圆柱状,并且细胞体较短,OHC的细胞核在细胞中显得尤其大。犬吻蝠外毛细胞呈典型的烧瓶状,蹄蝠和菊头蝠外毛细胞呈哑铃状,即毛细胞核部与胞体中上部膨大,而毛细胞上端变细(图11)。内毛细胞均呈倒烧瓶状,内外毛细胞体内细胞器均存在,但数量不多。外毛细胞底部与Deiters细胞相连,但未见到Deiters细胞杯状包裹外毛细胞底部的现象。豚鼠和棕色田鼠耳蜗外毛细胞基本呈圆柱体样形态。
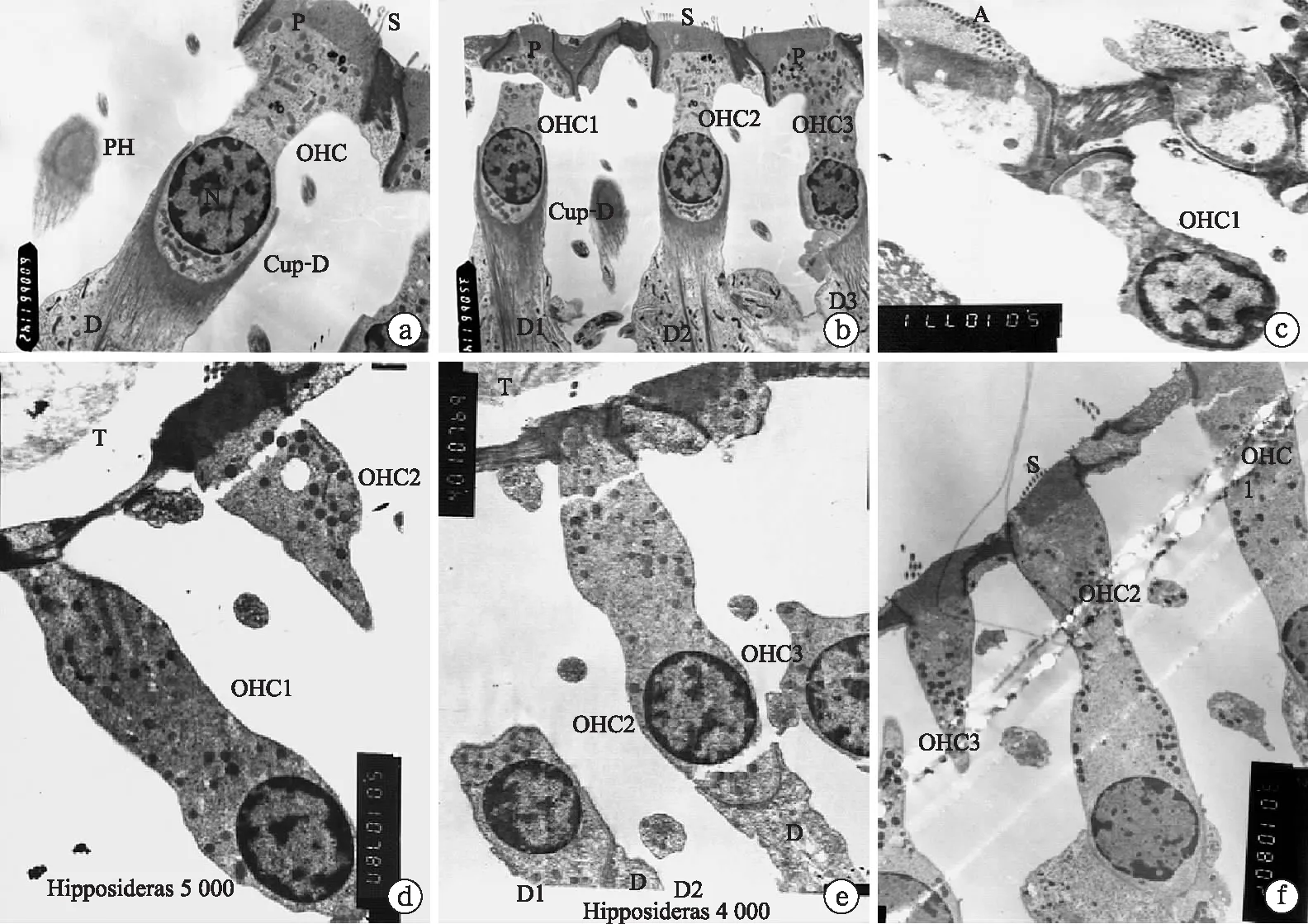
图11 透射电镜观察蝙蝠耳蜗外毛细胞的形态结构
蹄蝠的耳蜗底回外毛细胞(OHC)呈灯盏形,支持细胞(Deiter)、静纤毛(Steria bundle)、支持细胞(Deiter) 形成的包裹外毛细胞杯状连接(Cup-Deiter)(a);蹄蝠的耳蜗底回三排外毛细胞(OHC)呈灯盏形,支持细胞(Deiter)、静纤毛(Steria bundle)、支持细胞(Deiter) 形成的包裹外毛细胞杯状连接(Cup-Deiter)(b);犬吻蝠耳蜗底部的OHC呈短烧瓶状(c);菊头蝠的OHC呈纺锤状(d);长翼蝠OHC呈纺锤状(e);犬吻蝠耳蜗底部的OHC呈长烧瓶状(f)
3 讨论
回声定位蝙蝠经过长期的进化,为了敏锐感觉和调谐分析其叫声回声频率的多普勒频移(CF2),耳蜗明显出现了有别于非回声定位蝙蝠和哺乳类动物的特化现象,在蝙蝠耳蜗基底膜上代表区极度扩展从而得到极度表达的区域称为"声黄斑"[1]。根据大多数研究者的命名和该区域主要感觉回声的生理特点[1,5,10,19~22],以及与视力的“视黄斑”相对应。本文将回声定位蝙蝠的回声过度表达区称之为“听黄斑”,国内学者有的称之为“听觉凹”[22,40]。目前研究证明菊头蝠的听黄斑最敏感的调谐频率是83.0~84.5 kHz[7~9,23],蹄蝠是60~62 kHz[24],而犬吻蝠的听黄斑频率最低是21~27 kHz[4]。本研究三种蝙蝠的听黄斑反应频率范围与上述研究结果基本相同,频率范围稍有扩大,可能与采用的ABR测试方法不同有关。
3.1回声定位蝙蝠听黄斑的形态特征 Bruns[11]定量研究蹄蝠属的马铁菊头蝠(Rhinolophus ferrumequinum)耳蜗形态学特化(morphological specialization)与外周听觉系统的特殊敏锐调频的相关性, 证明该种蝙蝠的耳蜗基底膜平均长度为16.1 mm,明显比其它体型大小相当的哺乳类动物长,甚至超过其它发射调频声(frequency modulated, FM)定位的蝙蝠;沿耳蜗管有两个显著的突变中断结构,对耳蜗的特化功能具有重要意义:第一个最显著中断出现在距基底膜最底端4.3~4.6 mm处,该处基底膜厚度由35 μm突降到10 μm,在稍低处出现急转直下的坡度区(4.5~4.6 mm),该区的基底膜宽度最窄;第二个中断出现在基底膜7.8 mm处,此处的基底膜宽度对应于骨螺旋板外侧的变化;这些耳蜗特化结构的作用与频率分析的机制相互对应。Bruns[23]分析马铁菊头蝠的耳蜗结构,正常外毛细胞核基底部直径2.85 μm ,顶部3.2 μm,静息频率(resting frequency, FR)在82.6~83.3 kHz,回声出现在83.0~86.0 kHz,在基底膜的4.5 mm处。本研究主要观察Bruns等研究[10,23]相同位置的基底膜,该处是听黄斑的主要部位。
Bruns等[3]研究大蹄蝠(greater horseshoe bat)耳蜗发现其适应不同听觉功能的三个区域:①从基底膜1.3~5.4 mm的恒频(constant frequency)定向片段(围绕 83 kHz) 的分析区,该区域的神经结构相似于其他哺乳类动物;②5.4~8 mm区域,频率从40~80 kHz涵盖了方向信号的调制部分;③从8 mm处到顶部(16 mm) 是频率低于40 kHz区域。另外,耳蜗任何部分的外毛细胞上均无传出纤维。同年Bruns[25]报道用扫描电镜观察马铁菊头蝠(Rhinolophus ferrumeguinun)的耳蜗内外毛细胞和盖膜(tectorial membrance,TM)结构,该种蝙蝠听觉系统的敏锐调频在83 kHz 的小频率带,是该动物的恒频回声定位信号区;基底膜0~4.5 mm区是围绕83 kHz 的频率响应部位,具有以下特征:①与其他哺乳类动物相比,OHC的静纤毛较短;②第一排OHC的Z字形连续出现在TM相关的位置上;③第一排OHC与其他两排间具有宽大的分离带;④IHC静纤毛两倍长于其他哺乳类动物及菊头蝠的其他耳蜗部位;⑤IHC受体表面小且有宽大的分离带;⑥没有发现TM与IHC的接触结构。这些特征说明它适应于提升高频的敏感性或适应特殊的纤细频率分析。本研究在菊头蝠耳蜗SI和CF2区观察到OHC同样具有上述现象,且从ABR反应幅度和阈值看,其敏锐高调频在83~86 kHz。
Vater等[16]观察到髯蝙蝠耳蜗外毛细胞特别短,基底回长12~15 μm ,顶回长28~30 μm ;Deiter细胞的指突尤其长,其细胞膜包裹外毛细胞底部成杯状,他认为外毛细胞亦呈现典型的哺乳类动物耳蜗形状,并含有电子致密物质和微管。明显的特化表现在蹄蝠耳蜗底回下部的内毛细胞,主要是静纤毛有两排纤毛,每排仅有7~8根纤毛,OHC纤毛高度仅为0.8 μm,表皮板小而相互分离[26],但没有观察OHC胞体的形态差异。Vater等[4]对巴西犬吻蝠(Tadarida brasiliensis) 的耳蜗进行扫描电镜观察,结果显示形态特征与非特化的高频过程相关,如:①基底膜呈辐射状,而基底膜增厚片段与盖膜变薄相对等呈齿形匹配;②三排外毛细胞形态相似。从基底膜35%~86%处, 频率在12~30 kHz,该区域界定为声黄斑(acoustic fovea),它包括最大敏感频率和敏锐调频 (21~27 kHz) 的分布,但其频率低于声纳信号。声黄斑具有下列几个形态学特征:①主要由透明物质(hyaline substance)构成的基底膜呈连续辐射状增厚;②螺旋韧带(spiral ligament)增加张力纤维层数目;③三排OHC的静纤毛排列具有形态差异。在OHC主动运动表达差异上,没有任何超微结构证明OHC细胞体的组织结构在听黄斑区与其它耳蜗区之间存在定性差异,而仅在OHC的表皮板和静纤毛束的排列上出现特化。而本研究发现听黄斑区的OHC细胞体与其他区域差异甚大,听黄斑区的OHC细胞体呈球形或烧瓶状、纺锤形,并不是其他区域的圆柱型,犬吻蝠的最大敏感频率和敏锐调频亦在21~27 kHz范围。
Reuter等[27]测定昭短尾叶鼻蝠(Carollia perspicillata)的OHC电能动性(electromotility),发现耳蜗顶部的OHC呈典型的哺乳类动物形状,而基底部的OHC却相当短,呈球形(baii-shaped),OHC最显著的位移在细胞核和表皮板水平上,由低于100 Hz的刺激频率引出的最大位移约0.3~0.8 μm,与其相同的是本研究现SI和CF2区的部分OHC呈球形。OHC的形状增加细胞膨压是由于细胞外液低渗[27],蹄蝠的OHC呈柱状[15,16], 因此,可推测毛细胞第一个动力是耳蜗回影响浴渗透压。在蝙蝠中,有多个结构调整两种毛细胞和支持细胞,可能是其对高频刺激有效放大至关重要的。鲁氏菊头蝠(Rhinolophus rouxi)非常短的OHC纤毛排显示夸张的倾斜角相互倾向可能导致刚度增加[15]; 有研究发现在高频率增加整个Corti器劲度有利于机械相互作用[16]。本研究可见SI和CF2区的OHC纤毛非常短,并且相互紧密靠拢和连接,亦支持其增加其静纤毛束刚性的观点。Kössl等[18]研究氨基糖苷类损害髯蝠耳蜗毛细胞后DPOAE变化,用扫描电镜观察SI区和CF2区的毛细胞,在编码第二谐波恒频回声定位叫声组分(second harmonic constant-frequency component of the echolocation call,CF2)和75~100 kHz间的耳蜗区损害最大,DPOAE幅值升高。这与目前普遍认为的耳毒性损害OHC造成DPOAE幅值下降相矛盾[24]。本研究参照他们的方法对蝙蝠听黄斑区的毛细胞进行观察,正常蝙蝠的结果基本与其观察的毛细胞结构一致,但他们没有对OHC细胞体进行观察,本研究对OHC的形态观察填补了上述研究的空白。结合以前的文献报道和本研究观察结果,基本可以认为:①回声定位蝙蝠耳蜗听黄斑区OHC呈烧瓶状、纺锤状和哑铃状或球状;②听黄斑区的OHC被Diters氏细胞形成的细胞杯包裹,不利于OHC的主动运动;③听黄斑区的OHC纤毛特别短,且具有很强的刚性,不利于纤毛束的主动摆动和振动。蝙蝠这三点OHC的特化形态证明它的听觉机制不同于其他哺乳动物。
3.2回声定位蝙蝠听黄斑区毛细胞特化对耳蜗听觉机制的影响 目前普遍认为哺乳类动物耳蜗OHC细胞体呈长柱状,以前对回声定位蝙蝠的研究观察也证明蹄蝠、髯蝠及犬吻蝠的OHC细胞体为圆柱状[15,16],也有报告蹄蝠、菊头蝠和犬吻蝠耳蜗OHC呈烧瓶状、纺锤状和和哑铃状,明显有别于其他哺乳类动物[18]。仅Reuter[27]观察到昭短尾叶鼻蝠耳蜗顶部的OHC呈典型的哺乳类形状,而基底部的OHC却相当短,呈球形(baii-shaped)。我们认为决定毛细胞体形态的关键是表皮板的形状,因为表皮板是毛细胞的顶表面形态特征。普遍认为哺乳动物的外毛细胞表皮板基本是圆形,所以OHC细胞体的横截面与其表皮板统一呈圆形,沿其纵轴到圆形细胞核的底部,OHC细胞体呈圆柱状;而回声定位蝙蝠的OHC表皮板呈细长的"V"字形,沿其纵轴向下"V"字形逐渐变化为包裹细胞核圆形呈现为球形。所以,由于观察回声定位蝙蝠耳蜗OHC的方向和角度不同,而出现不同的细胞体形态。从本研究看垂直于OHC表皮板观察,其细胞体呈球形(图5a、b;图7b);而平行于OHC表皮板,沿基底膜的放射方向观察,OHC细胞体呈现两头大、中间小的哑铃状形态(图4b、c和d;图11a和b;图12),在某种情况可以呈圆柱状(图7c和f);如果平行于OHC表皮板,沿基底膜的纵向方向观察,OHC的细胞体形态呈头小而向细胞核变膨隆的烧瓶状(图11c、图12)。总之,回声定位蝙蝠耳蜗OHC的细胞核均呈圆形,因表皮板的特化形态向细胞核的纵向变化而呈现不同的形状(图12),与哺乳动物的圆形表皮板形成的圆柱状细胞体呈鲜明对照。
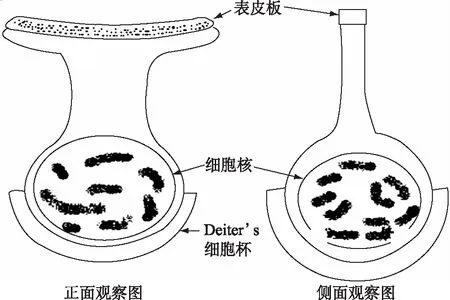
图12 回声定位蝙蝠听黄斑区外毛细胞不同方向观察形态模式图
Wada等[26]观察豚鼠耳蜗OHC发现马达蛋白(protein motor)在细胞顶部和基底部无分布,而在细胞中部细胞侧膜均匀分布,OHC的运动主要在细胞中部。Dallos等(1991)[28]观察到OHC具有统一直径的细长圆柱形,电刺激产生的OHC运动在细胞纵向范围,但不涉及表皮板和细胞核及突触区。Zheng等[29]亦认为OHC是具有恒定直径、长度不同的圆柱体,在豚鼠同样观察到OHC细胞体呈长圆柱形[30~33],在回声定位蝙蝠也观察到OHC细胞体是圆柱形[4,15],可能与他们观察角度不同有关。回声定位蝙蝠OHC的这种形态特化,对其主动运动机制不利,而对降低基底膜的劲度有利。根据OHC细胞体与Deiters细胞体的密切结合,以及尤其长的Deiters指状突与网状板的结合这两个特点,推测OHC可顺应TM的谐振,从而促进基底膜共振行波的前行传导,此点尚需以后的研究证实。
蝙蝠这种在CF2频率范围内非常狭窄的频率调谐的共同特点是:①耳蜗外毛细胞在SI区没有像一般理论认为的通过OHC的电能动性完成耳蜗的放大作用。所有对蝙蝠的研究均未证明OHC对SI区和CF2频率共振器发挥主要作用;研究证明蝙蝠的OHC起阻尼作用,可改变基底膜的阻抗状态;②与传统的耳蜗听觉机制认为的行波逆向传播造成耳声发射相反,蝙蝠的SI区的TM和BM共振器与OHC结合,泵发功能进入邻近的CF2区,发生了标准波的正向传播,导致耳声发射延迟,并且SI区TM和BM共振器导致耳蜗前庭阶和鼓阶液体压力改变。Ren等[34]用扫描激光干涉仪检测沙土鼠声反射频率BM振动的纵向形式,发现耳蜗基底有一个向前的行波(forward traveling wave),但未发现反向的逆向行波(backward-traveling wave)出现在声反射频率。这些结果与目前流行理论相矛盾,证明耳声发射是通过耳蜗液体的压缩波,而不是沿BM传导的反向行波[35],并且DP产生位点有一个从基底侧移向顶侧的放大位置[36], 通过对耳蜗OAE延迟的测量分析,显示耳蜗内总的声反射延迟相等或略小于向前的延迟(forward delay),说明是耳蜗液体压力改变导致的压缩波[37]。耳声发射与基底膜振动的相位关系显示DPOAE从其在耳蜗内产生部位到外耳道的传导方式与传统的逆向行波不完全相同,DPOAE前行波在耳蜗内分布的范围比按照理论计算的大得多。 通过测量和比较BM在两个点振动的相位角发现,在耳声发射频率上的BM行波向前而不是逆向传播[34]。实验证明耳声发射是反向传导的耳蜗液体压缩波(compression waves)[38]。按照任田英[39]及上述研究[34,37,38],如果耳声发射经耳蜗液体压缩波逆向传出,那么该机制在声音在耳蜗前行传导中的作用是什么?运用蝙蝠听觉斑的频率分析现象,可以回答该问题,像蝙蝠耳蜗中前行波是为了对最佳频率的极大扩展和对多普勒频移回声(Doppler-shifted echoes)的过度表达一样,人类或非回声定位的哺乳动物可能亦存在对最佳频率临近的低频率选择扩展和过度表达需要,而且,最新的研究表明听觉凹的范围与蝙蝠多普勒频移补偿效应相关,即CF蝙蝠可能存在两大类抑制和兴奋型神经元通过拮抗性作用调节多普勒补偿效应[40]。对这些听力学基本问题的重要推论,尚待大量的实验证据支持和证明。现有的耳蜗行波理论无法解释的实验结果,加上对特化耳蜗听觉生理的研究,必将促进听觉新理论的产生和发展,将对耳蜗机制和临床听力疾病的诊断和治疗具有重要的意义和广阔的应用前景。
(本研究在我校环境与疾病相关基因教育部重点实验室完成。电镜观察得到213研究所安老师和张芳同志的支持,高分辨扫描电镜得到西安理工大学张老师的支持。美国任田英教授阅读本文并提出修改意见。在此,一并表示感谢!)
4 参考文献
1 Ulanovsky N, Moss CF. What the bat's voice tells the bat's brain[J].PNAS, 2008,105:8 491.
2 Suga N, Simnons JA, Jen PHS. Peripheral specialization for fine analysism of Doppler-shifted echoes in the auditory system of the 'CF-FM' bat Pteronotus parnellii[J]. J Exp Biol, 1975,63:161.
3 Bruns V, Schmieszek E.Cochlear innervation in the greater horseshoe bat: Demonstration of an acoustic fovea[J]. Hear Res,1980,3:27.
4 Vater M, Siefer W.The cochlea of Tadarida brasiliensis: Specialized functional organization in a generalized bat[J].Hear Res,1995,91:178.
5 Neuweiler G. Evolutionary aspects of bat echolocation[J]. J Comp Physiol A, 2003,189:245.
6 Rübsamen R, Schäfer M. Audiovocal interactions during development? Vocalisation in deafened young horseshoe bats vs. audition in vocalisation-impaired bats[J]. J Comp Physiol A,1990,167:771.
7 Russell IJ,Kössl M. Micromechanical responses to tones in the auditory fovea of the greater mustached bat's cochlea[J]. J Neurophysiol, 1999,82:676.
8 Metzner W, Zhang SY, Somotherman M. Doppler-shift compensation behavior in horseshoe bat revisited: Auditory feedback controls both a decrease and an increase in call frequency[J]. The Journal of Experimental Biology,2002,205:1 607.
9 Russell IJ, Drexl M, Foeller E,et al. Synchronization of a nonlinear oscillator: Processing the of component of the echo-response signal in the cochlea of the mustached bat[J]. J Neurosci,2003,23:9 508.
10 Kim SY, Allen R, Rowan D. The simulation of bat-oriented auditory processing using the experimental data of echolocating signals[J]. Acoustic,2008:5235.
11 Bruns V. Peripheral auditory tuning for fine frequency analysis by the CF-FM bat,rhinolophus ferrumequinum Ⅰ.Mechanical specializations of the cochlea[J]. J Comp PhysioI,1976,106:77.
12 Vater M,Kössl M.Further studies on the mechanics of the cochlear partition in the mustached bat Ⅰ.Ultrastructural observations on the tectorial membrane and its attachments[J].Hearing Research,1996,94:63.
13 Kösll M.A tectorial membrane fovea in the cochlea of the mustached bat[J]. Naturwissenschaften,1996a,83:89.
14 Kössl M,Vater M. Further studies on the mechanics of the cochlear partition in the mustached bat Ⅱ.Asecond cochlear frequency map deriver from acoustic distortion praducts[J].Hearing Research,1996,94:78.
15 Kössl M. Sound emission from cochlear filters and foveae- does the auditory sense organ make sense[J]. Naturwissenschaften,1997,84:9.
16 Vater M, Lenoir M,Pujol R.Ultrastructure of the horseshoe bat's organ of Corti,Ⅱ.Transmission electron microscopy[J]. J Comp Neurol,1992,318:380.
17 Vater M, Lenoir M. Ultrastructure of the horseshoe bat's organ of Corti,Ⅰ.Scanning electron microcopy[J].J Comp Neurol,1992,318:367.
18 Kössl M, Vater M. Consequences of outer hair cell damage for otoacoustic emissions and audio-vocal feedback in the mustached bat[J].JARO, 2000,1:300.
19 闫利英,李胜利,李白芽,等.蝙蝠耳蜗Corti器的电子显微镜观察[J].中华耳科学杂志,2007,5:202.
20 赵谦,李胜利 ,闫利英,等.蹄蝠听性脑干诱发电位特点分析[J].中华耳科学杂志,2009,7:60.
21 王婉莹,邰发道. 中国蝙蝠听觉和回声定位研究进展[J].陕西师范大学学报(自然科学版),2006,34:121.
22 罗峰,李安安,吴飞健,等.菲菊头蝠的下丘神经元基本声发声特性[J].动物学报,2006,27:202.
23 Bruns V. Peripheral auditory tuning for fine frequency analysis by the F-FM bat, rhinolophus ferrumequinum.II. Frequency mapping in the cochlea[J]. J Comp Physio I,1976,106:87.
24 Cover E. Neurobiological specializations in echolocating bats[J]. Anat Res,2005,287A:1 103.
25 Bruns V, Goldbach M. Hair cells and tectorial membrance in the cochlea of the greater Horseshoe bat[J].Anat. Embryol,1980,161:51.
26 Wada H, Usukwa H, Takerchi S. Distribution of protein motors along the lateral wall of the outer hair cell[J]. Hearing Research,2001,162:10.
27 Reuter G,Kössl M, Hemmert SW,et al.Electromotility of outer hair cells from the cochlea of the echolocating bat,carollia perspicillata[J].J Comp Physiol A , 1994, 175:449.
28 Dallos P, Evans BN, Hallworth R. Nature of the motor element in electrokinetic shape changes of cochlear outer hair cells[J]. Nature, 1991,350:155.
29 Zheng J, Shen WX, David Z,et al. Prestin is the motor protein of cochlear outer hair cells[J]. Nature,2000,405:149.
30 Chertoff ME,Brownell WE. Characterization of cochlear outer hair cell turgor[J]. Am J Physiol Cell Physiol,1994,266:C467.
31 Nakagawa T, Oghalai JS, Saggau P. Photometric recording of transmembrane potential in outer hair cells[J]. Journal of Neural Engineering, 2006,3:79.
32 Frolenkov GI. Regulation of electromotility in the cochlear outer hair cell[J]. J Physiol, 2006,576:43.
33 Zhiwei Li, Anvari B, Takashima M,et al. Membrane tether formation from outer hair cells with optical tweezcrs[J]. Biophysical Journal, 2002,82:1 386.
34 Ren TY. Reverse propagation of sound in the gerbil cochlea[J]. Nature Neuroscience, 2004,7:333.
35 He WX, Ren TY. Backward propagation of otoacoustic emissions[J]. Journal of Otology, 2006,1:40.
36 He WX, Fridberger A, Porsov E,et al. Reverse wave propagation in the cochlea[J]. PNAS, 2008,105:2 729.
37 Ren TY, He WX, Scott M,et al. Group delay of acoustic emissions in the ear[J]. J Neurophysiol, 2006, 96:2 785.
38 Ren TY, Nuttal AL. Cochlear compression: An implication of the Allen-Fahey experiment(L)[J]. J Acoust Soc AM, 2006,119:1 940.
39 任田英.声波在耳蜗内的逆行传导机制[J].西安交通大学学报(医学版),2009,30:261.
40 王绪中,胡开良,韦力,等.大蹄蝠多普勒正负补偿效应的声波特征与比较[J].动物学研究,2010,31:663.
