Bt的活化时间对发酵周期的影响
2010-12-26杨开杰
杨开杰
(邢台广播电视大学理工系,河北邢台 054000)
Bt的活化时间对发酵周期的影响
杨开杰
(邢台广播电视大学理工系,河北邢台 054000)
通过对苏云金芽孢杆菌生长曲线的研究,将处于不同生长阶段的菌体分别作为菌种,进行发酵实验,对610 nm和278 nm波长处的吸光度变化曲线、溶氧变化曲线和p H值变化曲线进行比较,得出了菌种最佳的活化时间为8 h,把处于对数生长期的菌体作为“种子”,与未活化的菌种发酵相比,可以使发酵周期由32 h缩短为28 h。
苏云金芽孢杆菌;发酵周期;活化时间
苏云金芽孢杆菌(Bt)作为生物农药中的一种,以其独特的优势成为目前产量最大、应用最广的微生物杀虫剂[1],占到生物农药的80%左右。目前,苏云金芽孢杆菌的菌种选育、基因工程等上游技术逐渐走向成熟。而要满足市场的大量需求,发酵生产是关键。
近年来,人们通过改变培养方式、发酵方法和设计新的反应器类型等方法来达到工业生产中高效发酵的目的[2],却往往忽略了通过缩短发酵周期来提高发酵效率的方法。菌体的发酵周期除受培养基成分、发酵条件等影响外[3],菌种的活化时间也是影响发酵周期的关键因素。笔者系统研究了Bt菌种活化时间对发酵周期的影响,确定了最佳活化时间。
1 材料和方法
1.1 供试菌种
Bacillus thuringiensis HD-1。
1.2 仪器和设备
数显光照培养箱,高压灭菌锅,SW-CJ-FD型净化工作台,光照恒温振荡培养箱,GBCS-8C型发酵罐,752C紫外-可见分光光度计。
1.3 培养基
1.3.1 LB固体培养基
胰蛋白胨:10 g/L,北京双旋微生物培养基制品厂提供;酵母膏:5 g/L,北京双旋微生物培养基制品厂提供;NaCl:10 g/L,北京益利化学品公司提供;琼脂:15 g/L,北京化学试剂公司提供;p H值为7.2~7.3。
1.3.2 自制培养基
玉米粉:15 g/L;豆饼粉:15 g/L;花生饼粉:12 g/L,购于市场;鱼粉:5 g/L,北京饲料公司提供;淀粉:10 g/L,北京市恒利公司提供;K2HPO4:5 g/L,北京红星化工厂提供;CaCO3:7 g/L,北京化学试剂公司提供;p H值为7.2~7.4。
1.4 菌种制备
采用LB固体培养基配方发酵 HD-1菌株,接种后36 h,向固体培养基上加入一定体积的无菌水,用手振荡锥形瓶或用接种环轻轻刮拭琼脂表面以洗落固体培养基表面的菌体,将菌悬液收集到一锥形瓶中,配置成菌悬液,冷冻保藏,备用。
1.5 菌体生长曲线确定
250 m L摇瓶,培养基装量50 m L,共15瓶,灭菌后用其中14瓶接种,另外一瓶为空白。培养条件:30℃恒温光照培养,240 r/min摇床上振荡培养,每隔1 h在610 nm处测定吸光度,得到菌体生长曲线。
1.6 发酵罐试验
分别将等体积的LB固体培养基培养的菌悬液、等体积菌悬液接种自制培养基培养8 h和培养13 h的菌体,接种于发酵罐中发酵,每隔2 h取样,分别在278 nm和610 nm处测发酵液吸光度,比较发酵效果。
1.7 参数测定方法
1.7.1 吸光度变化曲线测定
利用发酵罐中取样针每隔2 h取样一次,取样发酵液1 mL,用去离子水稀释100倍,测其在278 nm和610 nm处的吸光度值,每种测5次取平均值,求出目标产物的吸光度值并记录。
1.7.2 溶氧量变化曲线
采用Mettler Toledo InPro 6000型溶氧电极在线检测。
1.7.3 p H值变化曲线
采用M ettler To ledo InPro 3030型p H玻璃电极在线检测。
2 结果与讨论
2.1 菌体生长曲线
为确定Bt所处迟缓期、对数生长期和稳定期等生长时期的具体时间,制作了Bt的生长曲线,见图1。
可以看出,菌体在0~4 h生长非常缓慢,称之为迟缓期,这主要是菌体适应新培养基环境以及自身的萌发所需要的时间;在5~10 h吸光度值迅速增加,这说明菌体总数迅速增加,成对数增长趋势,称之为对数期;10 h以后,吸光度变化已经不明显,这说明菌体数增加维持稳定。
工业上发酵周期是一个关键因素,如何降低发酵周期直接影响到发酵的效益。在工业发酵中,迟缓期会增加生产周期而产生不利的影响。因此,可以利用对数期的细胞作为“种子”,接种前后所使用的培养基组分不要相差太大,以避免适应新培养基环境所需时间,从而缩短发酵周期。
2.2 610 nm处吸光度曲线比较
对于Bt菌来说,在610 nm处吸光度最大,因此用发酵液610 nm处吸光度变化曲线来表征菌体生长变化曲线。对于3种不同活化时间的菌种,接种后发酵液在610 nm处的吸光度变化曲线如图2所示,测量方法见1.7.1。
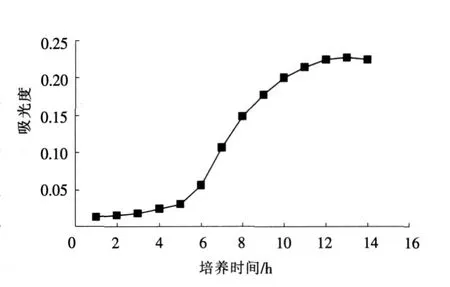
图1 Bt菌体生长曲线Fig.1 Grow th curves of bacillus thuringiensis
可以看出,对于用未活化的菌体作为菌种发酵时,在接种6 h时间内,吸光度变化比较缓慢,说明在此阶段还没有大量繁殖,处于群体生长规律中的迟缓期。这是由于把固体培养的菌体直接作为菌种,接种前后培养基成分差别较大,芽孢需要适应新环境,暂时缺少足够的能量和必需的生长因子,导致了迟缓期的形成。随后进入生长的对数期,此阶段大概持续了10 h,对数期持续时间越长,对发酵越有利。在16~32 h进入稳定期,随后进入衰亡期。活化8 h菌种发酵相对于未活化的菌种发酵来说,迟缓期明显缩短或不存在,这主要是因为菌种已在相同成分的培养基中得到活化,已经到达了对数生长阶段,接种于发酵罐后前后培养基成分无明显差别,使菌体不需要重新适应环境,可以使对数生长得到继续。从活化8 h的菌种发酵中可以看出,在4~14 h处于对数生长期,14~30 h处于稳定生长期。菌种经过活化13 h后菌体已处于生长的稳定期,此时接种于发酵罐中,与活化8 h的菌种发酵相比较,610 nm处吸光度曲线除初始吸光度稍有增加外,无明显变化。
从以上分析可以看出,将在相同培养基成分中活化8 h的菌体作为菌种,可使Bt的迟缓期时间缩短4 h左右,而菌体稳定期持续的时间无明显变化。
2.3 278 nm处吸光度曲线比较
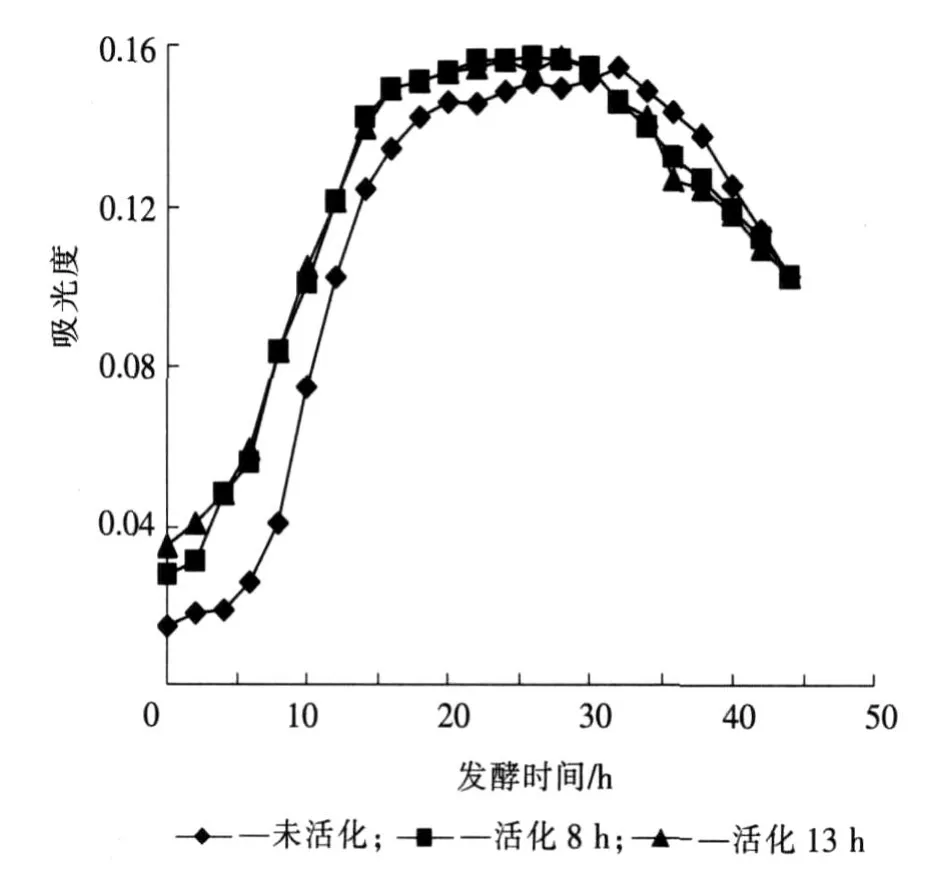
图2 活化时间对发酵液610 nm处吸光度的影响Fig.2 Effect of the activated time on abso rbency at 610 nm
经测量,目标产物(伴胞晶体和芽孢混合物)在278 nm处吸光度最大,因此发酵液在278 nm处吸光度变化曲线可以表征目标产物的变化曲线。对于3种不同活化时间的菌种,接种后发酵液在278 nm处的吸光度变化曲线如图3所示,测量方法见1.7.1。
未经活化的菌种发酵时,发酵液在278 nm处的吸光度在前10 h变化不明显,说明目标产物还未大量形成、释放。随着菌体的大量繁殖,进入生长对数期,此阶段吸光度开始增加,表明伴孢晶体和芽孢开始大量形成并释放。随后菌体生长进入稳定期,但目标产物的吸光度仍然增加,说明芽孢囊仍然不断破裂,释放出伴孢晶体,伴孢晶体的总量不断增加。在36 h处达到最大值,相对稳定5 h后,吸光度开始下降。而经活化8 h的菌种接种,在发酵32 h后发酵液278 nm处吸光度达到最大值,相对未活化的菌体作为菌种来说,吸光度提前4 h达到最大值。从图3可以看出活化8 h和活化13 h的菌体作为菌种发酵时,发酵液在278 nm处的吸光度曲线无明显变化。这说明并不是活化时间越长,目标产物的量越多,这与菌种所处的生长阶段有关。
从上面比较中看出,未活化菌种接种和经活化的菌体接种培养,目标产物达到最大值的时间前者比后者提前4 h,这主要是由于经活化8 h的菌种使生长的迟缓期缩短或消失所造成的。
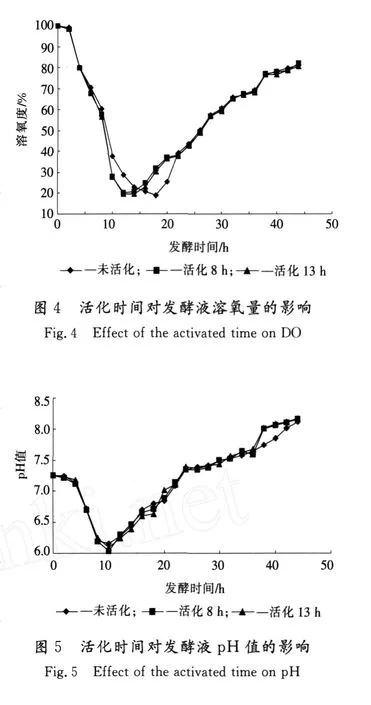
2.4 溶氧量变化曲线比较
对于3种不同活化时间的菌种接种后,发酵过程中发酵液溶氧量变化曲线见图4,测量方法见1.7.2。
溶氧曲线从侧面也能反应出菌体的生长过程,菌体生长越快,所需氧气量越大,发酵液中的溶氧量就越低。图4中用未经活化菌种发酵时,溶氧最低点出现在菌体生长15~20 h的对数期,说明此时菌体增长率最高、新陈代谢最活跃。活化8 h和活化13 h的菌种发酵时,溶氧量最低点都出现在12 h,说明其最快增长期比用未活化的菌种发酵提前3 h。针对出现溶氧最低点的时刻,生产中可以在溶氧最低点时刻提高供氧量和补料,从而延长菌体的对数生长期或出现第2对数期,达到高效发酵的目的。
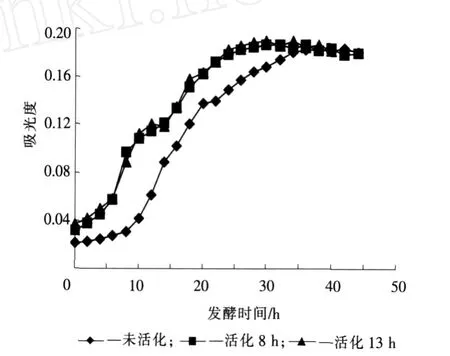
图3 活化时间对发酵液278 nm处吸光度的影响Fig.3 Effect of the activated time on absorbency at 278 nm
2.5 p H值变化曲线比较
对于3种不同活化时间的菌种,接种后发酵液p H值的变化曲线如图5所示,测量方法见1.7.3。
发酵过程中随着代谢产物的积累,会使发酵液环境发生变化,使芽孢和晶体蛋白的形成受到影响,尤其是对p H值的影响,当p H值大于8时不利于伴孢晶体的形成。由于发酵液中的葡萄糖经 EM P和PP途径降解成醋酸和丙酮酸,导致p H值下降,随着醋酸等被进一步异化,p H值逐渐回升。在图5中以未活化的菌种接种,在发酵42 h后p H值到达8.0,由于p H值的影响伴孢晶体总量开始下降。从图3中也可以看出,278 nm处的吸光度在增加到一定程度后会出现5~6 h的相对稳定期,由于p H值增大的影响,稳定期过后吸光度值开始下降,因此把到达相对稳定期初始点所需时间作为发酵周期,而不把278 nm处吸光度开始下降处作为结束的标志。
综上,将3种不同活化时间菌种发酵的各参数最大(小)值及到达最大(小)值处的时间进行统计,见表1。从表1中可以看出,菌种的不同培养时间直接影响发酵的过程和周期。用未活化的菌体直接接种固体培养和用经过活化8 h的菌体作为菌种接种时,菌数(610 nm处吸光度)和目标产物(278 nm处吸光度)到达最大值时前者要比后者晚4 h,而菌体活化8 h和活化13 h后接种出现最大值处的时间没有明显变化。因此比较可知,菌体活化8 h后接种为最佳的活化时间,这样可使发酵周期提前4 h,而所获得的目标产物的量基本不变。
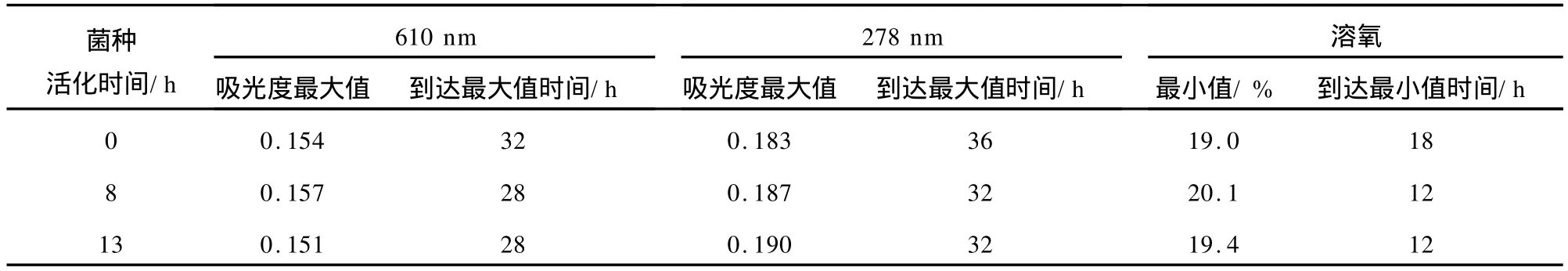
表1 发酵液的吸光度和溶氧Tab.1 Absorbency and DO of ferment liquids
3 结 语
利用处于对数期的菌体作为“种子”,并且尽量使接种前后所使用的培养基组分不要相差太大,能够使Bt的发酵周期缩短4 h(由原来的32 h缩短为28 h),从而提高生产效率。
[1]YASUHISA K.Current status and p rospects on microbial control in Japan[J].Journal of Invertebrate Pathology,2007,95:181-186.
[2]孙翠霞,弓爱君,姚伟芳,等.苏云金芽孢杆菌固态发酵培养基的优化[J].化学与生物工程(Chem istry and Bioengineering),2006,23(8):34-36.
[3]姚伟芳,弓爱君,宋小春,等.Bt固态发酵条件的研究进展[J].现代农药(Modern Agrochemicals),2006,5(3):4-6.
Effect of activated time of Bt on ferment cycle
YANG Kai-jie
(Polytechnic Department,Xingtai University of Broadcast and Television,Xingtai Hebei 054000,China)
By studying the grow th curve of bacillus thuringiensis,the experiment takes Bton various grow th phases as"seeds"to ferment,then the curves of abso rbency in 610 nm and 278 nm,dissolved oxygen and p H value are obtained.By comparing the curves,the best phase of Bt"seeds"is on the log phase.In comparison w ith unactivated Bt,the ferment cycle decreases from 32 h to 28 h.
bacillus thuringiensis(Bt);ferment cycle;activated time
Q 936
A
1008-1542(2010)06-0534-04
2010-07-07;
2010-09-16;责任编辑:张士莹
杨开杰(1964-),男,河北邢台人,讲师,主要从事生物农药方面的研究。
