用钛基锑–锡氧化物涂层电极研究橙黄G的电化学降解第二部分
——橙黄G的电催化氧化及其机理
2010-11-15方战强杨梅徐勇军李伟善
方战强,杨梅,徐勇军,李伟善
(1.华南师范大学化学与环境学院,广东 广州 510006;2.东莞理工学院,广东 东莞 511700;3.广东高校电化学储能与发电技术重点实验室,广东 广州 510006)
【三废治理】
用钛基锑–锡氧化物涂层电极研究橙黄G的电化学降解第二部分
——橙黄G的电催化氧化及其机理
方战强1,*,杨梅1,徐勇军2,李伟善1,3
(1.华南师范大学化学与环境学院,广东 广州 510006;2.东莞理工学院,广东 东莞 511700;3.广东高校电化学储能与发电技术重点实验室,广东 广州 510006)
考察了不同工艺条件下Ti/Sb–SnO2电极对橙黄G去除效果的影响。结果表明:当电流密度为4.8 mA/cm2,橙黄G初始质量浓度为40 mg/L,氯化钠浓度为0.35 mol/L,pH = 7时,室温下电解8 min,橙黄G的去除率达到90.2%,其降解过程符合一级反应动力学模型,速率常数为0.063 31 min−1。通过考察橙黄G在NaCl和Na2SO4两种电解质中的去除效果,推导其降解机理,并采用紫外–可见(UV–Vis)吸收光谱和高效液相色谱–质谱联用仪(HPLC–MS)鉴定了中间产物。
钛基电极;锑–锡氧化物涂层;橙黄G;降解;电催化;吸收光谱
1 前言
本文的第一部分[1]采用扫描电子显微镜(SEM)、能量色散谱(EDS)、X射线衍射仪(XRD)和电化学测量技术等方法,对刷涂热分解法制备的Ti/Sb–SnO2电极进行了表征,发现该电极的催化氧化性能比Ti基体有明显提高。为了证明此结论,继续采用恒流电解法对橙黄G模拟废水进行氧化降解研究,考察该电极在不同工艺条件下对橙黄G去除效果的影响。通过对不同电解质种类(包括NaCl和Na2SO4)对橙黄G去除效果的研究,推导其降解机理,并采用紫外–可见(UV–Vis)光谱仪和高效液相色谱–质谱联用仪(HPLC–MS)鉴定了降解过程的中间产物。
2 实验
2. 1 电解实验
利用自制的电解装置进行电解实验,以Ti/Sb–SnO2电极为阳极,Ti片为阴极,由稳压电源提供稳定电流。电极间距1.5 cm,电极面积2.5 cm × 2.5 cm,采用中速搅拌。以氯化钠或硫酸钠溶液作为电解质,用0.1 mol/L NaOH和0.1 mol/L H2SO4调节溶液的pH。
2. 2 分析方法
橙黄G的浓度采用分光光度法测定,检测波长为477 nm。
UV–Vis吸收光谱测试的波长范围为200 ~ 900 nm,采用中速扫描。
橙黄G去除率(η)的计算公式为:
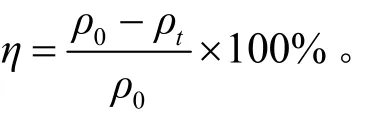
式中ρ0为起始时刻橙黄G的质量浓度(mg/L),ρt为t时刻橙黄G的质量浓度(mg/L)。
采用 HPLC–MS鉴别中间产物,流动相 A为10 mmol/L醋酸铵,流动相B为乙腈,线性梯度洗脱(50 min内乙腈由5 %走到40 %),C18柱(150 mm × 2.1 mm,5 μm),柱温30 °C,流速1.0 mL/min,进样量20 μL,紫外检测器300 nm。电离方式:电喷雾电离源,正离子模式(ESI+),脱溶剂气(N2)温度450 °C,气体流速12 L/min,喷雾电压4.5 kV,锥孔电压100 V。
3 结果与讨论
3. 1 电解工艺条件对橙黄G去除率的影响
室温下,采用Ti/Sb–SnO2电极,以氯化钠溶液作为电解液,讨论不同工艺参数对橙黄G去除率的影响。
3. 1. 1 电流密度的影响
在橙黄G初始质量浓度为80 mg/L,电解质浓度为0.3 mol/L,pH = 7的条件下,电流密度对橙黄G降解的影响如图1所示。

图1 电流密度对橙黄G去除率的影响Figure 1 Effect of current density on removal of Orange G
Ti/Sb–SnO2电极对橙黄G的去除率随着电流密度的增加而增大。当电流密度为1.6 mA/cm2时,电解5 min时橙黄G的去除率为64%;当电流密度增大到8.0 mA/cm2时,电解5 min时橙黄G的去除率增大到88.6%。此后进一步增大电流密度,橙黄G的去除率变化不大。为了提高电流效率,选择4.8 mA/cm2为最佳电流密度。3. 1. 2 橙黄G初始质量浓度的影响
如图2所示,在电流密度为4.8 mA/cm2,电解质浓度为0.3 mol/L,pH = 7的条件下,当橙黄G初始质量浓度由10 mg/L增加到40 mg/L时,Ti/Sb–SnO2电极对其去除率明显增大,但是当初始质量浓度再增大时,去除率反而下降。不同初始质量浓度的橙黄G溶液中,因为电解质浓度相同、电流密度恒定,所以产生的活性基团(氯、次氯酸或羟基自由基)的量就相同。由于这些活性基团没有选择性,因此橙黄G初始质量浓度较高时,一部分活性基团就去氧化中间产物,导致高初始质量浓度时,去除率随着其增大而减小。为了节约能源以及考虑对环境的影响,选择40 mg/L为最佳橙黄G初始质量浓度。

图2 橙黄G初始质量浓度对橙黄G去除率的影响Figure 2 Effect of initial mass concentration of Orange G on its removal
3. 1. 3 电解质浓度的影响
在电流密度为4.8 mA/cm2,橙黄G初始质量浓度为40 mg/L,pH = 7的条件下,氯化钠浓度对橙黄G去除率的影响如图3所示。
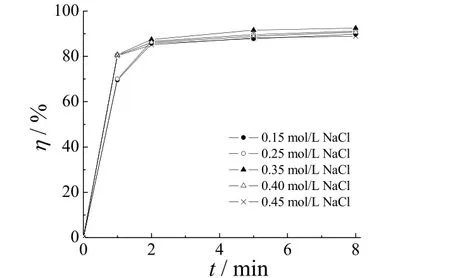
图3 电解质浓度对橙黄G去除率的影响Figure 3 Effect of electrolyte concentration on removal of Orange G
当电解质浓度由0.15 mol/L增加到0.35 mol/L时,电解前2 min,去除率明显增大;但是当电解质浓度大于0.35 mol/L时,去除率几乎没有变化。这是因为在本实验中活性氯也参与氧化降解橙黄 G,所以增加电解质浓度就增加了氯离子浓度,那么阳极表面的氯离子浓度就增大,生成的氯气增加,次氯酸就增多,与橙黄G反应的机会增大。但是当电解质浓度增大到一定程度时,大部分电量会用于氯离子生成氯气,而不是用于氧化橙黄 G,这就导致去除率没有太大变化。所以,选择适当的电解质浓度,既节省资源又提高电流效率。
3. 1. 4 pH的影响
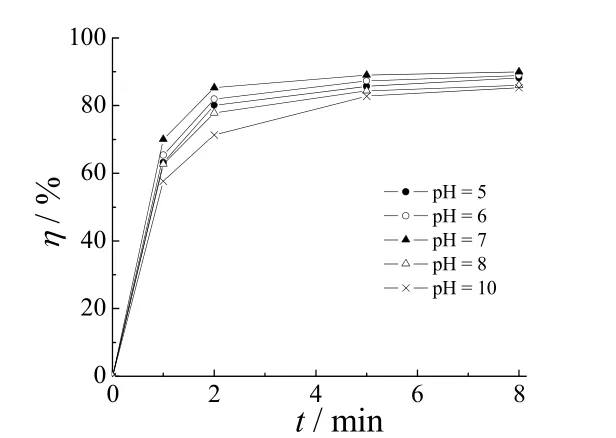
图4 pH对橙黄G去除率的影响Figure 4 Effect of pH on removal of Orange G
在电流密度为4.8 mA/cm2,初始橙黄G质量浓度为40 mg/L,电解质浓度为0.35 mol/L的条件下,pH对橙黄G去除率的影响如图4所示。pH = 7时电解8 min,去除率达到最大值,为90.2%。中性条件下主要生成次氯酸钠,酸性条件下主要生成次氯酸,而次氯酸钠的氧化电位为0.94 V(相对于SCE),低于次氯酸的氧化电位1.49 V(相对于SCE)。在相同电流密度下,中性溶液的氧化能力更强,所以其去除效果较好。pH > 7不利于氯气或次氯酸钠的生成,那么次氯酸根相对较少,同时参与竞争的副反应——析氧反应增强,在电流密度不变的情况下抑制了活性基团的产生,导致橙黄G去除率下降。
3. 2 动力学研究

根据绝对速率理论,用式(1)模拟降解橙黄G的动力学方程。其中 c是电解时间为 t时剩余橙黄 G的质量浓度(mg/L),c0为初始橙黄G的质量浓度(mg/L),k为反应速率常数(min−1),t为电解时间(min)。
在电流密度为4.8 mA/cm2,初始橙黄G质量浓度为40 mg/ L,氯化钠浓度为0.35 mol/L,pH = 7的条件下,分别采用Ti电极和 Ti/Sb–SnO2电极电解橙黄G溶液,对实验所得数据进行模拟,得与t的关系如图5所示。

图5 两种电极的动力学曲线Figure 5 Kinetic curves for two types of electrodes
由图5可知,两种电极的 ln( c c0)与t都很好地符合线性关系,Ti电极的动力学方程为 y = 0.03319 + 0.028 92 x,Ti/Sb–SnO2电极的动力学方程为 y =−0.032 95 + 0.063 31 x。上述两个方程的线性相关因数分别为0.992 81和0.995 40,表明两电极降解橙黄G的过程都符合一级反应动力学规律。Ti/Sb–SnO2电极的反应速率常数为0.063 31 min−1,而Ti电极的反应速率常数为0.028 92 min−1。由此可见,Sb–SnO2涂层可以明显提高Ti电极的电化学性能。
3. 3 机理分析
在最佳工艺条件下,分别采用电导率相等(均为2.78 S/m)的NaCl和Na2SO4溶液作为电解质,考察不同电解质种类对橙黄G去除率的影响,结果如图6所示。在以NaCl为电解质的溶液中,电解20 min后的去除率达到90%以上;而Na2SO4体系中的去除率仅为59%。这说明本实验中Cl−起了重要作用。同时,在采用NaCl体系的实验过程中,可闻到有刺激性气味的气体,这也进一步确定本实验中存在活性氯的氧化过程。
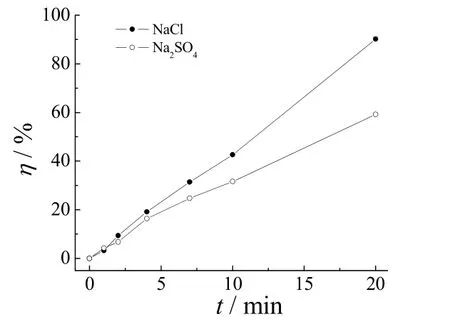
图6 电解质种类对橙黄G去除率的影响Figure 6 Effect of electrolyte type on removal of Orange G
为了进一步说明问题,采用电导率均为 2.78 S/m的NaCl和Na2SO4体系,在最佳工艺条件下进行降解实验,对不同时间的样品进行UV–Vis分析,结果如图7所示。
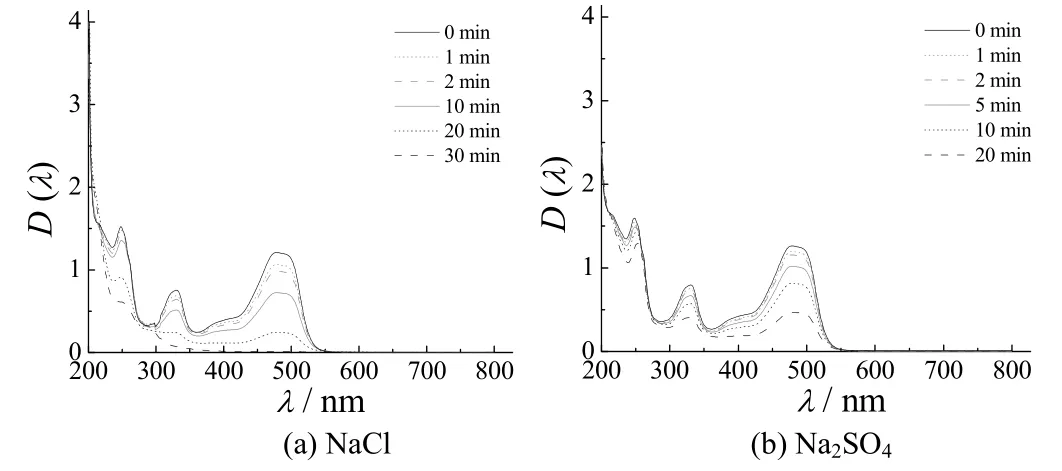
图7 电解不同时间后,含橙黄G的NaCl和Na2SO4体系的紫外–可见吸收光谱Figure 7 Ultraviolet–visible absorption spectra of NaCl and Na2SO4 solutions containing Orange G after electrolysis for different time
由图7可知,最大吸收波长都在477 nm,是由发色的偶氮键与其他双键形成的共轭体系所致;在247 nm和329 nm处的吸收,是由芳香环的K带和R带电子跃迁引起的。随着电解时间的延长,NaCl体系在波长477 nm、247 nm和329 nm处的吸光度逐渐减小,甚至消失;而在Na2SO4体系中,上述3处还有吸收峰存在。这说明,相同条件下Na2SO4体系中还存在橙黄G,从而表明在NaCl体系中,Ti/Sb–SnO2电极降解橙黄G的能力有所提高。
3. 4 中间产物的鉴别
采用HPLC–MS鉴别了Ti/Sb–SnO2电极在两种体系中降解橙黄G的中间产物。橙黄G的初始质量浓度为400 mg/L,可增强HPLC–MS扫描中的信号。中间产物可能的化学式如表1所示。
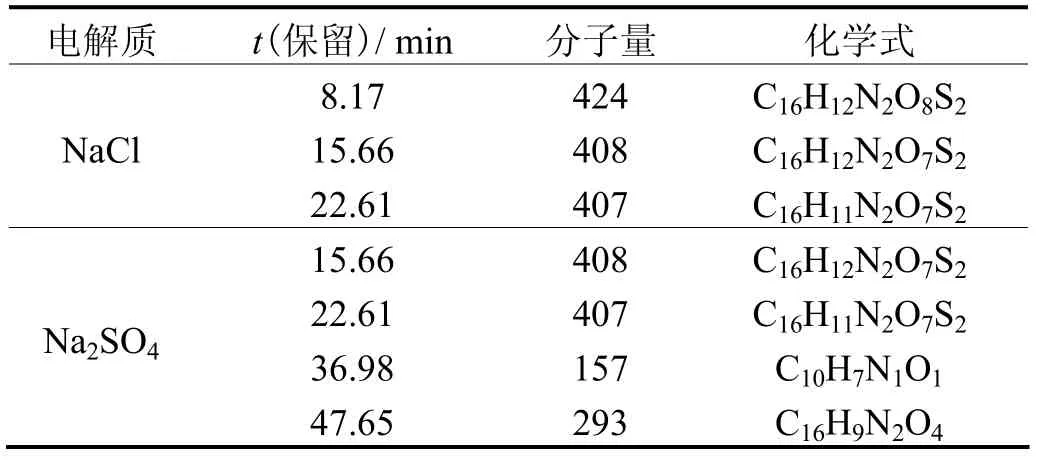
表1 不同电解质溶液中橙黄G降解中间产物的化学式Table 1 Proposed chemical formulas of the intermediate products from the degradation of Orange G in different electrolytes
在 NaCl体系中的中间产物主要有3种,即分子量分别为424、408和407的物质,其中分子量为407和408的物质都是未降解的橙黄G所形成的。质谱图中没有检测到任何小分子量的物质,说明在NaCl体系中活性基团(氯或次氯酸)将大部分橙黄 G氧化成了CO2和H2O,少量橙黄G由羟基自由基氧化去除。在Na2SO4体系中的中间产物有 4种,其分子量分别为157、293、407和408,其中分子量为293的物质是羟基自由基取代的一种产物。如果偶氮键被打开就会形成苯胺和分子量为319的物质,而分子量为157的物质正是分子量为319的物质在羟基自由基作用下的产物。所以,在Na2SO4体系中主要是羟基自由基氧化橙黄G,生成苯胺和分子量为319的物质。因此,在NaCl体系中Ti/Sb–SnO2电极降解橙黄G时,同时存在多种活性基团的共同氧化过程。
4 结论
实验所制备的Ti/Sb–SnO2电极对橙黄G有很好的降解效果。通过考察NaCl和Na2SO4两种电解质中橙黄G的电解过程,发现Ti/Sb–SnO2电极在NaCl体系中同时存在羟基自由基和活性氯的氧化过程,而在Na2SO4体系中只存在羟基自由基的氧化。采用紫外–可见光谱仪和高效液相色谱–质谱联用仪鉴定中间产物后发现,在Na2SO4体系中主要生成分子量为319的物质和苯胺,而在NaCl体系中大部分橙黄G被降解为CO2和 H2O。因此,Ti/Sb–SnO2电极在降解偶氮类染料时最好选择NaCl为电解质,不仅可以节约电能,而且无有毒、有害中间产物生成。
[1] 方战强, 杨梅, 徐勇军, 等. 用钛基锑–锡氧化物涂层电极研究橙黄 G的电化学降解: 第一部分——电极的制备及电化学性能[J]. 电镀与涂饰, 2010, 29 (8): 40-42.
[ 编辑:温靖邦 ]
Study on electrochemical degradation of Orange G by titanium-based antimony and tin oxide coated electrode Part II—Electrocatalytic oxidation of Orange G and the mechanism //
FANG Zhan-qiang*, YANG Mei, XU Yong-jun, LI Wei-shan
The effects of process conditions on the removal of Orange G by Ti/Sb–SnO2electrode were studied. The results showed that the removal rate of Orange G reaches 90.2% after electrolysis in a 0.35 mol/L NaCl solution at room temperature, pH 7 and current density 4.8 mA/cm2for 8 min when the initial mass concentration of Orange G is 40 mg/L. The degradation of Orange G in the above system follows the first-order reaction kinetics with a rate constant of 0.063 31 min−1. The degradation mechanism was deduced by examination of the removal efficiency of Orange G in NaCl and Na2SO4electrolytes, respectively. The intermediate products were analyzed by high-performance liquid chromatography–mass spectroscopy (HPLC–MS) technique and ultraviolet–visible (UV-Vis) absorption spectroscopy.
titanium-based electrode; antimony and tin oxide coating; Orange G; degradation; electrocatalysis; absorption spectroscopy
College of Chemistry and Environment, South China Normal University, Guangzhou 510006, China
O646; X788
A
1004 – 227X (2010) 09 – 0039 – 04
2010–01–19
2010–03–15
广东省教育厅自然科学重点项目(06Z025)。
方战强(1977–),男,河南人,博士,教授,研究方向为环境功能材料的制备、表征及其应用,承担了国家、省市级科研项目6项,企业委托的科研项目20多项,发表学术论文30多篇。
作者联系方式:(E-mail) lisan408@yahoo.cn。
