一种检测麦芽蛋白质溶解度的新方法
2010-11-10姜晓雷孙丽华莫新迎赵长新
韩 丹,姜晓雷,孙丽华,莫新迎,陈 霞,赵长新,*
(1.大连工业大学生物与食品工程学院,辽宁大连116034;2.辽宁经济管理干部学院,辽宁沈阳110122)
一种检测麦芽蛋白质溶解度的新方法
韩 丹1,姜晓雷1,孙丽华2,莫新迎1,陈 霞1,赵长新1,*
(1.大连工业大学生物与食品工程学院,辽宁大连116034;2.辽宁经济管理干部学院,辽宁沈阳110122)
麦芽库值是反映大麦蛋白质溶解的重要指标,只有溶解适度的麦芽才能酿制出高品质的啤酒,因此麦芽蛋白质溶解度的检测尤为重要。EDTA是一种良好的金属离子螯合剂,本文分别用不同浓度的EDTA水溶液培养大麦,利用EDTA、金属离子和蛋白酶活性之间的关系,分析EDTA对蛋白酶活力和麦芽中各组分蛋白含量的影响、各蛋白组分之间的转化及其与麦芽库值的相关性,并以此为据建立检测麦芽蛋白质溶解度的新方法。
库值,麦芽蛋白溶解度,EDTA,蛋白含量,SDS-PAGE电泳
库尔巴哈值(下简称库值)是麦芽蛋白溶解的一个重要指标[1]。发芽时麦粒中蛋白质的溶解是否适当是决定麦芽和啤酒质量的主要因素,如用溶解不足的麦芽酿造啤酒,其浸出物得率低,泡持性差,且易产生浑浊;如采用溶解过度的麦芽,则会引起酵母早衰,酒味淡薄。因此,正确把握麦芽蛋白质溶解度对于保证啤酒品质具有重要意义。传统检测麦芽蛋白溶解度的方法测定库值,此法仅能从宏观上反映蛋白质的溶解程度,不能充分反映其溶解过程,且操作麻烦,因此建立简便有效的检测方法尤为重要。在大麦发芽过程中,蛋白质的分解主要依靠蛋白酶,而蛋白酶活的发挥大多需要金属离子参与。已有研究表明,大麦发芽过程中金属离子对制麦酶系活力有明显的激活作用。乙二胺四乙酸二钠(EDTA)是一种金属离子螯合剂,能与大部分金属离子形成稳定的水溶性螯合物。本论文根据金属离子与大麦酶系的关系,利用EDTA与金属离子的关系在浸麦时添加不同浓度的EDTA以去除金属离子作用,从而抑制蛋白酶活性,改变其对蛋白质的分解和麦芽蛋白含量,并通过检测库值掌握这些麦芽的蛋白质溶解程度。同时根据Osborne的溶解度分类法[2-3],分别提取这些麦芽的水溶、盐溶、醇溶和碱溶蛋白,分析其SDS-PAGE电泳图谱,从中找出各蛋白组分间的相互转化及其与麦芽库值的相关性,并以此联系为依据建立检测麦芽蛋白质溶解度的新方法,为工业上评估和改良酿造大麦和麦芽质量提供更简便有效的判据。
1 材料与方法
1.1 材料与仪器
大麦 Gairdner(澳大利亚),由大连中粮麦芽有限公司提供;标准牛血清白蛋白、丙烯酰胺、甘氨酸(Amresco)、SDS-PAGE低分子量蛋白质标准(TaKala);考马斯亮蓝 R-250/G-250、干酪素、EDTA、95%乙醇、NaCl、NaOH等 均为国产分析纯。
ZPS-250H智能恒温恒湿培养箱 黑龙江东拓仪器制造有限公司;WFJ7200可见光分光光度计 尤尼柯仪器有限公司;YQ-PJ-6B型自动糖化器 轻工业部西安轻机所光电公司;GTL-16A离心机 上海浦东物理光学仪器厂;JM-250型垂直板电泳仪 上海捷迈科贸有限公司。
1.2 实验方法
1.2.1 麦芽的制备 分别选取浓度为0.05%、0.10%和0.15%的EDTA水溶液培养大麦,并以水培养作为空白对照。采用浸水5h断水10.5h,再浸水6h断水3h的方式浸麦,使其最终浸麦度达到44%~47%,然后进入发芽阶段,控制温度16℃、湿度90%以上,发芽96h后焙焦制成麦芽。分别取发芽0、24、48、72、96h的绿麦芽和焙焦后的成品麦芽样品备用。
1.2.2 蛋白酶活力的测定 称取擦干表面水的上述绿麦芽10g,粉碎后放入糖化杯内,加入去离子水90mL、pH5.0的醋酸-醋酸钠缓冲液10mL,于40℃水浴保温搅拌1h后,2800r/min离心15min。最后得到的上清液用来测定蛋白酶活性。具体测定方法详见参考文献[4]。
1.2.3 蛋白的提取 水溶、盐溶、醇溶和碱溶四种蛋白的提取方法详见参考文献[5]。
1.2.4 蛋白含量的测定 采用Bradford法,使用牛血清白蛋白作为标准蛋白,详见参考文献[6]。
1.2.5 SDS-PAGE电泳 按照 Laemmli的 SDSPAGE方法[7],浓缩胶5%,分离胶12%,考马斯亮蓝R-250染色,醋酸-甲醇体系脱色。
1.2.6 麦芽指标的测定 具体测定方法详见《啤酒工业手册》[8]。
2 结果与讨论
2.1 不同浓度EDTA对大麦发芽过程中蛋白酶活力的影响
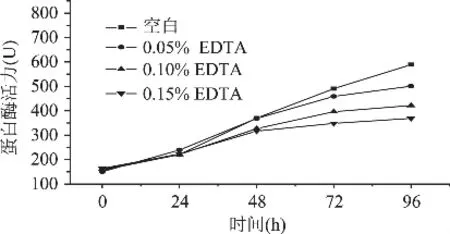
图1 大麦发芽过程中蛋白酶活力的变化
由图1可知,EDTA的加入对未萌发的大麦种子几乎没有影响,三种浓度下的蛋白酶活力与空白对照相差不大。发芽初期由于赤霉素的诱导,麦芽中各种酶的活力得到活化,如图可见发芽24h后蛋白酶活力开始增长。部分蛋白酶需要有金属离子的存在才能充分发挥其催化活性,尤其羧肽酶是一个含Zn2+的蛋白酶,Zn2+与酶结合在其活性部位。发芽24h后EDTA逐渐渗入麦芽内部,开始螯合其中的金属离子,于是大麦各蛋白酶中以金属离子为活性中心组成部分或激活剂的羧肽酶等蛋白酶活力逐渐降低,因此由图中可见,加入EDTA后的蛋白酶活力被部分抑制。EDTA添加浓度为0.10%和0.15%的大麦中蛋白酶活力增长速度较空白减慢。发芽48h后EDTA添加浓度为0.05%的大麦蛋白酶活力增长速度也开始减慢。发芽结束点96h时各麦芽中酶活力差异最大,且随EDTA添加浓度的升高依次降低,分别为500.559、421.732、369.136U,均低于空白对照的589.061U。
2.2 不同浓度EDTA对麦芽库值的影响
由图2可见,在浸麦过程中加入不同浓度的EDTA可以降低麦芽的库值,且加入的EDTA浓度越高库值越低,大麦蛋白质溶解越差。说明EDTA的添加对于大麦蛋白的溶解产生了抑制作用。
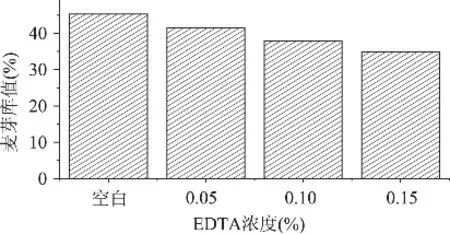
图2 添加不同浓度EDTA对麦芽库值的影响
2.3 不同浓度EDTA对麦芽蛋白含量的影响
由2.1研究可知,添加不同浓度EDTA抑制了大麦发芽过程中蛋白酶的活力,且在发芽结束时各麦芽中蛋白酶活力差异较大。于是取水、0.05%、0.10%和0.15%EDTA四种培养条件下的麦芽(其中水培养的作为空白),分别提取其水溶、盐溶、醇溶和碱溶蛋白,并测定含量,结果如图3所示。从图中可以看出,EDTA的添加不同程度地改变了麦芽中四种蛋白的含量。
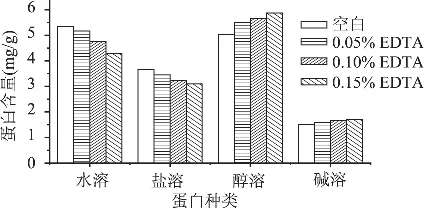
图3 麦芽中水溶、盐溶、醇溶和碱溶蛋白的含量
已有研究表明大麦发芽过程中贮藏蛋白不断分解成可溶性蛋白,并被输送到大麦胚部供根芽和叶芽生长,因此水溶蛋白和盐溶蛋白的含量是不断积累的,而作为贮藏蛋白的醇溶和碱溶蛋白含量的总体变化趋势是降低的。从图3可以看出,EDTA加入后明显降低了麦芽中水溶和盐溶蛋白的含量,且其含量均随EDTA添加浓度的升高而降低,可见EDTA抑制了蛋白酶活力后进一步影响了贮藏蛋白的分解,进而影响了可溶性蛋白的积累。因此作为贮藏蛋白的醇溶蛋白和碱溶蛋白的分解受到了抑制,且其分解量均随EDTA添加浓度的升高而降低,因此由图3中可以看出添加EDTA后的麦芽中醇溶蛋白和碱溶蛋白含量均比空白高。
2.4 麦芽中各蛋白组分间的相互转化及其与麦芽库值的关系
大麦发芽过程中蛋白质的溶解受蛋白质水解酶的控制。不同浓度EDTA的添加抑制了蛋白酶的活力,导致四种培养条件的麦芽中各蛋白含量和组分产生差别。分析上述现象的原因,EDTA是金属离子螯合剂,而大麦蛋白酶中的羧肽酶是一种含Zn2+的蛋白酶。由此可以推断,受EDTA影响而降低活力的蛋白质水解酶主要为羧肽酶。运用SDS-PAGE电泳分析麦芽各蛋白组分,结果见图4。可知,加入EDTA后,水溶和盐溶蛋白中分子量约50.0kDa左右的蛋白条带含量差异较大,且随EDTA添加浓度的升高而降低。醇溶蛋白29.0~97.2kDa之间的蛋白条带(尤其是 90.0kDa左右的蛋白)和碱溶蛋白90.0kDa和53.0kDa左右的蛋白条带含量高于空白,说明其分解受到了抑制,且其分解量随EDTA添加浓度的升高而降低,由此可知羧肽酶易作用于这些蛋白,并有固定的酶切割位点,切割后生成分子量约50.0kDa左右的蛋白,并最终转移到水溶和盐溶蛋白中。而切割后的部分未在电泳图谱中体现,推测其可能在其他蛋白酶的作用下被分别转移到其他组分中。

图4 麦芽中水溶、盐溶、醇溶和碱溶蛋白的SDS-PAGE电泳图谱
综上所述,大麦醇溶蛋白29.0~97.2kDa之间的蛋白和碱溶蛋白约90.0kDa和53.0kDa左右的蛋白受羧肽酶活力影响较大,且随EDTA添加浓度的升高其分解量降低,结合2.2中的研究可知麦芽的库值随EDTA添加浓度的升高而降低,由此可知上述蛋白被羧肽酶分解的越多,麦芽库值越高。它们被分解后生成分子量约50.0kDa左右的蛋白,并不断转移到水溶和盐溶蛋白中,结合图4和图2可知这条50.0kDa左右的蛋白条带含量与麦芽库值呈正相关,其含量积累的越高,麦芽库值越高。
2.5 检测麦芽蛋白质溶解度的新方法
根据麦芽质量标准,优级麦芽溶解适度,库值应大于41%。本研究中0.10%EDTA水溶液培养的大麦所制麦芽库值为41.4%,因此可以以此麦芽中水溶和盐溶蛋白50.0kDa左右的蛋白条带含量作为判定麦芽蛋白质溶解适度的标准,衡量麦芽蛋白质溶解程度及成品麦芽的品质。运用凝胶分析软件BandScan分析并计算出其含量分别为0.193mg/g和0.25mg/g。
由此可知,当麦芽水溶和盐溶蛋白50.0kDa左右的蛋白条带含量分别达到0.193mg/g和0.25mg/g以上时,相应的麦芽醇溶和碱溶蛋白易受羧肽酶影响的组分分解较好,麦芽溶解较好,品质较高。此方法比起工业上通过测定协定糖化麦汁中可溶氮与总氮含量计算出成品麦芽库值的方法简便很多。
3 结论
为了探寻可以替代检测库值的判定麦芽蛋白质溶解度的新方法,本文根据EDTA、金属离子及蛋白酶活力相互间的特殊关系,分别用不同浓度的EDTA水溶液培养大麦。结果表明,EDTA可以通过螯合维持蛋白酶活力所必须的金属离子降低麦芽中蛋白酶的活力,主要降低羧肽酶活力;抑制大麦发芽过程中蛋白的溶解,降低麦芽库值;减少高分子贮藏蛋白向可溶性蛋白的转化,改变麦芽中水溶、盐溶、醇溶和碱溶蛋白的含量。
运用SDS-PAGE电泳分析麦芽中四种蛋白,发现大麦醇溶蛋白29.0~97.2kDa之间的蛋白和碱溶蛋白90.0kDa和53.0kDa左右的蛋白受羧肽酶活力影响较大,它们被羧肽酶分解后生成分子量约50.0kDa左右的蛋白,并转移到水溶和盐溶蛋白中。当EDTA加入后,Zn2+被螯合,羧肽酶活力降低,醇溶和碱溶蛋白中易被作用组分分解受到抑制,最终导致水溶和盐溶蛋白的SDS-PAGE电泳图谱中50.0kDa左右的蛋白积累含量减少,麦芽库值降低,蛋白溶解受到抑制。由此可知,麦芽水溶和盐溶蛋白中50.0kDa左右的蛋白条带含量与麦芽蛋白质溶解程度呈正相关性,因此可以以其含量作为判定麦芽蛋白溶解适度的标准。运用凝胶分析软件BandScan分析此条带并计算其含量,结果表明当其在水溶和盐溶蛋白中含量分别达到0.193mg/g和0.25mg/g以上时,醇溶蛋白和碱溶蛋白中受羧肽酶影响较大的蛋白组分分解较好,麦芽溶解较好,品质较高。因此可以以此为依据建立检测麦芽蛋白质溶解程度的新方法。传统依靠检测麦芽库值来反映蛋白溶解度的方法仅能从宏观上反映出蛋白质溶解的程度,而本研究的方法可从微观上反映出麦粒内部各蛋白之间的相互转化关系及蛋白溶解过程,且操作上相对简单方便,对于深入研究大麦蛋白溶解理论、工业上评判麦芽质量和保证啤酒品质有着新的指导意义。
[1]Kunze W.啤酒工艺实用技术(第八版)[M].北京:中国轻工业出版社,2008:145-146.
[2]Osborne T B.The proteins of barley[J].American Chemical Society journal,1895,17:539-567.
[3]Osborne T B.The Vegetable Proteins[M].New York:Longmans Green and Co,1924.
[4]日本酱油研究所.酱油实验法[M].东京:日本酱油研究所出版,1985:294-298.
[5]Doll H,Andersen B.Preparation of barley storage protein,hordein for analytical sodium dodecyl sulfate polyacylamide gel electrophoresis[J].Analytical Biochemistry,1981,115:61-66.
[6]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[7]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[8]管敦仪.啤酒工业手册(修订版)[M].北京:中国轻工业出版社,1996.
A new method on detecting malt protein solution
HAN Dan1,JIANG Xiao-lei1,SUN Li-hua2,MO Xin-ying1,CHEN Xia1,ZHAO Chang-xin1,*
(1.Dalian Polytechnic University College Malting Buckwheat of Biology and Food Technology,Dalian 116034,China;2.Liaoning Economic management Cadre College,Shenyang 110122,China)
Malt Kolbach index is an important target on reflecting barley protein solution.Only the malts dissolved moderately could brew high quality beer,so the detection of malt protein solution is the most important.EDTA is a kind of good metal ions chelating agent.Different concentrations EDTA aqueous solution were used to culture barley,and the barleys which were cultured with water were used to make a contrast.ln this article,the influences of EDTA on protease activity and protein content in malts,the transition among the different protein ingredients and the relation to malt Kolbach index were analysed,new method on detecting malt protein solution was built basing on the results above.
Kolbach index;solution of malt protein;EDTA;protein content;SDS-PAGE
TS210.7
A
1002-0306(2010)11-0356-04
2010-01-14 *通讯联系人
韩丹(1984-),女,硕士研究生,研究方向:制麦、大麦生理及大麦蛋白。
国家科技部“十一五”科技支撑项目(2007BAK36B01)。
