四氢嘧啶提高脂肪酶催化合成油酸乙酯产率的研究
2010-11-10张苓花
王 越,张苓花
(1.大连海事大学环境科学与工程学院,辽宁大连116026;2.大连工业大学生物工程学院,辽宁大连116034)
四氢嘧啶提高脂肪酶催化合成油酸乙酯产率的研究
王 越1,2,张苓花1
(1.大连海事大学环境科学与工程学院,辽宁大连116026;2.大连工业大学生物工程学院,辽宁大连116034)
为了对抗乙醇对酶的竞争性抑制作用,提高酶法合成油酸乙酯的酯化率,在米曲霉DM-01全细胞脂肪酶催化合成油酸乙酯的无溶剂体系中添加补偿性溶质。结果表明,添加补偿性溶质四氢嘧啶效果最好,四氢嘧啶浓度为1.5mmol/L时,0.1g全细胞脂肪酶催化油酸乙酯酯化合成反应48h,油酸乙酯酯化率为61.4%,与未添加四氢嘧啶的相比,提高了24.8%,酯化速率提高了38.0%。在全细胞脂肪酶3次重复使用反应中添加四氢嘧啶,与未加四氢嘧啶的比较,油酸乙酯相对酯化率分别提高了24.7%、33.3%和166.8%。添加四氢嘧啶为提高酶法合成油酸乙酯的产率提供了一种新手段。
四氢嘧啶,油酸乙酯,脂肪酶,无溶剂体系
油酸乙酯是高级脂肪酸醇酯,被广泛用于化工和食品添加剂、特殊甘油三酯制备和柴油的添加剂等领域[1-2]。目前工业中主要采取十二烷基苯磺酸液体酸催化油酸和乙醇酯化生成,但需要在高温、高压及强酸条件下进行,副反应多,生产成本高[3-4]。为解决上述问题,人们研究利用脂肪酶催化油酸和乙醇进行酯化反应,制备油酸乙酯[5-6]。生物酶法制备油酸乙酯目前存在着一些亟待解决的问题,如底物乙醇影响酶反应活性及稳定性,酶价格高等,这些问题制约着生物酶法在工业中酯化反应的应用[5,7]。为降低乙醇对酶的抑制作用,以下几种方法被报道:a.构建逆胶束体系[8];b.添加介质[5];c.利用固定化脂肪酶[6];d.添加保护剂[9-11]。然而,至今尚未见到通过添加补偿性溶质提高油酸乙酯合成体系中脂肪酶活性和稳定性的报道。四氢嘧啶(1,4,5,6-四氢-2-甲基-4-嘧啶羧酸,英文名为ectoine,(结构式见图1[12])是由嗜盐菌在高渗透压诱导下合成的一种渗透压补偿溶质,有两性离子性质[14]。研究表明,四氢嘧啶对蛋白质、核酸、细胞等在逆环境下具有保护作用[12,14-16]。本文采用从白酒曲中筛选出来的米曲霉DM-01(Aspergillus oryzae DM-01)全细胞脂肪酶为催化剂,研究渗透压补偿性溶质四氢嘧啶对全细胞脂肪酶酯化合成油酸乙酯的影响,对于提高酶法酯化合成油酸乙酯的产率具有意义。

图1 四氢嘧啶结构式
1 材料与方法
1.1 材料与设备
产酶菌株 实验室筛选的菌株米曲霉DM-01(Aspergillus oryzae DM-01);化学试剂 四氢嘧啶按文献[17]方法制备;油酸、无水乙醇、氢氧化钠 分析纯;斜面培养基 马铃薯-2%蔗糖培养基;发酵培养基(L) 蛋白胨40g,蔗糖5g,橄榄油5g,硫酸铵1g,硫酸镁1g,磷酸氢二钾1g。
LGJ-10冷冻干燥机 宁波;METTLER TOLEDO电子分析天平 瑞士;ZHWY恒温培养摇床 上海。
1.2 实验方法
1.2.1 脂肪酶的制备 菌种米曲霉DM-01在斜面培养基30℃条件下培养3d,用无菌去离子水洗下孢子。1mL孢子悬浮液接到200mL发酵培养基中(500mL三角瓶),在 30℃、120r/min条件下发酵48h。经三层纱布过滤发酵液,收集菌丝体,用0.025mol/L、pH7.5磷酸缓冲液洗去发酵残留物,在冷冻干燥机冻干48h。研钵磨碎,干燥储存备用[18]。脂肪酶水解活性为89.9U/g,1U定义为40℃,pH7.5,1min水解乳化橄榄油产生1μmol脂肪酸所消耗的酶量。
1.2.2 酯合成 将10g油酸和无水乙醇(酸醇比因实验需要设定)置于50mL聚丙烯材料带盖离心管中,混合均匀,加入1%(w/w)米曲霉DM-01全细胞脂肪酶,在30℃、150r/min条件下振荡反应,定时取出反应液,用于油酸乙酯酯化率测定。为研究重复使用全细胞脂肪酶对油酸乙酯酯化率的影响,脂肪酶从反应体系中过滤分离,室温下风干,重新加入油酸和无水乙醇,反应48h为一个周期。
1.2.3 酯化率的测定
1.2.3.1 酯化过程酯化率的测定 按照文献[19]进行。油酸乙酯的酯化率定义为反应液中油酸酯化反应消耗的质量占反应前油酸质量的百分数(%),计算公式如下:

式中,V0-样品反应前用0.1mol/L氢氧化钠滴定的耗碱量,mL;V-样品反应后用0.1mol/L氢氧化钠滴定的耗碱量,mL。
1.2.3.2 相对酯化率 为重复使用全细胞脂肪酶催化合成油酸乙酯时,以第一次循环所合成的油酸乙酯酯化率为100%。
1.2.3.3 油酸乙酯酯化速率 单位时间油酸消耗的毫摩尔数(mmol/h),计算公式如下:
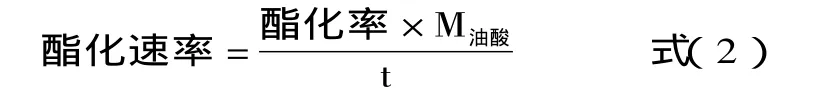
式中:M油酸-油酸起始摩尔数,30mmol;t-反应时间,h。
2 结果与讨论
2.1 酸醇比对酯化率的影响
考察了在无溶剂体系中油酸和乙醇摩尔比对油酸乙酯酯化率的影响,按照方法“1.2.2”在酸醇比为2∶1~1∶5合成反应体系中加入1%全细胞脂肪酶,反应48h,测定油酸乙酯酯化率,结果见图2。

图2 酸醇摩尔比对酯化率的影响
由图2可见,在高酸醇比时,酯化率随着酸醇摩尔比降低而增高,说明增大乙醇的用量有利于合成反应向生成油酸乙酯的方向移动。酯化率在酸醇摩尔比为1∶1时最大,达到50.4%。但乙醇量继续增加,酯化率呈明显下降趋势。从理论上来讲,1mol油酸完全酯化为相应的油酸乙酯至少需要1mol乙醇,本文当酸醇摩尔比超过1∶1时,乙醇便对脂肪酶活性造成抑制作用,因此下面实验的酸醇比均为1∶1。
2.2 添加渗透压补偿性溶质对油酸乙酯酯化合成的影响
为比较几种渗透压补偿性溶质对全细胞脂肪酶催化合成油酸乙酯的影响,按照反应体系体积1.5mmol/L的比例,将四氢嘧啶、海藻糖、甜菜碱和羟脯氨酸先溶解在乙醇中,按照方法“1.2.2”在油酸中加入溶有补偿性溶质的乙醇以及全细胞脂肪酶,反应48h,测定油酸乙酯酯化率。结果见图3。

图3 渗透压补偿性溶质对油酸乙酯酯化率的影响
由图3可以看出,四氢嘧啶、甜菜碱和羟脯氨酸都对全细胞脂肪酶催化合成油酸乙酯具有保护作用,和无保护剂比较,对应的油酸乙酯酯化率分别提高了24.8%、14.3%和14.3%。保护效果最好的是四氢嘧啶,其次是甜菜碱和羟脯氨酸,海藻糖对全细胞脂肪酶催化酯化合成油酸乙酯的保护效果不显著。
在脂肪酶催化酯化合成油酸乙酯的无溶剂体系中,作为底物的乙醇在一定浓度下对脂肪酶具有两个水平上的负面作用:一方面乙醇分子和酶结合会直接生成死端复合物,因此乙醇表现为动力学水平上的竞争性抑制[20];另一方面,乙醇作为蛋白质的变性剂引起酶蛋白天然构象的破坏,导致脂肪酶的不可逆失活[21]。在油酸乙酯酯化合成体系中添加四氢嘧啶,能显著地改善油酸乙酯酯化率。推测四氢嘧啶改善油酸乙酯酯化率是因为四氢嘧啶对乙醇环境中的脂肪酶的保护作用,即四氢嘧啶一方面降低了乙醇对脂肪酶的竞争性抑制;另一方面提高了乙醇环境下酶蛋白天然构象的稳定性,减少了酶的不可逆失活。根据图1的四氢嘧啶结构,推测其可能在反应体系中与酶以氢键结合,排阻并代替了部分乙醇与酶的结合,减少了酶分子与乙醇生成的死端复合物,从而提高了反应速率;同时四氢嘧啶与酶的结合,增加了酶结构“柔性”,从而增加了酶在乙醇环境中的稳定性。
2.3 四氢嘧啶添加量对油酸乙酯酯化合成的影响
考察添加四氢嘧啶对无溶剂体系中油酸乙酯酯化率的影响,按照方法“1.2.2”在油酸乙酯酯化合成体系中添加不同浓度的四氢嘧啶,反应48h,测定油酸乙酯酯化率,结果见图4。
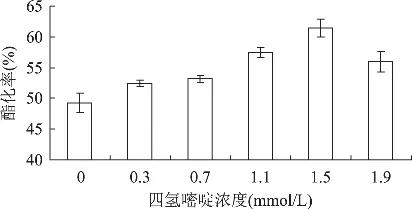
图4 四氢嘧啶添加的浓度对油酸乙酯酯化率的影响
从图4可知,四氢嘧啶能够提高脂肪酶催化油酸乙酯合成能力,添加1.5mmol/L的四氢嘧啶添加效果最好,酯化率为61.4%,与没有添加四氢嘧啶的相比,酯化率提高了24.8%。但四氢嘧啶浓度超过1.9mmol/L,油酸乙酯酯化率降低。
图4的结果表明,四氢嘧啶只有在适量范围内才有保护作用,超过范围则会抑制酶活性,降低油酸乙酯酯化率。据文献报道,在非水相脂肪酶催化油脂甲醇解时,补偿性溶质甘油适量时会提高酶在有机溶剂中的稳定性,但当甘油浓度较高时,会在脂肪酶表面形成亲水层,不仅阻碍了疏水性底物向酶活性中心的扩散,而且还富集了甲醇,导致甲醇对酶更强的抑制作用[22]。因此,推测添加过量四氢嘧啶对全细胞脂肪酶的影响,与甘油过量的情况相似,四氢嘧啶达到较高浓度(大于1.9mmol/L)后,在酶表面形成亲水层,富集了乙醇,导致油酸乙酯酯化率降低。
2.4 添加四氢嘧啶对酯化速率的影响
为考察添加四氢嘧啶对油酸乙酯酯化进程的影响,按照方法“1.2.2”在体系中添加1.5mmol/L的四氢嘧啶,测定油酸乙酯酯化率。根据酯化率和反应时间的关系,按照方法“1.2.3.3”,对油酸酯化量进行线性回归,求出油酸的酯化速率,结果见图5。
由图5所示,无保护剂的酯化速率是0.287mmol/h(R2=0.99),添加四氢嘧啶的酯化速率是0.396mmol/h(R2=0.9902),提高了38.0%。反应48h,酯化率分别是61.4%和49.2%,显示添加四氢嘧啶提高了油酸乙酯酯化速率。

图5 四氢嘧啶对酯化速率影响
2.5 四氢嘧啶对全细胞脂肪酶重复使用的影响
为考察四氢嘧啶对全细胞脂肪酶重复使用时酶活性的影响,按照方法“1.2.2”在酯化合成体系中添加1.5mmol/L的四氢嘧啶,反应48h。测定油酸乙酯的酯化率,每48h为一个反应周期。以不添加四氢嘧啶的第一次循环的油酸乙酯酯化率为100%。在3次重复使用全细胞脂肪酶催化酯化合成反应中,无添加和添加四氢嘧啶的合成油酸乙酯的相对酯化率见图6。

图6 四氢嘧啶对脂肪酶重复使用的影响
图6显示,不添加四氢嘧啶,油酸乙酯酯化率随重复使用次数的增加而降低,1~3次的相对酯化率分别为100%,41.4%和13.1%。添加四氢嘧啶,油酸乙酯的相对酯化率均显著提高,但仍随重复使用次数的增加而降低,1~3次分别为124.7%,55.2%和36.6%。与每次循环中未添加四氢嘧啶比较,相对合成率在第1、2、3次循环中分别提高了24.7%、33.3%和166.8%,说明添加四氢嘧啶可以延缓酶活性衰减的速度。但循环3次后,无论是否添加四氢嘧啶,油酸乙酯相对酯化率均较低,只有36.6%(添加四氢嘧啶)和13.1%。
3 结论
在米曲霉DM-01全细胞脂肪酶催化油酸和乙醇酯化合成油酸乙酯的无溶剂反应体系中,乙醇对脂肪酶有竞争性抑制作用,甚至引起蛋白天然构象的破坏,导致脂肪酶的不可逆失活。添加适量补偿性溶质四氢嘧啶,在全细胞脂肪酶一次或重复使用中,均能显著改善油酸乙酯酯化率。和同质量的其他补偿性溶质比较,四氢嘧啶保护效果最好。理想的酶稳定性保护剂应具备无毒、自身稳定、用量小、保护作用强。四氢嘧啶作为脂肪酶在有机相稳定性保护剂,在上述性质方面优势明显。添加四氢嘧啶为提高酶法合成油酸乙酯的产率提供了一种新手段。
[1]Bloomer S,Adlercreutz P,Mattiasson B.Facile Synthesis of Fatty Acid Esters in High Yields[J].Enzyme Microb Technol, 1992,14(7):546-552.
[2]Kanasawud P,Phutrakul S,Bloomer S,et al.Triglyceride interesterification by lipases 3 Alcoholysis of pure triglycerides[J].Enzyme Microb Technol,1992,14(12):959-965.
[3]吴伟,刘一夫,何剑镔,等.固体超强酸S/TiO2催化合成亚油酸乙酯[J].精细化工,2005,22(1):23-25.
[4]韩庆玮,李会鹏,杨丽娜,等.含磺酸介孔分子筛SBA-15-SO3H催化合成油酸乙酯[J].工业催化,2006,14(3):36-38.
[5]Hazarika S,Goswami P,Dutta N N,et al.Ethyl oleate synthesis by Porcine pancreatic lipase in organic solvents[J]. Chem Eng J,2002,85(1):61-68.
[6]Foresti M L,Ferreira M L.Solvent-free ethyl oleate synthesis mediated by lipase from Candida antarctica B adsorbed on polypropylene powder[J].Catal Today,2005,107-108:23-30.
[7]Manjon A,Iborra J L,Arocas A.Short-chain flavour ester synthesis by immobilized lipase in organic media[J].Biotechnol Lett,1991,13(5):339-344.
[8]李伟杰,高静,姜艳军,等.AOT逆胶束体系脂肪酶催化合成油酸乙酯[J].过程工程学报,2008,8(6):1173-1178.
[9]Han D,Rhee J S.Biotechnology Letters Batchwise hydrolysis of olive oil by lipase in AOT-isooctane reverse micelles[J]. Biotechnol Lett,1985,7(9):651-656.
[10]Hoq M M,Yamane T,Shimizu S,et al.Continuous hydrolysis of olive oil by lipase in microporous hydrophobic membrane[J]. J Am Oil Chem Soc,1985,62:1016-1021.
[11]Lee Y K,Choo C L.The kinetics and mechanism of shear inactivation of lipase from Candida cylindracea[J].Biotechnol Bioeng,1989,33(2):183-190.
[12]Lippert K,Galinski E A.Enzyme stabilization be ectoinetype compatible solutes:protection against heating,freezing and drying[J].Appl Microbiol Biotechnol,1992,37(1):61-65.
[13]Costa M S,Santos H,Galinski E A.An overview of the role and diversity of compatible solutes in Bacteria and Archaea[J]. Adv Biochem Eng Biotechnol,1998,61:117-158.
[14]Schnoor M,Vo β P,Cullen P,et al.Characterization of the synthetic compatible solute homoectoine as a potent PCR enhancer[J].Biochem Biophys Res Commun,2004,322(3):867-872.
[15]Zhang L H,Wang Y,Zhang C Y,et al.Supplementation Effect of ectoine on Thermostability of Phytase[J].J Biosci Bioeng,2006,102(6):560-563.
[16]Nagata S,Maekawa Y,Ikeuchi T,et al.Effect of Compatible Solutes on the Respiratory Activity and Growth of Escherichia coli K-12 under NaCl Stress[J].J Biosci Bioeng,2002,94(5):384-389.
[17]Zhang L H,Lang Y J,Nagata S.Efficient production of ectoine using ectoine-excreting strain[J].Extremophiles,2009,13(4):717-724.
[18]金亮,徐岩,曹光群,华根霉全细胞脂肪酶催化合成油酸油醇酯[J].催化学报,2006,27(7):611-614.
[19]颜兴和,王栋,徐岩,华根霉脂肪酶有机相合成酶活的研究[J].工业微生物,2005,35(2):24-28.
[20]Al-Zuhair S,Ling F W,Jun L S.Proposed kinetic mechanism of the production of biodiesel from palm oil using lipase[J].Process Biochem,2007,42(6):951-960.
[21]Herskovits T T,Gadegbeku B,Jaillet H.On the Structural Stability and Solvent Denaturation of Proteins I.Denaturation By The Alcohols And Glycols[J].J Biol Chem,1970,245:2588-2598.
[22]Dossat V,Combes D,Marty A.Continuous enzymatic transesterification of high oleic sunflower oil in a packed bed reactor:influence of the glycerol production[J].Enzyme Microb Technol,1999,25(3-5):194-200.
Ectoine improving yield of ethyl oleate catalyzed by lipase
WANG Yue1,2,ZHANG Ling-hua1
(1.Environmental Science and Engineering College,Dalian Maritime University,Dalian 116026,China;2.College of Biotechnology,Dalian Polytechnic University,Dalian 116034,China)
To resist the competitive alcohol inhibition on lipase,improving the esterification degree of ethyl oleate by enzymatic synthesis,compatible solutes were added to the solvent-free synthesis system catalyzed by whole-cell lipase from Aspergillus oryzae DM-01.The results indicated that the addition of ectoine led to an increase in the synthesis of ethyl oleate.When 0.1g whole-cell lipase was added in the synthesis system,and the reaction was conducted for 48h,the esterification degree of ethyl oleate reached a maximum of 61.4%in the presence of 1.5mmol/L ectoine,an increase of 24.8%compared with that in the absence of ectoine.The esterification rate increased by 38.0%.Ectoine was added into synthesis systems for whole-cell lipase reuse during three recycling tests.Relative esterification degrees of ethyl oleate increased by 24.7%,33.3%and 166.8%compared with the control without ectoine.The supplementation of ectoine provided a new method for the purpose of improving yield of ethyl oleate catalyzed by enzyme.
ectoine;ethyl oleate;lipase;solvent-free system
TS201.2
A
1002-0306(2010)11-0224-04
2010-04-06
王越(1972-),女,讲师,博士研究生,研究方向:非水相酶制剂的应用。
