紫玉米与红玉米籽粒花色苷提取方法比较研究
2010-11-04崔丽娜董树亭高荣岐刘吉强
崔丽娜 董树亭 高荣岐 刘吉强
(山东农业大学农学院作物生物学国家重点实验室,泰安 271018)
紫玉米与红玉米籽粒花色苷提取方法比较研究
崔丽娜 董树亭 高荣岐 刘吉强
(山东农业大学农学院作物生物学国家重点实验室,泰安 271018)
以紫色玉米品种——紫糯香与红色玉米品种——西星赤糯一号玉米为原料,通过单因素试验,探索了甲醇提取玉米籽粒花色苷色素的条件:紫糯香玉米,材料为玉米籽粒鲜样,2%HCl甲醇,浸提次数 2次,提取时间为 1.5 h,提取温度 50℃;西星赤糯一号玉米,材料为玉米籽粒鲜样,4%HCl甲醇,浸提次数 3次,提取时间为 7 h,提取温度 60℃。
花色苷 盐酸甲醇 色素
近年来,由于随着人们回归自然的愿望越来越强烈,以及合成色素出现的一些类似致癌作用和其他的对人体的伤害作用(如可能导致生育力下降、畸胎、抵抗力下降、影响人的生长发育等)[1],人们对合成色素越来越排斥,对天然色素随之热衷起来。玉米色素因其具有多种功能,诸如具有保护视力、促进人体生长发育和提高抗病能力等,人们对玉米色素的研究、开发和应用也越来越多,越来越深入。对于玉米籽粒花色苷提取的研究主要在黑色玉米籽粒色素[2-5]及紫色玉米色素方面[6-7],而对于紫色玉米籽粒花色苷色素提取方法及红色玉米籽粒花色苷色素的提取方法研究很少,特别对红色玉米籽粒花色苷色素提取的具体方法未见报道。本试验研究红色玉米籽粒花色苷色素以及紫色玉米籽粒花色苷色素具体的提取方法,以为玉米籽粒花色苷色素的生产、应用提供依据。
1 材料与方法
1.1 材料与仪器
紫色玉米品种紫糯香 (Z)及红色玉米品种西星赤糯一号(C):山东农业大学试验基地。
UV-2450紫外分光光度计:岛津公司。
1.2 方法
本试验采用单因素试验,其他因素采用已知的最佳条件进行试验。从中选择最合适的提取条件。将浸提液混合,并定容至 2 5 mL,用紫外分光光度计确定其最大吸收波长,并在最大吸收波长下测其吸光度,用色素的吸光度作为色素溶液提取效率的标准。采用比吸光度法,食品添加剂标准委员会建议采用比吸光度(λ)表示色素含量。
E=A/m
式中:A为样品稀释到 100 mL时,用 1 cm比色皿测得最大波长下的吸光度值;m为样品质量/g。
由上式可以看出,当质量一定时,色素的比吸光度与色素的吸光度成正比。在本试验中,直接用样品稀释至 2 5 mL时的吸光度值除以质量来表示色素含量。结果仍然用吸光值 ( OD)来表示。并参考孙群等[8]、宋伟等[9]的试验进行试验设计。
2 结果与分析
2.1 鲜干样不同对浸提效果的影响
称取 3 g的鲜玉米 6份,3份经干燥处理,另 3份保存于 -20℃的冰箱中,将材料研磨成浆,加入浸提剂 1%HCl甲醇,在常温下(25℃)反复浸提 48 h,离心取上清,将浸提液混合,并定容至 25 mL,在紫外分光光度计下测其最大吸收峰并测其吸光度 (OD),将数据处理后,结果如图 1。从图 1中可以看出,鲜样比干样的色素含量大,可能是因为材料在干燥的过程中,使得色素部分分解。

图1 鲜干样对浸提效果的影响
2.2 不同浸提剂对浸提效果的影响
称取鲜玉米籽粒约 3 g,研磨成浆,加入不同浸提剂,分别为乙醇、甲醇、1%HCl、水、1%HCl乙醇、乙酸乙酯、1%HCl甲醇、1%HCl甲醇乙醇。在常温下(25℃)反复浸提 48 h,离心取上清,将浸提液混合,并定容至 25 mL,在紫外分光光度计下测其最大吸收峰并测其吸光值 (OD),将数据处理后,结果如图 2。从图 2中可以看出,1%HCL甲醇浸提效果最好。因此,选择 1%HCl甲醇作为浸提剂。因玉米籽粒中的花色苷类色素易溶于极性溶剂,极性越强,浸提效果越好。

图2 不同浸提剂对浸提效果的影响
2.3 不同 HCl甲醇比甲醇比对浸提效果的影响

图3 不同HCl甲醇比对浸提效果的影响
称取鲜玉米籽粒约 3 g,研磨成浆,加入不同比值 HCl甲醇溶液,在常温下 (25℃)反复浸提 48 h,离心取上清,将浸提液混合,并定容至 25 mL,在紫外分光光度计下测其最大吸收峰并测其吸光度 (OD),将数据处理后,结果如图 3。从图 3中可以看出,随 HCl甲醇比的升高,吸光度增加,紫糯香在 2%HCl甲醇处达到峰值,之后略有下降。而西星赤糯一号在 4%盐酸甲醇处达到最大值。说明花色苷类色素对盐酸浓度有一定限度的耐性,超过阈值,就会影响色素的结构。因而紫糯香与西星赤糯一号分别选择的HCl甲醇比为2%、4%。
2.4 浸提次数对浸提效果的影响
称取鲜玉米籽粒约 3 g,研磨成浆,加入 1%HCl甲醇溶液,在常温下 (25℃)浸提 48 h,浸提次数分别为 1次、2次、3次、4次、5次、6次,离心取上清,将浸提液混合,并定容至 25 mL在紫外分光光度计下测其最大吸收峰并测其吸光度 (OD),将数据处理后,结果如图 4。随浸提次数的增加,吸光度增加,但紫糯香从浸提 2次后,其吸光值的几乎不变,西星赤糯一号从浸提 3次以后,吸光度值不再变化,这说明浸提 2次以后,色素已几乎完全转移到浸提液中。因此,紫糯香与西星赤糯一号可以选择浸提次数分别为 2次、3次。
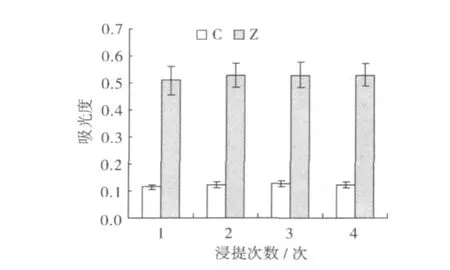
图4 浸提次数对浸提效果的影响
2.5 浸提温度对浸提效果的影响
称取鲜玉米籽粒约 3 g,研磨成浆,加入 1%HCl甲醇溶液,在不同的温度 (10、20、30、40、50、60℃)下,反复浸提 3 h,浸提 3次,离心取上清,将浸提液混合,并定容至 25 mL在紫外分光光度计下测其最大吸收峰并测其吸光度 (OD),将数据处理后,结果如图 5。随温度的升高,吸光度变大,被浸提出的色素越多。温度升高,溶液的渗透性增强,有利于色素的浸提。在 50℃时,紫糯香浸提液吸光度达到最大;西星赤糯一号在 60℃时达到最大值。说明对其温度的耐性有一定的阈值,到超过这个阈值时,色素的吸光度稍有下降,因温度升高加快了色素的分解,并接近于甲醇的沸点 64.7℃。因此,选择浸提温度为紫糯香 50℃、西星赤糯一号 60℃。
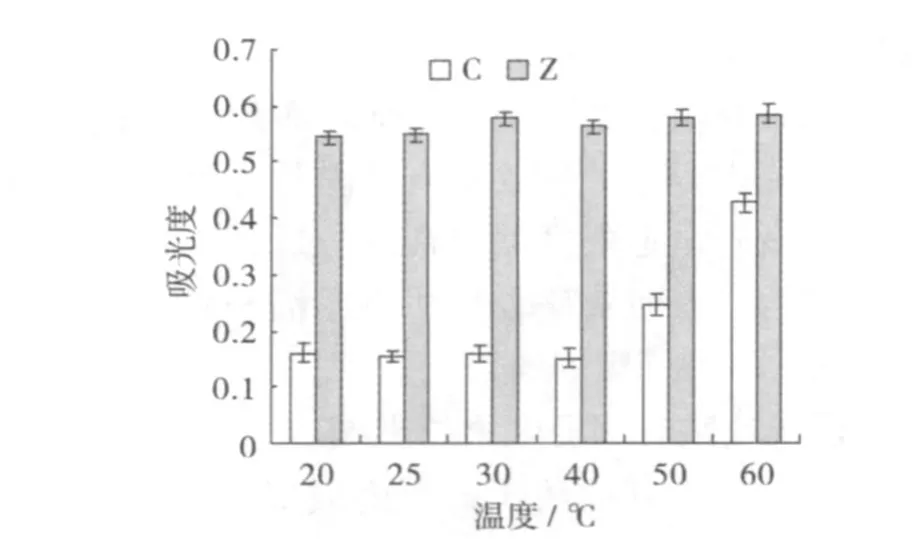
图5 温度对浸提效果的影响
2.6 浸提时间对浸提效果的影响
称取鲜玉米籽粒约 3 g,研磨成浆,加入 1%HCl甲醇溶液,在 50℃下浸提不同时间 (1.5、2.0、3.0、4.0、5.0、6.0、7.0、8.0 h),反复浸提 3次,离心取上清,将浸提液混合,并定容至 25 mL在紫外分光光度计下测其最大吸收峰并测其吸光度 (OD),将数据处理后,结果如图 6。随时间的延长,吸光度变大,色素浸出增加,当时间超过 2 h时,紫糯香浸提液吸光度只是略有增加。当时间为 7 h时,西星赤糯一号浸提液吸光度值达到最大值。因此,浸提时间紫糯香 1.5 h、西星赤糯一号 7 h。

图6 浸提时间对浸提效果的影响
3 讨论与结论
研究表明,对于玉米籽粒花色苷色素的浸提方法,离心比过滤效果更佳,特别是对于要保留残渣的试验,此种方法要优先考虑。鲜样中含有比晒干后样品中更多的色素,因此在工业生产中可以将干燥这一步骤省去,既省时又省能源。
紫糯香玉米,材料为玉米籽粒鲜样,2%HCl甲醇,浸提次数2次,提取时间为1.5 h,提取温度50℃;西星赤糯一号玉米,材料为玉米籽粒鲜样,4%HCl甲醇,浸提次数 3次,提取时间为 7 h,提取温度 60℃。
不同颜色玉米籽粒花色苷色素的具体组成不同,其具体提取方法也有差异。总体来讲西星赤糯一号籽粒色素比紫糯香玉米籽粒花色苷色素更不易被提取出来。即西星赤糯一号籽粒色素比紫糯香玉米籽粒色素的稳定性更强,西星赤糯一号籽粒色素可能是酰基化的二糖苷。花色苷类色素具有抗氧化、消除自由基,降低血清及肝脏中脂肪含量,抗变异、抗肿瘤及防止人体内过氧化的作用。有研究表明,紫玉米籽粒色素可预防肝脏的损伤以及防痴呆和防脑老化[10-11],对大鼠所作试验说明,紫玉米籽粒色素对PhIP(2-氨基 -1-甲基 -6-苯基-咪唑并[4-6]吡啶)诱发的大肠癌有明显的抑制作用[12]。并且紫玉米籽粒色素对高脂肪饮食有明显抑制体重增加和体内脂肪组织的积累的作用,而对正常的膳食无明显影响。并且可以保护 DNA免受氧化损伤[13]。花色苷类色素不仅是天然的食品着色剂,还被用来开发保健食品[14-15],具有广泛的应用和经济前景。
[1]Julie Miller Jones.Food Safety[M].USA:Eagan press, 1992:4-5
[2]王新广,罗先群,云芸.海南黑糯玉米色素的提取及其稳定性的研究[J].中国食品添加剂,2003,5:19-21,49
[3]田春莲,陈建华,李立君,等.黑玉米色素的提取工艺及特性研究[J].中国林副特产,2003,3:30-31
[4]鲁京兰,申凤善,太俊哲.黑玉米中黑色素的提取[J].延边大学农学学报,2002,24(2):96-98
[5]张钟,宫坤,陈守江.黑糯玉米芯色素的提取及性质研究[J].中国粮油学报,2004,2(19):62-63
[6]王晓红,周波.玉米紫色植株色素理化性质研究[J].中国食品添加剂,2007,2(2):54-56
[7]陈丙堂,李全阳,刘保申.紫玉米植株色素提取工艺及理化性质研究[J].中国粮油学报,2009,24(1):112-117
[8]孙群,孙宝启.黑粒小麦籽粒发育过程中籽粒色素含量动态变化[J].中国农业学,2001,34(4):461-464
[9]宋伟,孙兰珍,类承斌,等.有色小麦籽粒发育过程中籽粒色素含量动态变化 [J].麦类作物学报,2004,24(2): 103-105
[10]Osawa T.Functional activity of polyphenols including antho2 cynins[J].Foods and Food,2001,192:4-10
[11]Osawal T.Protective effects of dietary cyanidin-3-O-β -D-glucoside on liver ischemia-reperfusion injury in rats [J].Arch.Biochem Biohyps,1999,368:361-366
[12]凌关庭.可供开发食品添加剂 (Ⅰ):紫玉米色素及其生理功能[J].粮食与油脂,2002,10:46-49
[13]Sarma A D,Sharma R.Anthocyanin DNA copigmentationcomplex:mutual protection against oxidative damage[J]. Phytochemistry,1999,52:1313-1318
[14]刁晓华 ,高亦珂.玉蝉花生物学研究[J].山东农业科学, 2006,5:33-34
[15]李永洪,谢戎,李乾平,等.糯玉米鲜穗产量与穗部性状灰色关联度分析[J].山东农业科学,2007,1:8-11.
Comparison Study of Extraction Conditions of Anthocyanin from PurpleMaize and RedMaize
CuiLina Dong Shuting Gao Rongqi Liu Jiqiang
(Agronomy College of Shandong AgriculturalUniversity,State KeyLab.of Crop Biolog,Tai′an 271018)
The conditions of extracting pigment from purple(Zinuoxiang)and red maize(XixingchinuoNO.1) with methanolwere optimized with single factor experi ments.The optimum extraction conditions are as follows:For Zinuoxiang,using fresh sample,2%HClmethanol,extraction times2,extraction time 1.5 h,extraction temperature 50℃;for XixingchinuoNO.1,using fresh grain sample,4%HClmethanol,extraction ti mes 3,extraction ti me 7 h, and extraction temperature 60℃.
anthocyanin,HClmethanol,pigment
S38 文献标识码:A 文章编号:1003-0174(2010)10-0028-04
国家科技支撑计划(2006BADO2A09),农业成果转化项目(2006cb0058),山东省良种工程(2006.90,2007.7)
2009-10-23
崔丽娜,女,1981年出生,博士,种子生物学及玉米高产研究
董树亭,男,1953年出生,教授,作物研究
