莱菔多糖分离纯化及相对分子质量初探
2010-11-02任惠峰
李 健,李 敏,刘 宁,任惠峰
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 2.东京海洋大学,东京 108-8477)
莱菔多糖分离纯化及相对分子质量初探
李 健1,李 敏1,刘 宁1,任惠峰2
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 2.东京海洋大学,东京 108-8477)
采用超声辅助提取莱菔粗多糖 (RP),经 Sevag法脱除蛋白,苯酚-硫酸法测定其多糖含量。葡聚糖凝胶Sephedex G-100进一步分离纯化,得到酸性多糖 RP1和 RP2。采用高效凝胶渗透色谱 (HPGPC)对纯化后的两组分分别进行分析。实验结果表明:多糖含量为 49.1%,RP1、RP2保留时间几乎相同,计算得平均相对分子质量分别为2.9741×104Da和 3.1038×104Da。
莱菔多糖,分离,纯化,平均相对分子质量
莱菔始载于《唐本草》,植物基源于十字花科莱菔属 (Raphanus L.)植物莱菔 (Raphanus sativus L.)。我国是中药的起源之地,而糖类是中药材中普遍存在的成分,因此对植物多糖的研究已成为医药界的热门领域。莱菔作为祖国传统资源及药食同源物质,具有诸多保健功能,其中部分功能与其多糖组分有关[1]。因此,研究莱菔多糖的分离纯化及相对分子质量等特性,为深入研究和利用莱菔这种我国传统药用植物资源提供一定的科学理论依据,并对新型功能保健食品的开发和预防、治疗疾病均有重要的现实意义。
1 材料与方法
1.1 材料与仪器
新鲜莱菔 市售;无水乙醇、石油醚、苯酚、浓硫酸、EDTA、NaHCO3、氯仿、正丁醇、乙醚、丙酮 国产分析纯;标准葡聚糖 (Dextran)系列 色谱级,美国Sigma公司;葡聚糖凝胶 Sephadex G-100,透析袋(MD25:8000~14000)。
数控超声波清洗器 (KQ3200DE) 昆山市超声仪器有限公司;数控恒温水浴锅(W205B)、旋转蒸发器(R-205) 上海申胜生物技术有限公司;万能粉碎机 中国天津泰斯特仪器有限公司;真空干燥箱(DZF-6030A) 上海一恒科学仪器有限公司;双光束紫外可见分光光度计 (T U-1901) 北京普析通用仪器有限责任公司;层析柱 (1.6×50cm) 上海锦华层析设备厂;组合式紫外检测仪 (HDL) 上海金达生化仪器有限公司;自动部分收集器 (BSZ-100)上海沪西分析仪器厂有限公司;高效液相色谱(Agilent 1200) 安捷伦公司。
1.2 实验方法
1.2.1 莱菔多糖的提取 取市售新鲜莱菔,去表皮污泥、杂质后切薄片,于 60℃干燥箱中烘干,粉碎,过40目标准筛,取筛下部分进行石油醚浸提脱脂及色素,过夜。真空抽滤,取滤渣超声辅助提取,真空过滤。滤液减压浓缩,上清液浓缩为原体积的 1/4~1/5后,加 5倍于其体积的 95%乙醇沉淀多糖。醇沉液体静置过夜,3000r/min离心 10min,取残渣真空干燥,即得莱菔粗多糖粉末。
1.2.2 莱菔多糖的分离纯化
1.2.2.1 脱蛋白 采用经典 Sevag法脱除蛋白。移取氯仿 40mL,正丁醇 10mL,按照氯仿∶正丁醇 =4∶1的比例配成二元有机溶剂体系。取适量莱菔粗多糖粉末,复溶,按多糖∶有机溶剂 =5∶1的比例添加有机溶剂体系,充分振摇,并于 4000r/min离心 10min,将离心液转移入梨形漏斗,静置。溶剂分 3层,上层为多糖水相,下层为有机溶剂层,中间为变性蛋白层。弃下层有机溶剂层和变性蛋白层,留上层清液,重复添加有机溶剂,直至水层与有机溶剂层中间无变性蛋白为止。
合并多次脱蛋白液,减压浓缩,醇沉过夜,离心,沉淀分别用无水乙醇、丙酮、乙醚洗涤,通风橱内进行,少时得疏松、微黄脱蛋白莱菔多糖。
1.2.2.2 柱层析 Sephadex G-100 将上述一定量的莱菔多糖溶解并定容至刻度,制得 10mg/mL莱菔多糖样品溶液。取适量葡聚糖凝胶 G-100,常温下浸泡过夜使之充分溶胀,使用前真空抽滤脱气。将处理好的葡聚糖凝胶装柱 (1.6×50cm),洗脱液平衡一夜,上样 10mg/mL的莱菔多糖溶液 1mL,然后用0.1mol/L的NaCl溶液洗脱,每 15min收集一管,每管收集 2mL。苯酚-硫酸法跟踪检测多糖洗脱情况,绘制洗脱峰。紫外检测仪跟踪检测有无蛋白吸收。按峰收集洗脱液,浓缩得精制莱菔多糖。
1.2.2.3 透析 透析袋的预处理:将透析袋剪成适当长度(10~20cm)的小段,后用2%(W/V)碳酸氢钠和1mmol/L EDTA(pH8.0)将透析袋煮沸 10min,蒸馏水清洗后再用 1mmol/L EDTA(pH8.0)煮沸 10min,冷却后,加上封盖 4℃存放待用。透析:将 1.2.2.2过程中所得到的多糖浓缩液分别装入透析袋内,放入大烧杯中,流水透析 48h,后用蒸馏水透析 24h[2]。透析过程中,用磁力搅拌器使水流动,并每隔 3~5h换一次水,以除去多糖溶液中的无机盐等小分子化合物。透析液真空冷冻干燥,得莱菔多糖纯品。
1.2.3 多糖含量的测定[3]
1.2.3.1 葡萄糖标准溶液的制备 精密称取 105℃干燥至恒重的葡萄糖标准品 0.5g,溶解并置于 50mL容量瓶中定容至刻度,配成 10mg/mL的标准储备液。吸上述贮备液1mL定容至100mL,配成0.1mg/mL的标准工作液。测定时吸取 4mL上述标准工作用液定容至 10mL,得 0.04mg/mL的测定用液。
1.2.3.2 最大吸收波长的测定 取适量配制好的葡萄糖标准溶液和样品溶液,按糖含量标准测定方法测定,以苯酚硫酸为空白,分别在 400~600nm下扫描葡萄糖标准品和样品显色溶液,以检测最大吸收波长。
1.2.3.3 标准曲线的绘制 精密移取葡萄糖标准测定用液 0、0.2、0.4、0.6、1.0、1.6mL于 25mL刻度试管中,加蒸馏水定容至 2.0mL,再各加 5%苯酚溶液(取分析纯苯酚加沸石少许,加 0.05g碳酸氢钠,收集182℃的馏分,取 5g定容至 100mL即得)1.0mL,摇匀,迅速加入浓 H2SO4溶液 5mL。振摇 5min,置沸水浴中加热 15min,取出冷却 30min,于 490nm以试剂空白为参比测定吸光度。
1.2.3.4 样品的测定 精密称取脱蛋白粗糖样品0.05g置于 50mL容量瓶中,溶解并稀释至刻度,配成1mg/mL的标准储备液,吸取 4mL上述储备液定容于10mL容量瓶中,得 0.4mg/mL的待测用液。吸取1mL,加水定容至 2mL,之后按标准曲线测定方法测定,平行实验 3次。
1.2.4 莱菔多糖相对分子质量的测定
1.2.4.1 多糖样品的预处理 分别收集 2个主峰波峰位置试管内溶液,合并多次洗脱液,经浓缩、透析后,微孔滤膜(0.45μm)过滤后直接进行液相分析。
1.2.4.2 液相色谱分析 (HPLC)条件 液相色谱仪: Agilent 1200;色谱柱:GPC柱;检测器:示差折光检测器(35℃);流动相:去离子水;流量:1.0mL/min;柱温:25℃;进样量:10μL。
1.2.4.3 莱菔多糖相对分子质量的计算 不同分子质量的标准葡聚糖用流动相溶解并配制成 10mg/mL标准样品,微孔过滤后进样,进样量为10μL。参考文献[4]测定方法,根据不同标准多糖的保留时间及其相对分子质量对数作标准曲线,多糖的相对分子质量由标准工作曲线计算得到。
1.2.5 多糖理化性质测定
1.2.5.1 溶解性 取适量脱蛋白莱菔多糖样品,将其置于不同的溶剂中以检测其溶解性。
1.2.5.2 淀粉定性测定[5]采用碘-碘化钾法。
2 结果与讨论
2.1 脱蛋白结果分析
由图 1所示,经 Sevag法脱除蛋白后的莱菔多糖在 260~280nm无明显紫外吸收,说明脱蛋白后的莱菔多糖不含蛋白、核酸等大分子物质,与在线蛋白检测结果一致,Sevag法对莱菔多糖中蛋白脱除效果较好。实验还研究了不同脱蛋白次数 (3~11次)对莱菔多糖中蛋白脱除的影响,实验结果表明,莱菔多糖中蛋白含量较少,莱菔多糖粗品经紫外扫描后也没有明显的蛋白吸收峰,扫描图谱见图 2。说明粗糖干基中蛋白含量较少。故在保证实验结果的基础上,综合实验条件以及试剂的节约等各方面考虑,选取脱除蛋白 5次为宜。

图 1 莱菔多糖脱蛋白样品紫外光谱图
2.2 莱菔多糖的 Sephadex G-100柱层析
按 1.2.2.2实验方法取 10mg/mL莱菔多糖 1mL上样,控制流速为 0.133mL/min,收集时间为 15min,每管收集 2mL多糖,洗脱曲线如图 3所示。
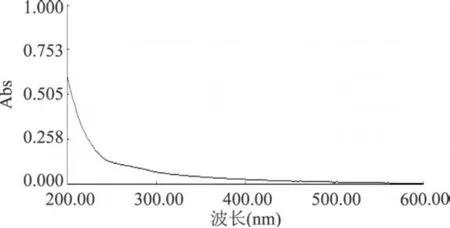
图 2 莱菔多糖未脱蛋白样品紫外光谱图
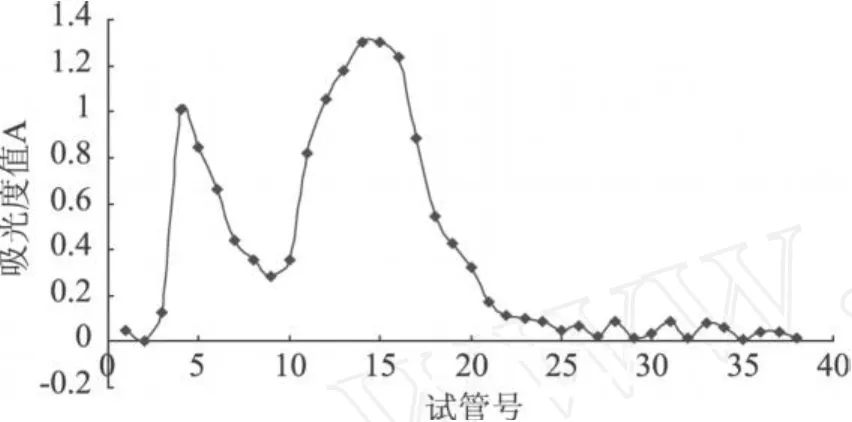
图 3 莱菔多糖的葡聚糖凝胶 Sephadex G-100洗脱曲线
实验考察了不同收集时间对莱菔多糖的分离效果,当每管收集时间为 20min时,多糖洗脱曲线出峰较多,峰形较乱,且其吸光光度值较接近,考虑由于收集时间太长导致不同多糖组分混合,而使分离效果不好,故相应缩短每管收集时间。由图 3多糖洗脱曲线可以看出,当每管收集时间为 15min时,多糖在该条件下洗脱出峰形较好的 2个峰,且其为正好完全分开,说明达到了分离多糖的效果,以每一单一洗脱峰为组分,分别收集管 3~8和管 10~24,且将其分别命名为 RP1和 RP2。继续缩短收集时间,当每管收集时间为 10m in时,同一组分多糖峰分离开来,峰形较散,说明相同组分在较短时间内没有收集完全。
综合上述洗脱曲线实验统计结果,确定每管收集时间选择为 15min。并在此相同条件下进行重复收集实验,以考察方法的重现性。按以上方法按峰收集洗脱液,并分别放置于冰箱内保存。
2.3 莱菔多糖的含量
2.3.1 最大吸收波长的测定 由图 4和图 5比较可知,葡萄糖标准品按苯酚--硫酸法显色后测定其最大吸收波长为491nm,同法检测莱菔多糖样品最大吸收峰为 490nm,考虑实验的方便及方法的准确性,并综合其他参考文献[6-8],最终确定 490nm为实验用测定波长。
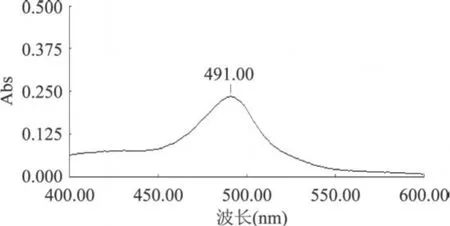
图 4 葡萄糖标准溶液紫外光谱图

图 5 莱菔多糖样品溶液紫外光谱图
2.3.2 葡萄糖含量标准曲线 由图 6得到以葡萄糖浓度 C为横坐标,吸光光度值A为纵坐标的标准曲线回归方程为A=0.0396C+0.0195,R2=0.9923,将 3次平行测定样品吸光光度值分别带入上述回归方程,得相应的不同标准葡萄糖浓度,按多糖含量计算公式计算,取其平均值得脱蛋白多糖含量为 49.1%。

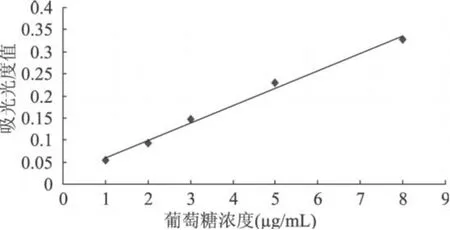
图 6 莱菔多糖含量的葡萄糖标准曲线
2.3.3 多糖相对分子质量的测定
2.3.3.1 标准曲线 见图 7。
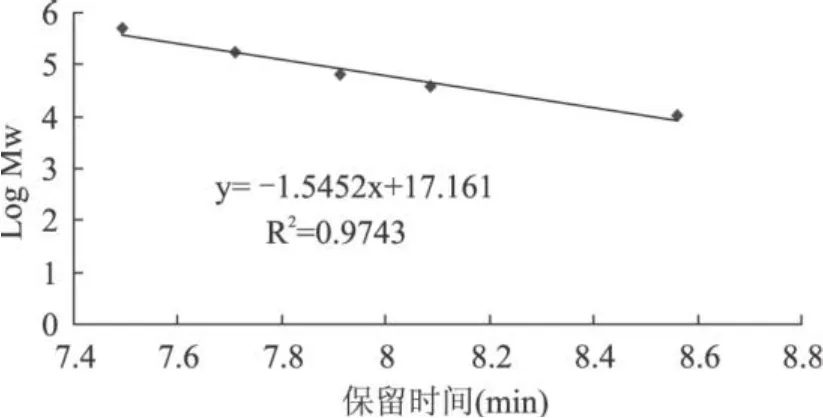
图 7 相对分子质量对数与保留时间曲线
2.3.3.2 样品 HPGPC色谱图 实验考察了不同进样量对标准品及样品保留时间的影响,结果表明,同一样品进样量与保留时间成一定的量效关系,即进样量越大,样品的保留时间则较长。所以,为保证实验的灵敏度及检测的准确性,在保证正确分析的基础上应该尽量减少进样量,故实验中所采用的标准品及样品进样量皆为 10μL。
根据图8,RP1和 RP2的保留时间分别为8.211min和 8.199min,说明二者可能为同一物质,或是同分异构体,这些还需对 RP1和 RP2的结构做进一步的分析,拟在以后的实验中,通过气相色谱、红外光谱、核磁共振光谱、电镜以及动物实验等各种方法对莱菔多糖的结构、生理活性等其他性质做进一步细致和详尽的分析,以期为莱菔多糖的结构等方面研究掌握更加全面的理论数据,相信会对莱菔的开发和研究奠定坚实的理论和实践基础,这些将在后续的实验中加以完整。实验通过标准曲线计算得二者平均相对分子质量分别为 2.9741×104Da和3.1038×104Da。

图 8 RP1、RP2高效凝胶渗透色谱洗脱曲线
2.3.4 莱菔多糖定性 莱菔多糖纯品呈白色粉末状,不易溶于冷水,易溶于热水。不溶于无水乙醇、氯仿、正丁醇、丙酮、乙醚等有机溶剂。苯酚--硫酸法反应呈橘红色溶液,说明其含有糖。但由于五碳糖类以及它们的双糖类均能被硫酸分解成糖醛,六碳糖类以及它们的双糖类也同样地被分解成羟甲基糖醛,这些糖醛类化合物均与苯酚作用产生橘红色缩合产物[5],所以不能说明其为五碳糖还是六碳糖,这些将在后续实验中通过硫酸-咔唑法进行鉴定。通过紫外光谱扫描结果说明,莱菔多糖不含蛋白质、核酸等大分子物质。
3 结论
本实验研究立足于传统水提醇沉的基础,采用超声辅助提取莱菔多糖,Sevag法脱除蛋白后,经葡聚糖凝胶 Sephadex G-100洗脱得到两个主要吸收峰,并分别命名为 RP1和 RP2。二者经减压浓缩、透析、过膜后上葡聚糖凝胶渗透色谱,二者保留时间几近相同,说明二者结构可能相似,但并不能得到确定的结论,还需要辅以其他色谱等结构测定方法加以说明,这些将会成为日后的主要研究内容。多糖定性实验结果表明,莱菔多糖纯品为白色粉末,不溶于冷水、有机溶剂,易溶于热水,不含蛋白质、核酸、淀粉类物质。目前国内外关于莱菔多糖的研究报道甚少[1,9],所以本实验的进行对开发我国传统药食两用植物资源具有重要的现实意义。从莱菔多糖的提取到莱菔多糖的分离纯化均为后续的实验研究掌握了第一手理论资料。对其结构、生物活性等方面的研究将在日后加以补充和完善。
[1]杨萌,熊峰梅,于化泓 .莱菔子多糖的提取及分离纯化研究现状[J].江西食品科技,2007(2):48-50.
[2]朱晓霞,罗学刚 .多糖提取与纯化技术应用进展[J].食品研究与开发,2007,28(3):186-189.
[3]王文平,郭祀远,李琳,等 .苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279.
[4]李健,刘宁,陈平,等 .香菇多糖分子质量的测定方法研究[J].哈尔滨商业大学学报,2005,21(5):644-648.
[5]刘春兰,邓义红,杜宁,等 .新疆雪莲水溶性多糖的分离纯化及组成分析 [J].天然产物研究与开发,2009,(20)21: 99-103.
[6]何新益,刘仲华 .苦瓜多糖的改良苯酚-硫酸法测定和提取工艺[J].食品与机械,2007,23(4):72-75.
[7]黎晶晶,徐格非 .苯酚-硫酸法测定灵芝多糖含量的研究[J].杭州化工,2008,38(1):23-26.
[8]钟岩,潘浦群,王艳红,等 .苯酚-硫酸法测定鲜人参中多糖含量[J].时珍国医国药,2008,19(8):1957-1958.
[9]刘剑利,曹向宇 .萝卜水溶性多糖的提取工艺研究[J].辽宁大学学报,2009,36(1).82-84.
Study on isolation purification and relative molecular mass of radish polysaccharids
L I Jian1,L IM in1,L IU Ning1,REN Hui-feng2
(1.Institute of Food Engineering,Harbin University of Commerce,Harbin 150076,China; 2.Ocean University of Tokyo,Tokyo 108-8477,Japan)
Us ing ultrasound-ass is ted extrac tion rad ish p olysaccha ride(RP),rem oving of p rote in by Sevag m e thod, p henol-sulfuric ac id m e thod for the de te rm ina tion of the p olysaccha ride content.By Sep hedex G-100for furthe r sep a ra tion and p urifica tion
ac id p olysaccha ridesRP1and RP2.High Pe rform anceGe l Pe rm ea tion Chrom a tog rap hy(HPGPC)ana lyzed comp onent RP1,RP2afte r p urified,resp ec tive ly.The result showed the re tention t im e we re a lm os t sam e of RP1and RP2.Ca lcula ted the ave rage re la tive m olecula r m ass was2.9741× 104Da and3.1038×104Da,resp ec tive ly.
rad ish p olysaccha rides;isola tion;p urifica tion;ave rage re la tive m olecula rm ass
TS201.2
A
1002-0306(2010)01-0151-04
2009-10-26
李健(1956-),男,教授,硕士生导师,研究方向:食品化学。
