基于螯合机理的桑叶提取物抗氧化活性研究
2010-11-02邹碧群杨新平义祥辉
邹碧群,张 业,王 凯,杨新平,义祥辉,*
(1.桂林师范高等专科学校化学与工程技术系,广西桂林 541001; 2.广西师范大学化学化工学院,广西桂林 541004; 3.桂林医学院药学院,广西桂林 541004)
基于螯合机理的桑叶提取物抗氧化活性研究
邹碧群1,2,张 业1,王 凯2,杨新平3,义祥辉1,2,*
(1.桂林师范高等专科学校化学与工程技术系,广西桂林 541001; 2.广西师范大学化学化工学院,广西桂林 541004; 3.桂林医学院药学院,广西桂林 541004)
用超声波提取法以及大孔树脂对桑叶进行初步提取,得到三个提取物 (Ⅰ、Ⅱ、Ⅲ)。在对三个提取物进行DPPH自由基清除能力研究的基础上,利用紫外吸收光谱法研究了桑叶提取物与 Fe2+、Fe3+的螯合作用。结果表明,三个桑叶提取物皆对DPPH自由基具有良好的清除效果,提取物Ⅰ、Ⅱ对 Fe2+、Fe3+具有良好的螯合作用,提取物Ⅲ仅对 Fe3+表现出良好的螯合作用。
桑叶,抗氧化,螯合
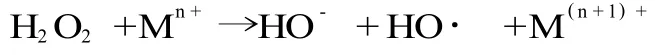
因此,研究与开发既具有清除自由基能力,又能够通过螯合过渡金属阳离子来阻止人体 Fenton反应发生的抗氧化剂,已经成为了抗氧化剂新的研究热点之一[4-5]。桑叶始载于《神农本草经》,为桑科落叶乔木桑树 (M orus alba L.)的叶,味苦、性寒,有散风祛热、清肝明目等功效,且含黄酮类化合物,约占 1%~3%[6-7]。而黄酮类化合物正是一类天然抗氧化剂,可以减少和清除自由基,具有延缓人体衰老、防治疾病的作用[8],更重要的是部分黄酮类化合物还具有与金属离子螯合的能力,抑制人体 Fenton反应[4]。基于上述背景,本文在利用DPPH法对桑叶三个提取物自由基清除能力进行研究的基础上,对其与铁离子以及亚铁离子的螯合性能进行了研究,旨在为进一步研究桑叶的抗氧化活性奠定基础。
1 材料与方法
1.1 材料与仪器
桑叶 采自桂林师范高等专科学校生物园,自然干燥,粉碎过筛;大孔吸附树脂 天津市津科细化工研究所生产;其他试剂 均为分析纯。
JBT/FCT型釜罐式超声波提取设备,KQ5200-B型超声波清洗机,RE501型旋转蒸发仪,SHB-Ⅲ循环水式真空泵,TU-1901双光束紫外可见分光度计, DJ灵巧型粉碎机。
1.2 实验方法
1.2.1 桑叶不同提取物的制备 称 50.0g粉碎的桑叶于 600mL蒸馏水中,85℃恒温,置于超声波提取设备中提取 1h,重复三次,抽滤。减压浓缩滤液得5.21g膏状提取物 Ⅰ,收率 10.42%。把浸膏 Ⅰ以1mL/min的速度过大孔树脂柱,水洗至无色,浓缩得1.35g提取物Ⅱ,收率 2.7%。继续用 80%乙醇洗脱大孔树脂吸附物至完全,浓缩得 2.48g棕黑色微晶提取物Ⅲ,收率 4.97%。
1.2.2 抗氧化活性的测定 采用DPPH法,桑叶提取物对 DPPH自由基的清除作用的测定见参考文献[9]。将各提取物浸膏配制成系列溶液,测定待测桑叶提取液对DPPH自由基清除率,并绘制DPPH自由基清除率对桑叶提取液浓度曲线式 (1),并以此计算 I C50值。

式中:A0与At分别代表自由基在 517nm时空白与样品对其作用后的吸光度。
1.2.3 螯合作用的测定 室温下,将Ⅰ、Ⅱ、Ⅲ分别配成 1mg/mL的水溶液,进行紫外光谱扫描。然后,把铁离子、亚铁离子分别配制成不同浓度的溶液。分别移取各离子不同浓度的溶液 0.1mL,加入到3.9mL提取物水溶液中,混合振荡,30min后扫描紫外光谱,由紫外光谱的变化探讨桑叶提取物与铁离子、亚铁离子的螯合情况。
2 结果与讨论
2.1 桑叶提取物对DPPH自由基的清除作用
I C50常用来比较清除 DPPH自由基的能力大小, I C50值越低,表明其清除自由基的能力越强,抗氧化能力越强。结果表明,桑叶提取物Ⅰ、Ⅱ、Ⅲ的 I C50分别为 2.78、0.38、0.48mg/mL,这说明了桑叶提取物对DPPH自由基有良好的清除作用。
2.2 桑叶提取物的紫外吸收光谱
由图 1可以看出,提取物Ⅰ有λ1=216.0nm,λ2= 271.0nm这两个紫外吸收峰,最大吸收波长、最大吸收值和质量吸收系数分别为λmax=216.0nm,Amax= 7.6,ε=76L·g-1·cm-1;提取物Ⅱ有一个吸收峰,吸收波长、吸收值和质量吸收系数分别为 λmax= 206.0nm,Amax=4.3,ε=43L·g-1·cm-1;提取物Ⅲ有三个吸收峰,分别为λ1=214.0nm,λ2=272.0nm,λ3= 319.0nm,其中最大吸收波长、最大吸收值和质量吸收系数分别为λmax=214.0nm,Amax=5.7,ε=57L·g-1·cm-1。每个提取物的最大吸收峰的位置与黄酮类化合物的吸收值基本一致,说明了桑叶提取物的主要成分是黄酮类化合物[10]。
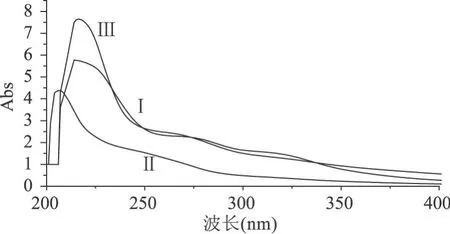
图1 Ⅰ、Ⅱ、Ⅲ的紫外吸收谱
2.3 桑叶提取物与 Fe2+、Fe3+的螯合作用
抗氧化剂与 Fe2+、Fe3+的螯合作用很复杂,目前一般可以通过紫外光谱法和荧光光谱法等来进行表征[4]。本文中,我们采用紫外光谱法。提取物Ⅰ、Ⅱ、Ⅲ对不同浓度 Fe2+和 Fe3+螯合结果见图 2~图 4。由图 2可见,提取物Ⅰ随着 Fe2+浓度的增加,最大吸收峰发生红移,吸收度也逐渐增加;同时,随着 Fe3+浓度的增加,其最大吸收波长发生大范围红移。
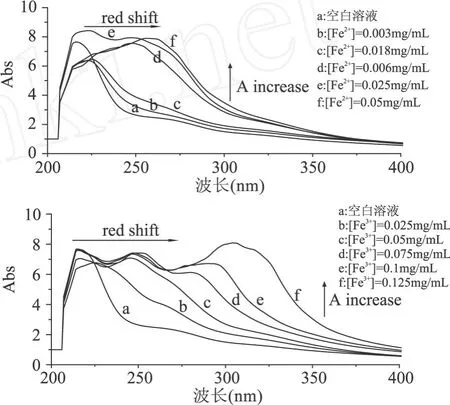
图 2 提取物Ⅰ对 Fe2+、Fe3+的螯合光谱
由图 3可见,提取物Ⅱ的吸收峰随着 Fe2+、Fe3+浓度的增加而发生红移现象,吸收度也相应地增大,并且产生新的吸收峰。
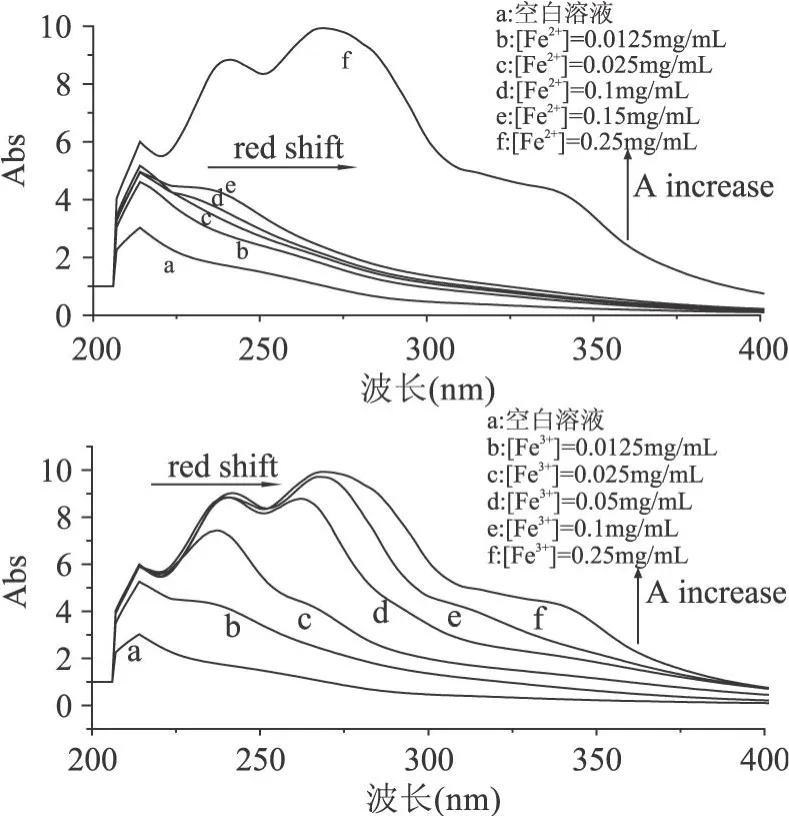
图 3 提取物Ⅱ对 Fe2+、Fe3+的螯合光谱
由实验发现,提取物Ⅲ仅与 Fe3+发生螯合作用(图 4),其吸收峰随着 Fe3+浓度的增加而发生相应的红移,且吸收度逐渐增大。
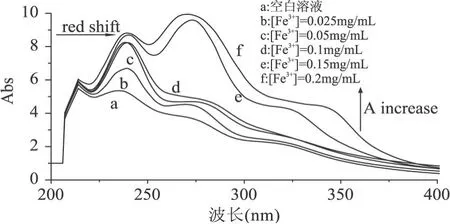
图 4 提取物Ⅲ对 Fe3+的螯合光谱
总之,随着 Fe2+、Fe3+浓度的增加,提取物的紫外特征吸收峰发生了红移现象,吸收度逐渐增大,说明桑叶提取物与 Fe2+、Fe3+发生了螯合,生成了新的物质。由此可见,桑叶提取物是良好的螯合剂,可螯合Fe2+或 Fe3+,防止其参与 Fenton反应,能够间接降低了羟自由基和氧自由基的产生。
3 结论
实验结果表明,桑叶提取物对 DPPH自由基有良好的清除作用,是一种良好的自由基清除剂;同时,桑叶提取物Ⅰ、Ⅱ对 Fe2+或 Fe3+具有很好的螯合作用,能间接降低了羟基自由基和氧自由基的产生,是良好的螯合剂,以上研究对桑叶进行基于抗氧化活性的进一步筛选具有重要的指导意义。
[1]赵保路 .氧自由基和天然抗氧化剂[M].北京:科学出版社,1999:53-382.
[2]陈瑗,周玫 .自由基医学 [M].北京:人民军医出版社, 1991:5-7.
[3]Neyens E,Baeyens J.A review of classicFenton’s peroxidation as an advanced oxidation technique[J].Hazard Mater,2003,98:33-50.
[4]LeopoldiniM,Russo N,Chiodo S,et al.Iron Chelation by the Powerful Antioxidant Flavonoid Quercetin[J].J Agric Food Chem,2006,54:6343-6351.
[5]Bermejo P,Piñero E,VillarÁM.Iron-chelating ability and antioxidant properties of phycocyanin isolated from a protean extract of Spirulina platensis[J].Food Chem,2008,110:436-445.
[6]张雁冰,王克让,刘宏民,等 .桑叶中黄酮类化合物的分离提取及结构鉴定[J].中草药,2006,37(3):341-343.
[7]孙敏耀,唐照文,卢霞,等 .分光光度法测定不同采收时间桑叶总黄酮[J].中草药,2004,35(10):1190-1191.
[8]方允中,郑荣梁 .自由基生物学的理论与应用[M].北京:科学出版社,2002:592-620.
[9]Pan YM,Zhu J C,Wang H S,et al.Antioxidant activity of ethanolic extract of Cortex fraxini and use in peanut oil[J].Food Chem,2007,103:913-918.
[10]赵丽君,齐凤兰,瞿晓华,等 .桑叶的营养保健作用及综合利用[J].中国食物与营养,2004(2):22-25.
Study on antioxidant activity of extracts of M orus alba L.leaves based on chelation mechanism
ZOU Bi-qun1,2,ZHANG Ye1,WANG Ka i2,YANG Xin-ping3,Y I X iang-hui1,2,*
(1.Depar tment of Chemistry and Engineering Technology,Guilin Normal College,Guilin 541001,China; 2.School of Chemistry and Chemical Engineering,GuangxiNormalUniversity,Guilin 541004,China; 3.College of Phar macy,GuilinMedical College,Guilin 541004,China)
Leaves of M orusa lba L.was extrac ted w ith ultrasonic wave,then was dea led w ith m ac rop orous adsorp tion res in to ge t three extrac tⅠ,Ⅱ andⅢ.Based on the s tudy of scaveng ing ac tivities ofⅠ,Ⅱ andⅢaga ins tDPPH free rad ica l,UV-vis sp ec troscop y was emp loyed to s tudy the ir che la tion ab ilities w ith fe rrous and iron ion.The results showed tha t a ll extrac ts exhib ited good scaveng ing ac tivities on DPPH free rad ica l.Extrac tⅠandⅡshowed favorab le che la tion ab ilities w ith both of fe rrous and iron ion,while extrac tⅢ dem ons tra ted only good che la tion ab ility w ith iron ion.
M orus a lba L.;antioxidant;che la tion
TS201.2
A
1002-0306(2010)02-0065-03
自由基 (free radical)通常指独立存在的带有未成对电子的原子或原子基团、分子或离子,如 O-2·、HO·、Ar O·等。人体生命活动进程中,自由基发挥着重要的作用。正常情况下,人体内自由基的产生和清除是平衡的,一旦自由基产生过多或抗氧化体系出现故障,体内自由基代谢就会出现失衡,可引起蛋白质、核酸 (DNA)变性,导致细胞和组织器官损伤,诱发各种疾病,加速机体衰老[1]。过渡金属阳离子是自由基生成强有力的催化剂,它们可参与人体中的 Fenton反应[2],将超氧化物转变为极其活跃的羟自由基和氧自由基[3]:
2009-03-18 *通讯联系人
邹碧群 (1982-),女,硕士生,从事药物合成和天然产物的研究与开发工作。
国家自然科学基金(20762001);广西科技开发计划(桂科能05112001-3B2);广西区教育厅科研项目 (200507067、200807MS076、200807MS075)。
