白介素18髓核内注射对兔椎间盘作用的实验研究
2010-10-28陈操秦超刘维钢王维山董金波史晨辉
陈操,秦超,刘维钢,王维山,董金波,史晨辉
(1石河子大学医学院第一附属医院,石河子832002;
2石河子大学医学院第二附属医院(新疆兵团医院),乌鲁木齐810000)
白介素18髓核内注射对兔椎间盘作用的实验研究
陈操1,秦超1,刘维钢2,王维山1,董金波1,史晨辉1
(1石河子大学医学院第一附属医院,石河子832002;
2石河子大学医学院第二附属医院(新疆兵团医院),乌鲁木齐810000)
为探讨白介素18(IL-18)髓核内注射对兔椎间盘蛋白多聚糖和基质金属蛋白酶-3(MMP-3)的影响。方法采用健康大白兔72只,体重2.5~3 kg。随机分为实验组48只,阴性对照组16只,空白对照组8只。实验组(IL-18组):随机分为3组,每组16只。选择L4~L5椎间盘,分别注射浓度为10 ng/μL、20 ng/μL、40 ng/μL的IL-18各1μL。阴性对照组(生理盐水组):椎间盘内注射1μL的生理盐水。空白对照组:不作任何处理。分别于第3、6周取相应椎间盘作HE染色、免疫组织化学法检测MMP-3的表达及蛋白多聚糖含量测定。结果显示:①HE染色显示,随着IL-18浓度加大,髓核中细胞数量减少,正常组织结构破坏越严重,空泡状结构减少,细胞核的形态由椭圆形变为多种形态。②3周时阴性对照组及空白对照组髓核蛋白多聚糖没有明显变化,实验组蛋白多聚糖下降明显(15.72%~43.78%,P<0.001)。6周时阴性对照组及实验组与空白对照组髓核蛋白多聚糖比较差异有统计学意义(P<0.05),并且实验组蛋白多聚糖下降程度与IL-18注射剂量呈正相关(P<0.05))。③实验组均发现表达MMP-3的阳性细胞,随时间延长阳性细胞数量逐渐增多,并且阳性率与IL-18注射剂量及时间呈正相关(P<0.05)。3周时阴性对照组及空白对照组很少发现表达MMP-3的阳性细胞,而6周时阴性对照组MMP-3的阳性细胞表达增多,与空白对照组比较差异有统计学意义(P<0.05)。结论:椎间盘内注射IL-18能够导致椎间盘内蛋白多聚糖含量降低,促进腰椎间盘内基质金属蛋白酶-3(MMP-3)的表达,可能加速椎间盘的退变,并且有量效关系。
白介素-18;椎间盘;蛋白多聚糖;金属蛋白酶-3
Abstract:To investigate the in vivo effects of IL-18 on the content of aggrecan and the expression of MMP-3 on the intervertebral disc.Seventy-two healthy rabbits were randomly divided into three groups,including control group(no intervention of the disc),IL-18 group(IL-18 injectde into the intervertebral discs)and NaCl group(NaCl injectde into the intervertebral discs).L4/5 intervertebral discs were exposed surgically,0.9%NaCl(1μL)and various concentrations(10 ng/μL,20 ng/μL and 40 ng/μL)of IL-18(1μL)were respectiyely injected into L4/5 intervertebral discs.Aggrecan content neasuring and expression of MMP-3 on intervertebral disc were done when the animals were killed in the third and sixth weeks.Results Showed①The HE-staining showed that with the increase of IL-18 the amount of nucleus pulposus cells decreased,reticular framework was broken down,vacuole shape disappeared and oval nucleolus of cells became multi-shape.②In the third week,content of aggrecan had not changed apparently in control and NaCl groups,but in the experiment groups rapid decline(15.72%~43.78%,P<0.001)was evidenced.In the sixth week,content of aggrecan in Nacl group and experiment groups decline(P<0.05),and experiment groups decline were more correlative with the dose of IL-18(P<0.05).③In IL-18 groups the MMP-3 mascuLine cells had homogeneous distribution puncti form moth patch and were increase with the concentrations and the time(P<0.05).ln the third week,there was little expression of MMP-3 in control and NaCl group,but in the sixth week the expression of MMP-3 in NaCl group increased(P<0.05).IL-18 injected into the intervertebral discs can lead to decline of aggrecan and morphologicaL changes in the nucleus pulposus,which were related with dose of IL-18 adminstration.
Key words:interleukin-18;intervertebral disc;aggrecan;matrix metalloproteinase-3
椎间盘退变是引起下腰痛、腰腿痛及腰椎间盘突出症的病理学基础,目前的研究发现,炎性细胞因子在椎间盘退变的过程中发挥极其重要的作用[1]。IL-18是目前研究较多的炎性细胞之一,在炎症反应、自身免疫性疾病、变态反应等疾病中扮演重要角色[2]。随着医学分子学和病理学技术的迅速发展,研究发现,其在退变的椎间盘组织中表达明显增多,且能诱导前列腺素 E2生成,刺激软骨细胞合成一氧化氮(NO)合酶,加速椎间盘病变恶化[3]。因此,我们选择健康大白兔,采用髓核内注射IL-18来观察其对椎间盘组织的作用。
1 材料与方法
1.1 实验模型的制备和分组
健康大白兔72只,雌雄各半,年龄4~6个月,体重2.5~3.0 kg,(由石河子大学动物实验中心提供)。IL-18由北京博奥森生物技术有限公司提供。随机选取48只作为实验组,16只作为阴性对照组,8只作为空白对照组。麻醉成功后,动物俯卧位固定于兔台,背部备皮,采用腰椎侧方倒八字入路,切开皮肤及皮下组织,分离腹肌于腹膜外进入腰椎侧方,找到L4~L5椎体,咬除部分横突,显露颜色呈白色的L4~L5椎间盘。实验组随机分为3组,每组16只,用1μL的微量注射器分别注入 I L-18 10 ng/μL(实验 A 组)、IL-18 20 ng/μL(实验 A 组)、IL-18 40 ng/μL(实验C组)各1μL 到L4~L5椎间盘髓核内。阴性对照组(生理盐水组)选择L4~L5椎间盘内注射1μL的生理盐水。空白对照组选择L4~L5椎间盘不作任何处理。注射椎间盘节段采用黑色缝合线作标记。以上各组,术后伤口无菌包扎,常规应用青霉素肌注,每天每公斤体重20万单位。连续注射10 d。术后两周拆除皮肤缝线。常规饲养,分别于第3、6周时各取8只兔子经耳缘静脉空气栓塞处死,经左腹前外侧入路(手术方法同前)取出L4~L5椎间盘。将取出的每个椎间盘组织分为两份。一份中性甲醛固定24h,另一份快速液氮冰冻保存。
1.2 组织形态学观察
将标本置于10%中性福尔马林液固定48 h,在Schmorl氏脱钙液中脱钙24 h以上,至完全脱钙,流水冲洗24 h,逐级脱水和浸蜡,石蜡包埋,切制5 μm石蜡切片,HE染色,光镜下观察。
1.3 蛋白多聚糖含量的测定
实验采用以朱庆三等[4]所述Bitter法进行蛋白多聚糖含量的测量。将液氮保存的每组取出的8个髓核置20 mL试管中,加丙酮2次,各6 h弃去,乙醚脱脂过夜后,置50℃恒温箱干燥4 h;称取脱脂髓核5 mg置10 mL试管中,加入木瓜酶消化液0.5 mL在60℃消化7 h(每2 h搅拌一次)冷却至室温加入30%TCA 0.25 mL,室温放置2 h,3500 r/min离心5 min。取50μL上清样本溶液,加蒸馏水2 mL。在有塞试管内加入浓硫酸3 mL,冰水浴至4℃左右。取样本或标准葡萄糖醛酸溶液1 mL加入试管中冰水浴冷却。将试管置沸水中加热10 min,冷却后加入咔唑试剂(0.125 g咔唑溶于100 mL乙醇)0.2 mL。再次沸水浴15 min,冷却后530 nm处测定OD值。线性回归分析得到吸光度与标准糖醛酸浓度关系的标准曲线,再根据样本溶液OD值计算蛋白多聚糖含量。
1.4 MMP-3免疫组织化学检测
应用免疫组织化学SABC法检测椎间盘组织中MMP-3的表达。MMP-3多克隆抗体购自北京博奥森生物技术有限公司,一抗按1∶400稀释。免疫组织化学试剂盒购自武汉博士德生物工程有限公司。免疫组织化学阳性对照为用含MMP-3丰富的乳腺癌病理切片代替实验切片,实验步骤相同,制备免疫组化阳性对照,结果为阳性。阴性对照为实验时不加抗MMP-3的多克隆抗体。显微镜下观察,免疫组织化学阳性染色为细胞浆内棕黄色颗粒,根据染色强度分为以下4个等级:-,无阳性细胞;+,阳性细胞 < 30%;++,阳性细胞占 3 0%~60%;+++,阳性细胞>60%。
1.5 资料收集和数据处理
各组数据均用均数±标准差,采用统计软件数据包SPSS11.0进行统计。多组数据之间均数比较采用单因素方差分析,然后采用LSD法行两两比较,两组数据之间均数比较采用t检验。
2 结果
2.1 组织形态学结果
HE染色显示:空白组及阴性对照组纤维环仍保持着致密的板层结构,细胞成分较多,呈梭形纤维细胞样或呈软骨细胞样。而实验组随着IL-18剂量增加及时间延长:髄核脊索细胞逐渐减少,并逐渐被纤维软骨细胞替代,纤维环与髄核之间失去明显的界限。且在实验组与阴性对照组比较显示了更多的髓核毛细血管侵入和炎性细胞浸润,髓核及纤维环退变更严重,纤维细胞增生及瘢痕形成,见图1。
2.2 蛋白多聚糖含量
各时间点实验组蛋白多聚糖含量较正常对照组显著下降。从量效关系来看,C组蛋白多聚糖含量下降高于B组,B组蛋白多聚糖含量下降高于A组;从时效关系来看各实验组蛋白多聚糖含量下降值6周高于3周,见表1。
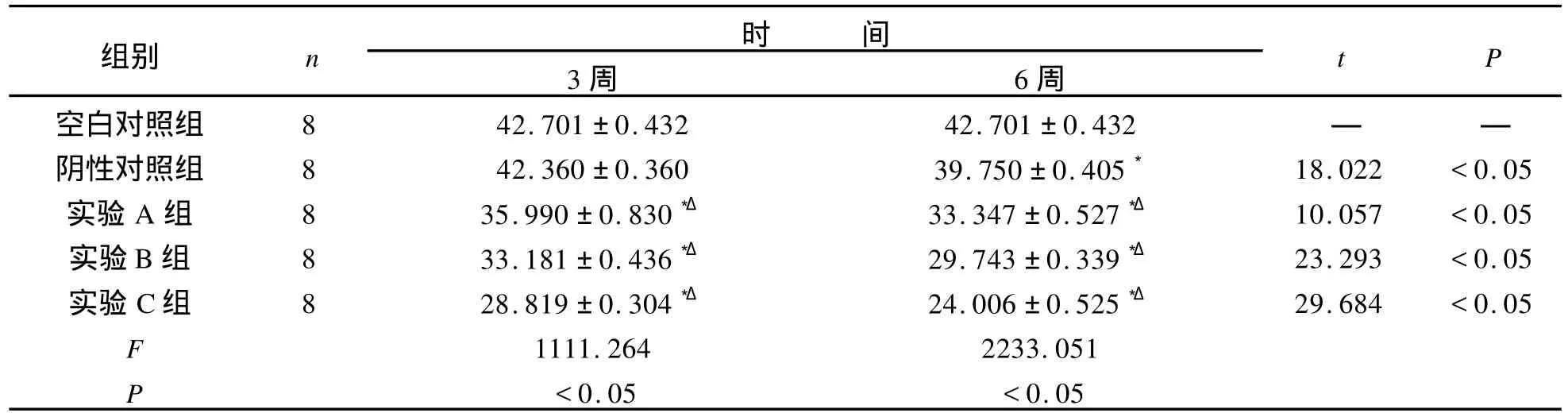
表1 髓核蛋白多聚糖含量的测定Tab.1 Results of nucleus pulposus proteoglycan content x±Sμ,g/mg

图1 各组兔椎间盘组织HE染色显微镜观察照片(100×)Fig.1 HE-staining results of each group rabbit lumbar intervertebral disc(100×)
2.3 MMP-3免疫组织化学检测结果
MMP-3阳性结果表现为:细胞浆内有黄色或棕黄色颗粒。每张切片随机观察10个视野并记录阳性细胞数和细胞总数,该标本阳性细胞率=10个视野(×400)×视野内阳性细胞数÷10个视野内的细胞总数×100%,阳性细胞率<5%为阴性。实验组与对照组阳性表达情况,实验组明显高于对照组,且随着IL-18剂量增加及时间延长,实验组阳性细胞数明显增加,见表2。各组兔椎间盘组织MMP-3免疫组化染色显微镜观察照片,见图2。
表2 MMP-3免疫组织化学检测结果Tab.2 Results of immunohistochemistry of MMP-3μ,g/mg
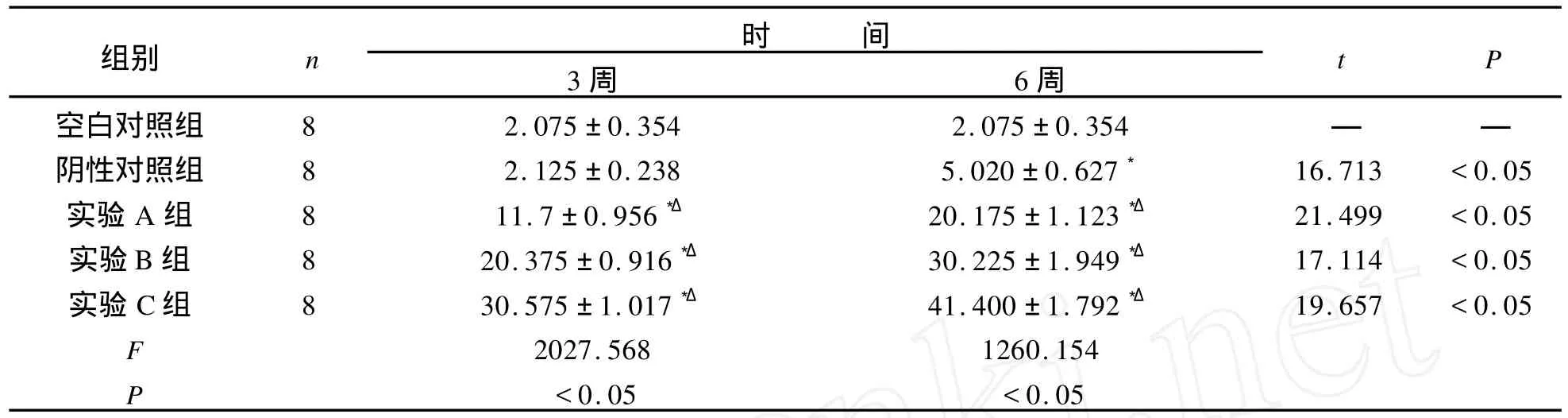
表2 MMP-3免疫组织化学检测结果Tab.2 Results of immunohistochemistry of MMP-3μ,g/mg
注:与空白对照组比较:*表示 P<0.05;与阴性对照组比较:Δ表示 P<0.05。同组不同时间比较用t检验。
组别 n 时 间3周 6周t P空白对照组 8 2.075±0.354 2.075±0.354 — —阴性对照组 8 2.125±0.238 5.020±0.627*16.713 <0.05实验A组 8 11.7±0.956*Δ20.175±1.123*Δ21.499 <0.05实验B组 8 20.375±0.916*Δ30.225±1.949*Δ17.114 <0.05实验 C组 8 30.575±1.017*Δ41.400±1.792*Δ19.657 <0.05 F 2027.568 1260.154 P<0.05 <0.05

图2 各组兔椎间盘组织MMP-3免疫组化染色显微镜观察照片(400×)Fig.2 MMP-3 immunohistochemistry coloured results of each group rabbit lumbar intervertebral disc(400×)
3 讨论
IL-18主要由活化的单核-巨噬细胞产生,有许多生物学活性,刺激 T细胞增殖;诱导 T细胞和自然杀伤(N K)细胞产生IFN-γ;使 T细胞分泌 IL-2、粒-巨噬细胞集落刺激因子(GM-CSF)和肿瘤坏死因子(TNF-α);促进 T细胞、N K细胞增殖,诱导Th1细胞分化成熟,增强N K细胞的细胞毒作用[2]。诱导 T细胞和N K细胞表达 Fas配体(FasL)等。除此之外,IL-18还对 IL-8、单核细胞炎症蛋白1(MIP-1)、单核细胞趋化蛋白(MCP)等趋化蛋白都有作用[5],而这些炎性因子反过来又促进IL-18合成,从而形成正反馈,加重反应,使椎间盘内的细胞数目进一步减少,从而加速了退变过程。椎间盘主要由胶原、蛋白多糖、弹性纤维、非胶原蛋白、糖蛋白等组成。其中,胶原和蛋白多糖是基质的主要成分,其含量和成分改变被认为是椎间盘退变最早出现的生化改变之一,并可直接导致椎间盘生物力学性能的改变,随着年龄的增长,蛋白多糖的总量及糖胺多糖显著减少[6],使胶原结构变得脆弱,造成生物力学功能障碍,引起椎间盘退行性变。其中MMP-3是降解椎间盘组织中蛋白多糖聚合体及椎间盘内多种基质成分的主要酶,减少髓核的亲水作用。通过降解连接蛋白破坏核心蛋白的透明质酸结合区分解蛋白多糖聚合体,此外还可以降解多种胶原、层粘素、纤维连接素、明胶、基底膜和结缔组织,并且可以通过激活其他MMPs起作用[7]。
最近的研究显示,在人体退变的椎间盘组织中发现IL-18高表达,认为 IL-18参与了这个过程,并认为是引起其退变的关键因子[8],但其引起椎间盘退变的机制鲜为人知,有关这方面的研究也少有报道。本研究以家兔为动物模型,通过向髓核内注射不同剂量的IL-18,在不同的时间点观察其对椎间盘蛋白多聚糖的影响并进行MMP-3免疫组织化学检测。本实验结果显示:从形态学观察发现,空白组及阴性对照组纤维环仍保持着致密的板层结构,纤维排列整齐,细胞成分较多,呈梭形纤维细胞样或呈软骨细胞样。而实验组随着IL-18剂量增加及时间延长:纤维结构排列紊乱,髄核脊索细胞逐渐减少,并逐渐被纤维软骨细胞替代,纤维环与髄核之间失去明显的界限。且在实验组与阴性对照组比较显示了更多的髓核毛细血管侵入,髓核及纤维环退变更严重,纤维细胞增生及瘢痕形成。3周时阴性对照组及空白对照组髓核蛋白多聚糖没有明显变化,6周时阴性对照组与空白对照组髓核蛋白多聚糖比较有差异性(P<0.05),而实验组蛋白多聚糖含量下降明显(15.72%~43.78%,P<0.001),并且下降程度与 IL-18注射剂量呈正相关(P<0.01),表明椎间盘在IL-18的作用下蛋白多聚糖降解加剧或者合成明显减少,并且和剂量呈正相关。而病理学检查发现实验组均有表达MMP-3的阳性细胞,且随时间延长阳性细胞数量明显增多,并且阳性率与IL-18注射剂量呈正相关(P<0.01)。阴性对照组及空白对照组在3周时很少发现表达MMP-3的阳性细胞,而6周时,阴性对照组表达MMP-3的阳性细胞较空白对照组表达增多(P<0.05),这与阴性对照组六周时蛋白多糖的降低一致,但没有实验组增多明显,进一步说明IL-18加速了椎间盘的退变过程,而IL-18是否直接促进基质金属蛋白酶的表达尚不能定论,需进一步的研究。
本组实验研究表明,小剂量 IL-18注射短期内就可以引起蛋白多聚糖含量的明显下降,在某种程度上说明了IL-18可以通过影响蛋白多聚糖含量的变化来导致椎间盘细胞外基质成分的改变,从而加速了椎间盘的退变,为临床通过抑制IL-18的作用来延缓椎间盘退变提供了一定的理论基础。但是,IL-18与椎间盘内其它炎性因子以及各种水解酶系相互间的作用,亦不甚清楚,如何通过改变 IL-18与其它炎性细胞因子以及各种水解酶的相互作用来达到预防和治疗椎间盘病变需更进一步的研究。
[1]郭健行,黄桂成.椎间盘退变影响因素研究进展[J].国际骨科学杂志,2008(29):46-48.
[2]彭彦,王勇,王亚平.白介素-18与临床疾病相关性研究进展[J].国外医学临床生物化学与检验学分册,2004,25(3):246-248.
[3]Futani H,Okayama A,Matsui K,et al.Relation between interleukin-18 and PGE2 in synovial fluid of osteoarthritis:a potential therapeutic targetof cartilage degradation[J].Immunother,2002,25(1):61-64.
[4]朱庆三,瞿饶生,许则民,等.腰椎间盘中胶原及蛋白含量的测定[J].中华外科杂志.1994,32(8):463-465.
[5]BercLaz P Y,Shibata Y,Whitsett J A,et al.GM-CSF,via PU.1,regulates alveolarmacrophage Fcgamma R-mediated phagocytosis and the IL-18/IFN-gamma-mediated molecular connection between innate and adaptive immunity in the lung[J].Blood,2002,100(12):4193.
[6]胡明.退变椎间盘细胞外基质的改变[J].局部手术学杂志,2004,13(1):55-57.
[7]Freemont A J,Watkins A,Maitre C L,et al.Current understanding of cellular and molecular events in intervertebral disc degeneration:implications for therapy[J].J Pathol,2002,196(4):374-379.
[8]尚琦松,刘维钢,王宗亮,等.退变椎间盘组织中 TNF-α及IL-18的表达及意义[J].农垦医学,2008,4(30):263-265.
Effects of Interleukin-18 on the Degeneration of Rabbit Lumbar Intervertebral Disc
CHEN Cao,QIN Chao,LIU Weigang,WANG Weishan,DONGJinbo,SHI Chenhui
(1 The First Affiliated Hospital of Medical College,Shihezi University,Shihezi 832002,China;2 The Second Affiliated Hopspital of Medical College,Shihezi Univevsity,Wulumuqi 810000,China)
R681.53
A
1007-7383(2010)05-0587-05
2009-12-17
陈操(1983-),男,硕士生,专业方向为脊柱外科。
刘维钢(1963-),男,教授,主任医师,从事脊柱与骨组织工程的研究;e-mail:Liu-wg@163.com 。
