293T细胞转染表达ARG1及其对砷代谢的影响
2010-10-28李莉杨元元王瑞张冰荫李媛媛慕晓玲
李莉,杨元元,王瑞,张冰荫,李媛媛,慕晓玲
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002)
293T细胞转染表达ARG1及其对砷代谢的影响
李莉,杨元元,王瑞,张冰荫,李媛媛,慕晓玲
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002)
研究含有ARGI基因的真核表达载体PcDNA3.1-IE-ARG1转染真核细胞后,在细胞中的表达及对细胞砷代谢的影响。由脂质体介导将PcDNA3.1-IE-ARG1转染入293T中,用real-timePCR方法检测ARG1基因的表达,用原子吸收分光光度法测定24h砷染毒后细胞内砷含量及细胞排砷量。重组质粒成功转入293T细胞中且表达良好;与转染前细胞比较,转染重组质粒的细胞在不同浓度砷染毒下细胞内砷含量明显降低(P<0.05),并且细胞的排砷量也高于转染前的;此外,转染表达ARGI基因的细胞在砷染毒48h后其内 GSH及 GST的含量高于转染前细胞。这些表明,ARG1基因在真核细胞中相对高表达后在砷代谢排出中发挥了一定的作用。
ARG1基因;转染;砷代谢;GSH;GST
Abstract:To examine the expression ofARG1 in eukaryotic cell and the effect of arsenic metabolism after transfecting the eukaryotic cell vector.293T cell was transfected with the recombinant plasmid and the expression of recombinant ARG1 was examined by real-timePCR.Cells were exposed to arsenite for 24h,Arsenite accumulation and efflux of cell was determined by atomic absorption spectrophotometry.The recombinant plasmid was successfully transfected into 293T cell.Arsenite contents in the transfected-cells that were exposed to arsenite with different consistency were lower than those in the 293T cell(P<0.05),and the efflux of cell was higher than those in the 293T cell.The transfected-cells were exposed to arsenite for 48h,intracellular concentration of GSH and GST activity were higher than those in the 293T cell.ARG1 plays an important role in arsenic metabolism after high expression of ARG1 in eukaryotic cell.
Key words:ARG1gene,transfection;arsenic metabolism;glutathiome;glutathione-S-transferase
谷胱甘肽(glutathiome,GSH)及谷胱甘肽转-S-转移酶(glutathione-S-transferase,GST)已被证明在砷的代谢过程中发挥重要作用。了解影响砷代谢的因素对解析砷中毒发生机制具有重要意义,ARG1(arsenite related gene 1)基因是顾永清[1-2]等人从胎脑中获得mRNA建立cDNA文库克隆出的一条新基因,全长 2255bp,开放阅读框(ORF)1532bp,该基因在未用砷染毒的细胞中几乎不表达,而在砷染毒细胞中表达量明显增加,且有随剂量增加表达量亦增加的趋势。他们推测ARG1可能是一条新的砷代谢相关基因。本实验通过真核细胞转染表达ARG1基因,检测细胞砷代谢相关指标的变化,从而进一步确定ARG1基因的抗砷作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂
H-DMEM培养基、胎牛血清购于 G ibco公司;Lipofectamine2000试剂购于invitrogen公司;DNA少量质粒抽提试剂盒购于 T akara公司;四甲基偶氮唑盐(MTT)购自北京华美生物工程公司。二甲基亚砜(DMSO)购自美国Sigma公司;GSH测定试剂盒、GST测定试剂盒购于南京建成生物工程研究所。
1.1.2 质粒及细胞
293T细胞为本实验室所存,ARG1质粒及pcDNA3.1载体购于北京泛基诺科技有限公司,PcDNA3.1-IE-ARG1质粒由本实验构建。
1.2 方法
1.2.1 质粒抽提
对PcDNA3.1-IE-ARG1质粒及PcDNA3.1空质粒进行小量抽提纯化,方法按照质粒抽提试剂盒说明书进行,用于转染试验。
1.2.2 细胞培养
用含10%FBS、双抗的 H -DMEM的培养基培养293T细胞,无菌条件下置于75 mL培养瓶中37℃,5%CO2培养箱中培养。倒置显微镜下观察细胞长满瓶底后,弃原液,PBS冲洗2遍,加0.125%胰酶1 mL,放入37℃,5%CO2培养箱中消化1 min,加适量含10%FBS、双抗的 H -DMEM的培养基终止消化,移入10 mL的离心管中1000 r/min离心7 min,弃上清,加入6mL H-DMEM培养基吹打成细胞悬液,计数,取适量细胞悬液稀释后铺入6孔板进行转染。
1.2.3 细胞转染
采用脂质体介导的转染方法,设三组即 P cDNA3.1-IE-ARG1转染组、空载体组,未转染组。转染前1 d用0.25%胰酶消化293T细胞,加入适量的H-DMEM终止消化,移入10 mL的离心管中1000 r/min离心 7 min,弃上清,加入 6mL HDMEM培养基吹打成细胞悬液并计数,将5×105个每孔细胞接种于6孔板培养24 h,次日细胞密度达到70%~80%,弃原液,PBS冲洗1遍,加入无血清、无双抗的DMEM培养24 h,将重组质粒pcDNA3.1-IE-ARG1和空质粒pcDNA3.1分别取2 μg,分别加入无血清、无双抗的 H -DMEM培养基250μL作为A液,Lipofectamine2000 8μL加入到250μL无血清、无双抗的 H -DMEM培养基作为B液,5 min内混匀,室温放置20 min,PBS冲洗6孔板中的293T细胞1次,然后将混合后的转染液加入其中,放入37℃,5%CO2培养箱中培养6 h,之后换含10%FBS、双抗的 H -DMEM的培养基继续培养,用real-timePCR方法检测基因表达。其余细胞分别加入含NaAsO2浓度为0、4、8μmol/L的培养基,继续培养48 h检测ARG1基因表达情况。
1.2.4 细胞内 G SH与 G ST含量测定
取含 N aAsO2浓度为 0 、4、8μmol/L 的培养基,培养48h的转染后的293T细胞和未转染的293T细胞2×107个/mL,PBS冲洗2次,冰浴中匀浆,15000 r/min,4℃离心10 min,分别按照试剂盒说明操作检测细胞内 G SH和 G ST含量。本实验 GSH及 GST测定采用二硫双硝基苯甲酸(DTNB)法。
1.2.5 细胞内砷蓄积及排出
取转染后的293T细胞和未转染的293T细胞按2×107个/mL密度种于100 mm的一次性培养皿中,用不含砷的 H -DMEM(含10%FBS)培养基培养细胞铺至70%~80%,换成含NaAsO2浓度为1、4、8μmol/L 的 H -DMEM(含 1 0%FBS),继续培养24 h后收集培养皿中液体于干净的离心管中,用PBS冲洗 3 次,加入不含砷的 H-DMEM(含10%FBS)培养基培养,分别于24 h,48 h收集其培养基,用原子荧光分光光度计检测培养基中砷含量,间接反映转染前后细胞内砷蓄积及排出量的变化。
1.3 统计学分析
应用SPSS13.0软件对实验数据进行统计学分析。两组间的比较采用 t 检验,P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒转染293T细胞结果
转染重组质粒组细胞48 h后,在激光共聚焦显微镜下观察可见细胞膜上荧光较强,如图1 b所示,镜下观察并计算转染率为70%以上;而未转染组与空载体组没有荧光显示,如图1a和c所示。
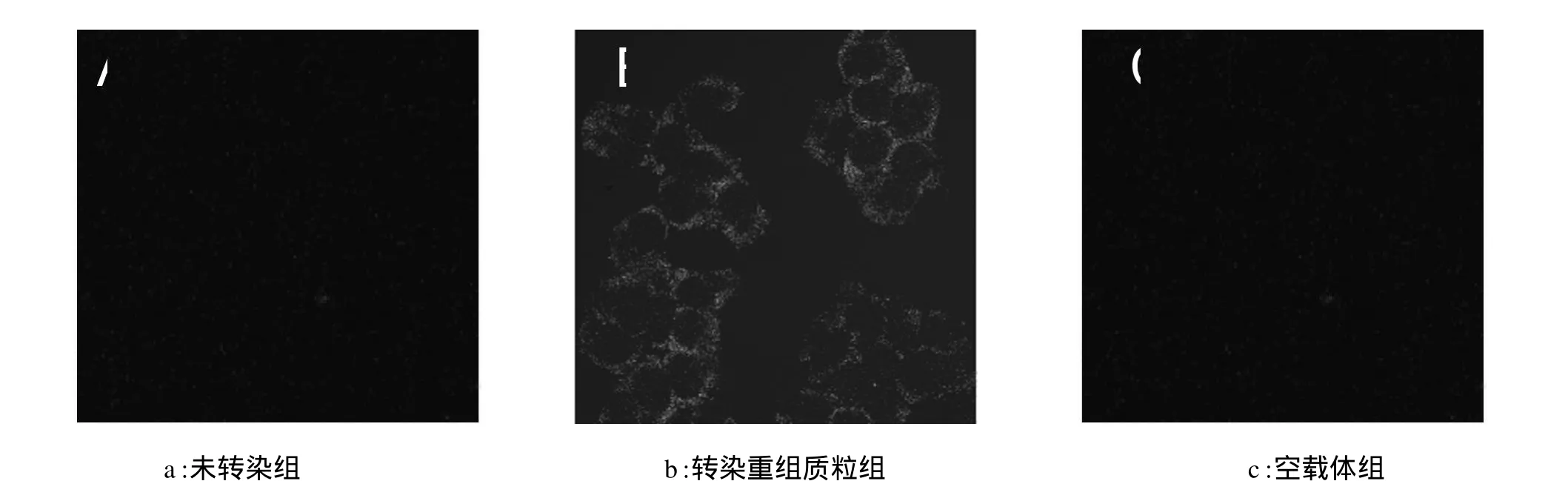
图1 激光共聚焦显微镜观察重组质粒转染293T细胞情况(×400)Fig.1 Observe the transfection of recombinant plasmid by laser scanning confocal microscopy(x400)
2.2 293T细胞中ARG1基因mRNA表达的检测
以β-actin为内参,Real-time PCR反应ARG1、β-actin基因的标准曲线线性相关性良好,扩增曲线呈“S”形指数扩增(见图2)条件符合相对定量标准。结果说明转染重组质粒组的293T细胞有ARG1基因表达,且随着砷染毒浓度的增加有着ARG1基因相对表达量亦增加的趋势,在砷染毒浓度为0、4、8 μmol/L时相对应的ARG1基因相对表达量分别为2.83×10-3±0.2×10-3,3.07×10-3±0.2×10-3,3.58×10-3±0.17×10-3(见图3)。而空载体组与未转染组细胞几乎中没有ARGI基因mRNA的表达。

图2 ARG1基因的标准曲线、扩增曲线、溶解曲线Fig.2 The amplification,melting and standard curves of ARG1 gene
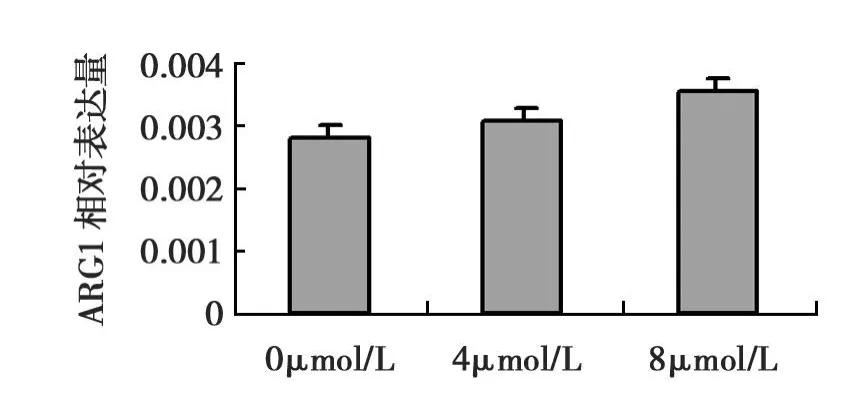
图3 不同浓度砷染毒48h重组质粒组细胞内ARG1mRNA的表达Fig.3 The expression of ARG1mRNA in the group of recombinant plasmid after 48h exposure to various concentrations of arsenite
2.3 细胞内GSH含量与GST活性的测定结果
不同浓度砷染毒48 h后,转染重组质粒组细胞内的GSH含量与 G ST活性增高,与未转染组及空载体组细胞相比,差异具有统计学意义(P<0.05)。见表1。
表1 细胞内GSH含量和 G ST含量比较Tab.1 Cellular GSH levels and GST enzyme activity in cells
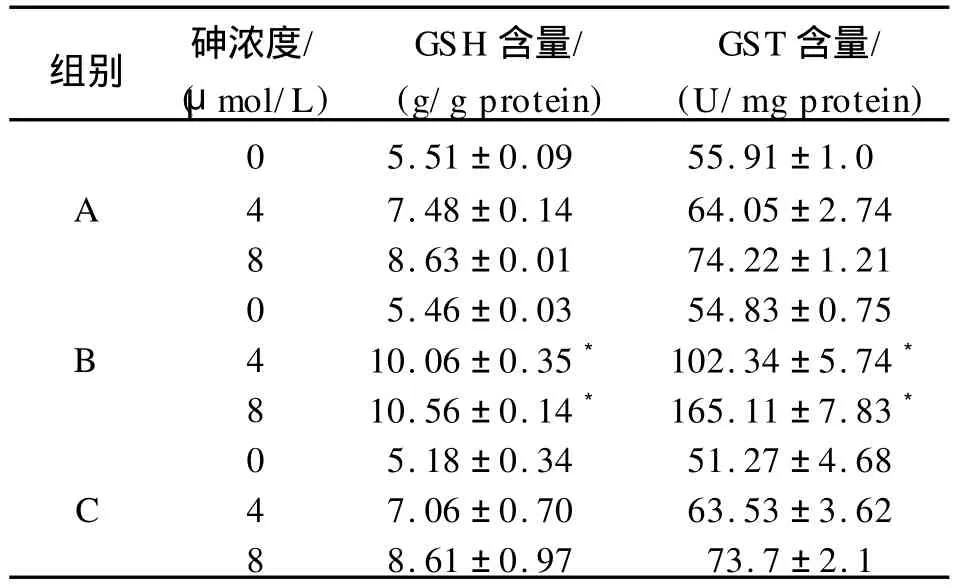
表1 细胞内GSH含量和 G ST含量比较Tab.1 Cellular GSH levels and GST enzyme activity in cells
注:与未转染组及空载体组相比,*表示 P<0.05。A为未转染组;B为转染重组质粒组;C为空载体组。
组别 砷浓度/(μmol/L)GSH含量/(g/g protein)GST含量/(U/mg protein)0 5.51±0.09 55.91±1.0 A 4 7.48±0.14 64.05±2.74 8 8.63±0.01 74.22±1.21 0 5.46±0.03 54.83±0.75 B 4 10.06±0.35*102.34±5.74*8 10.56±0.14*165.11±7.83*0 5.18±0.34 51.27±4.68 C 4 7.06±0.70 63.53±3.62 8 8.61±0.97 73.7±2.1
2.4 细胞内砷蓄积及排出能力的测定结果
不同浓度砷染毒24 h后,转染重组质粒细胞内砷的蓄积量降低,排砷能力增高,与未转染组及空载体组细胞相比,差异具有统计学意义(P<0.05)。见图4。
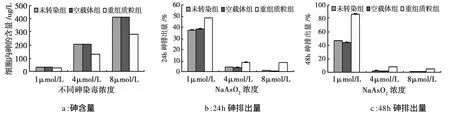
图4 不同浓度砷染毒24h细胞内砷蓄积及排出量比较Fig 4.The comparison of intracellular arsenic efflux for 48h after 24h exposure to various concentrations of arsenite
3 讨论
砷中毒能引发生物体多系统损伤,因此砷中毒发生机制备受关注。砷广泛分布,使得长期暴露于砷环境的个体产生了抗砷性,具有相应的基因介导来对抗砷毒的机制[3]。砷的毒性作用以及细胞对砷产生抗性涉及到众多基因的参与,至今抗砷基因的研究在原核生物已经比较清楚,对真核生物特别是哺乳动物和人体内的抗砷基因及其抗砷机制的研究乃处于起始阶段。Wang[4]首次报道了哺乳动物(中国仓鼠V79)细胞也具备可诱导的对砷的耐受性,发现并克隆了两条具有抗砷性的cDNA片段asr1和asr2;进一步的研究显示,在人体内也存在着抗砷基因及抗砷相关基因:Kurdi-Haidar[5]等首先分离出了一条人类的与细菌arsA同源的基因(hARSA-I),该基因属ATP酶超基因家族,没有跨膜区;杨磊[6-7]等从人胎脑cDNA文库中发现并克隆出了中国仓鼠asr2的同源基因hARRG;Brambila[8]等用低剂量砷长期诱导对人前列腺上皮细胞株做癌性转化时培养出了能稳定耐砷的细胞株。
ARG1基因通过 GenBank上作BLASTn和BLASTx同源性比较时发现其与日本NEBO human cDNA sequencing project在 GenBank上登陆的A K000371是不同的剪切体,而关于 A K000371编码的蛋白没有任何报道。ARG1蛋白的氨基酸序列于GenBank上作BLASTn和BLASTx同源性比较时,没有发现与已知功能蛋白同源的蛋白质,说明ARG1是一个未知功能的新基因。当ARG1蛋白的氨基酸序列于 GenBank上作 PSI-BLAST时,与一个116kD的液泡-ATP酶亚基家族同源性最高,提示ARG1具有一个液泡-ATP酶(Vacuolar-A TPase,V-ATPase)样的功能域。V-ATP酶属于ATP依赖的质子泵,负责真核细胞细胞器内的酸化反应,细胞器内的酸化反应参与许多重要的细胞反应,尤其是膜运输反应。顾永清等[2]前期研究表明ARG1基因在未用砷诱导的细胞中几乎不表达,而在砷诱导细胞中表达量明显增加,且有随剂量增加表达量亦增加的趋势;据此认为ARG1可能是一条新的全长砷代谢相关基因。
本次试验成功转染真核细胞,研究该基因是否参与砷代谢过程。GSH与GST在砷代谢过程中发挥重要作用。GSH是机体内一种重要的抗氧化物,可以清除多种自由基,其水平增高可以减轻砷中毒引起的氧化应激毒性作用[9],在砷的代谢过程中GSH还可与三价砷结合形成砷-硫复合物加速砷排出体外,并参与无机砷代谢中的还原甲基化过程[10-11]。GST是机体内参与外源性化学物质代谢解毒和活化的Ⅱ相代谢酶系,是砷代谢过程的限速酶[12]。在 Romach[13]和 Wang[14]的研究中发现哺乳动物细胞排砷能力的增加与细胞内 GSH及 GST水平升高有关。另有有资料显示,在生理条件下,存在一个依赖 MRP2的谷胱甘肽输出体系,通过MRP2与GSH共转运机制将内源性有毒物质共同泵出细胞外,并且细胞内 GSH水平可调节MRP2对底物的主动外运[15]。高怡等[16]研究表明MRP2转运砷及其代谢产物的作用与细胞内 GSH水平相关,抑制 GSH合成,可使MRP2-GSH共转运功能减弱,进一步导致砷在肝脏内蓄积增加。
本试验结果显示ARG1基因在293T细胞中随着砷染毒浓度的增加相对表达量逐渐增加;与对照组细胞相比,转染ARG1基因组细胞内 GSH含量与 GST活性增高,细胞排砷能力增高,细胞内砷蓄积量降低,但随着砷染毒浓度的增加各组细胞内砷蓄积量逐渐增高,排砷能力逐渐降低。由此推断ARG1基因是一条与砷代谢相关的抗砷基因,在低浓度砷中毒时,它可能是通过增强多药耐药相关蛋白与谷胱甘肽共同转运体功能来促进砷代谢及其产物转运排出进行,进一步提高了细胞对砷的耐受性,但其具体的作用机制还有待深入研究。
[1]顾永清,杨磊,潘泽民,等.砷代谢相关的全长新cDNA的克隆和功能初步研究[J].复旦大学学报:自然科学版,2000,39:603-608.
[2]顾永清,杨磊,潘泽民,等.ARG1基因的生物学信息和基因表达谱分析[J].农垦医学,2003,25(2):81-83.
[3]Gebel T W.Unanswered questions in arsenic toxicology[J].Environ Pathol Toxicol Oncol,2001,20(4):299-309.
[4]Wang Z,Rossman T G.Stable and inducible arsenite resistance in Chinese hamster cells[J].Toxicol Appl Pharmacol,1993,118(1):80-86.
[5]Kurdi-Haidar B,Heath D,Naredi P,et al.Immunohistochemical Analysis of the Distribution of the Human ATPase(hASNA-I)in Normal Tissues and Its Overexpression in Breast Adenomas and Carcinomas[J].The Journal of Histochemistry&Cytochemistry,1998,46(11):1243-1248.
[6]杨磊,王国荃,应康.人类抗砷相关基因(hARRG)的克隆和表达[J].新疆医科大学学报,2000,23(2):95-97.
[7]潘泽民,杨磊,吴顺华,等.人类抗砷相关基因 hARRGcDNA抗砷功能的研究[J].中国地方病学杂志,2005,24(2):140-142.
[8]Achanzar W E.Brambila E M,Diwan B A,et al.Inorganic Arsenite-Induced MalignantTransformation of Human Prostate Epithelial Cells[J].Journal of the National Cancer Institute,2002,94(24):1888-1889.
[9]Maiti S,Chatterjee A K.Effect on levels of glutathione and some related enzymes in tissues after an acute arsenic exposure in rats and their relationship to dietary protein deficiency[J].Arch Toxicol,2001,75:531-537.
[10]Aposhian H V.Enzymatic methylation of arsenic species and other new approaches to arsenic toxicity[J].Annu Rev Pharmacol Toxicol,1997,37:397-419.
[11]Rosen B P.Families of arsnic transporters[J].Trends Microbiol,1999,7:207-212.
[12]李述刚,刘开泰.无机砷甲基化产物与砷代谢相关基因研究进展[J].国外医学卫生学分册,2009,36(1):28-33.
[13]Romach E H,Zhao C Q,Del R,et al.Studies on the mechanisms of Arsenic-induced self-tolerance developed in liver epithelial cells throughcontinuous lowlevel arsenite exposure[J].Toxicol Science,2000,54(4):500-508.
[14]Wang H F,Lee T C.Glutathione-S-transferase facilitates the excretion of arsenic from arsenic2resistant Chinese hamster ovary cells[J].BiochemBiophys,1993,192(7):1093-1099.
[15]ZamanGJ,Lankelma J,van Telingen,et al.Role of glutathione in the export of compounds form cells by the multidrug-resistancea ssociated protein[J].Porc Natl Acad Sci USA,1995,92:7690-7694.
[16]高怡,裴秋玲,李国星,等.多药耐药相关蛋白2与谷胧甘肤共转运体系对肝脏砷代谢的影响[J].中华劳动卫生职业病杂志,2006,24(5):278-280.
Expression of ARG1 Gene in 293T Cell and Its Influence on Arsenic Metabolism
LI Li,YANG Yuanyuan,WANG Rui,ZHANG Bingyin,LI Yuanyuan,MU Xiaoling
(Medical College of Shihezi University/Key Laboratory of Xinjiang Endemic and Ethnic Diseases,Shihezi 832002,China)
R541.4
A
1007-7383(2010)05-0582-05
2010-03-06
国家自然科学基金项目(30360095)
李莉(1981-),女,硕士生,专业方向为环境与基因、干细胞研究。
慕晓玲(1962-),女,教授,从事环境与基因、干细胞研究;e-mail:xiaolingmr@163.com 。
