棉花耐旱相关基因的cDNA-AFLP差异显示
2010-10-28邓晓艳刘江娜李志博刘菲菲章杰郗忠玲魏亦农
邓晓艳,刘江娜,李志博,刘菲菲,章杰,郗忠玲,魏亦农
(1石河子大学生命科学学院,石河子832003;2石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子832003)
棉花耐旱相关基因的cDNA-AFLP差异显示
邓晓艳1,刘江娜2,李志博2,刘菲菲2,章杰2,郗忠玲1,魏亦农2
(1石河子大学生命科学学院,石河子832003;2石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子832003)
为鉴定棉花干旱胁迫响应基因,应用cDNA-AFLP技术,以棉花耐旱品种晋棉13号幼苗为研究对象,对干旱胁迫早期叶片基因表达进行了mRNA指纹分析。通过64对引物组合的筛选,共分离得到232个差异表达的转录衍生片段(TDFs),对其中102个 TDFs进行了克隆、测序和序列分析。结果表明:45个 TDFs与NCBI中已有序列同源,功能涉及信号传导、转录调控以及逆境诱导蛋白等,另有57个 TDFs无同源序列或同源性低,预测其为是一些未知功能基因。
棉花;干旱胁迫;cDNA-AFLP;差异表达基因
Abstract:In order to identify genes involved in drought stress responses in cotton,cDNA-AFLP approach was employed to identify genes differentially expressed in cotton leaves at drought stress.Sixty-four primer combinations were used for selective amplification.Two hundred and thirty-two TDFs were selected for their differential expression under drought stress.Among the 232 TDFs,one hundred and two TDFs were cloned and sequenced.Compared with the publicly available databases,45TDFs presented some significant similarities with known plant sequences,whose functions are involved in gene regulation,transcription factor,signal transduction,stress defense,etc.Fifty-seven TDFs with low identity and no match to known genes may represent novel cotton genes.
Key words:cotton;drought stress;cDNA-AFLP;differentially expressed genes
干旱是全球面临的严重问题之一,也是制约我国农业生产的主要因素。据统计,全世界约43%的耕地受到干旱、半干旱的威胁[1],因此,提高作物的抗旱能力是现代农业研究中的热点和重点问题之一。
棉花是我国乃至全世界重要的经济作物。新疆是西北五省干旱区之一,属于干旱荒漠地带,气候干燥,同时又是我国最大的棉花生产基地之一,开荒植棉面积逐年扩大。目前全疆耕地面积402.55万hm2,其中棉花种植面积约126万 hm2[2]。棉花属于耗水作物,其造成的农业用水危机问题日益突出,干旱问题严重制约着新疆棉花的进一步发展。由于棉花耐旱性状的复杂性和缺乏有效的选择手段,多年来,人们一直采用传统常规选育等方法解决棉花品种的干旱问题,但此方法具有耗资大、工作量大和选择效率不高等缺点,同时,植物的抗旱性是受多基因控制的复杂性状,单个抗旱基因在植物的抗旱过程中所起的作用有限[3],从而增加了解决棉花品种干旱问题的难度。
随着分子生物学的不断发展,利用生物技术手段,培育抗旱、耐旱棉花品种成为可能。目前研究基因差异表达的技术主要有 DD-PCR、RDA、SSH、SAGE、基因芯片技术、cDNA-AFLP[6]。cDNAAFLP技术是一种新的研究基因差异表达的技术,因其具有可靠性高、重复性好、假阳性率低,不需要预先知道序列信息,且所需仪器设备简单的特点[5],被广泛应用于生物体基因表达特性的研究。目前,利用 cDNA-AFLP技术已在藜属植物[6]、拟南芥[7]、马铃薯[8]、番茄[9]等植物中分离出抗虫、抗病、抗干旱等多个抗性基因。
本研究采用cDNA-AFLP技术,分离出与棉花耐旱有关的cDNA片段,试图从棉花中克隆出耐旱相关基因,以期为进一步阐明棉花耐旱性分子机理奠定良好的基础。
1 材料与方法
1.1 材料
以耐旱材料晋棉13号为实验材料,将晋棉13号的种子浸泡过夜,然后转入铺有滤纸的培养皿中,待发芽后,转入盛有 Hoagland营养液[10]的塑料盒中培养。
当幼苗长至两叶一心时,用浓度分别为20%和30%的 PEG6000进行干旱胁迫,整个培养过程在25℃进行。胁迫时间分别为 0 h、2 h、4 h、8 h、12 h、24 h、48 h。剪取叶片于液氮中速冻,-70℃保存备用。
1.2 方法1.2.1 RNA的提取及双链cDNA的合成
分别取对照和胁迫后的棉花叶片,用改良的CTAB法[11]提取其总RNA。
cDNA双链合成按照 Takara的 M-MLV RTase cDNA SynthesisKit(M-MLV version)(Code No.D6130)中介绍的方法,先以Oligo(dT)18 Primer为引物,合成cDNA第一链,然后通过E.coli RNaseH使杂合链中 RNA形成单链切口,在E.coli DNA Polymerse I与E.coli DNA ligase的作用下合成cDNA第二条链。合成的双链cDNA用Ubiquitin gene(UBI)[12]进行检测。
1.2.2 cDNA-AFLP分析
cDNA 200 ng,10 U/μL MseI和 EcoR Ⅰ各 1 μL,10×Reaction buffer 2.5μL,T4DNA连接酶(3 U/μL)1μL,10 mmol/L ATP 2.5μL,MseI和EcoRI人工接头(50μmol/L)各 0.5μL,用 ddH2O补足至20μL,在37 ℃下保温5 h,8 ℃保温4 h,然后4℃过夜。
取酶切连接后的产物2μL,M0和E0(50μg/L)各0.5μL,10×PCR buffer 2.5 L,dNTP 0.5 L ,Taq酶(2 U/μL)0.5μL,用 ddH2O 补足至20μL,进行预扩增。
预扩增引物序列:

PCR反应为预变性94℃2 min,变性94℃30 s,退火56℃30 s,延伸72℃80 s,30个循环,延伸加时72℃5 min,产物稀释20倍备用。稀释后产物 2μL,引物(50 ng/μL)各 1μL,10×PCR buffer 2.5μL,dNTP 0.5μL,Taq 酶(2 U/μL)0.5μL,用ddH2O补足至20μL,进行选择性扩增。
选择性扩增引物序列:
EcoRI primers E0-AGC,E0-ACT,E0-ACG,E0-AGG,E0-ACC,E0-ACA,E0-AAG,E0-AAC;
Mse I primers M0-CAG,M0-CTC,M0-CTG,M0-CTT,M0-CTA,M0-CAA,M0-CA T,M0-CAC。
PCR反应为预变性94℃2 min,变性94℃30 s,退火65℃30 s并且每个循环降低0.7℃,延伸72℃80 s,14个循环,接下来按下列参数扩增23轮:94℃30 s,55℃30 s,72℃80 s,最后延伸72℃5 min,产物备用。
1.2.3 电泳及银染
选择性扩增产物加上样缓冲液,变性后通过6%聚丙烯酰胺凝胶进行电泳,分离后用硝酸银染色[13],染色完成后统计结果。
1.2.4 差异片段的回收、克隆及测序
选择有明显差异的条带进行回收,用与原来相同的选择性扩增引物进行第2次扩增,用琼脂糖凝胶电泳检测扩增产物的真实性。
TIANgel Midi Purification Kit回收试剂盒回收纯化目的片段,Promega的p GEM-T载体试剂盒进行回收条带的克隆,所得阳性克隆由上海生工进行测序。
1.2.5 生物信息学分析
对获得序列利用BLASTN和BLASTX程序与网上数据库(NCBI,national center for biotechnology information)进行同源性分析。
2 结果与分析
2.1 RNA的提取结果及cDNA的质量
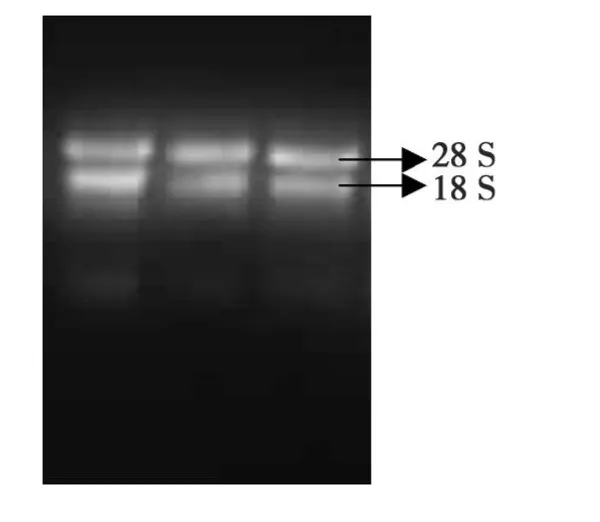
图1 棉花叶片RNA电泳图谱Fig.1.RNA of cotton leaf
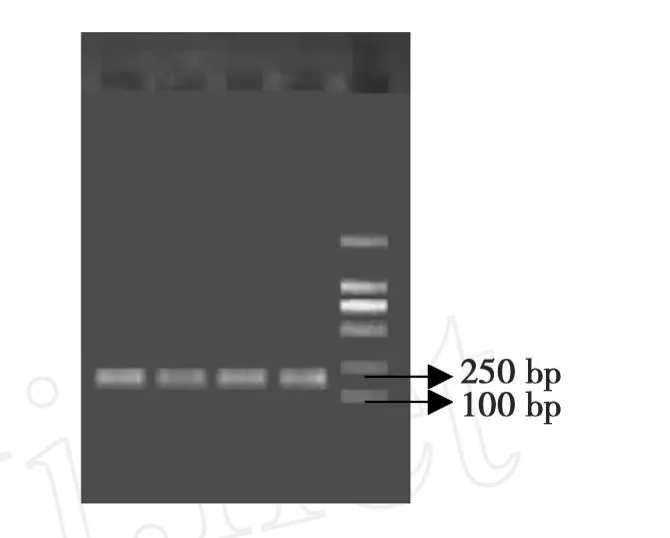
图2 棉花叶片cDNA质量检测Fig.2 cDNA quality of cotton leaf
本实验利用改良的CTAB法提取总RNA,紫外分光光度计测得D260nm与D280nm的比值为1.8~2.0,表明 RNA纯度较高;1.0%琼脂糖检测发现rRNA的 28 S和 18 S条带清晰(图 1),这说明RNA完整性较好,无降解,蛋白质和酚类物质的污染少,能够满足反转录cDNA要求。
以UBI为内参扩增的目的片段,琼脂糖电泳检测在200 bp处出现亮的条带(图2),说明反转录成功,可用于AFLP标记的分析。
2.2 棉花叶片对照、干旱胁迫条件下基因差异表达谱
本实验选取8个 MseI引物和8个 EcoRI引物,组成64个引物组合对其进行了差异表达基因的筛选,图3为部分引物组合的扩增产物,结果表明 E+CC/M+AG、E+CT/M+AG等引物组合可以扩增出较稳定的条带。
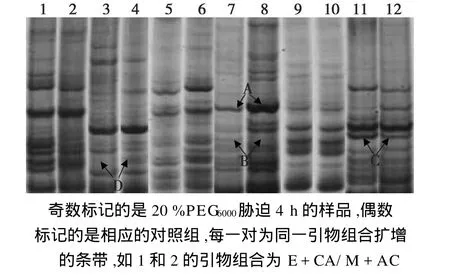
图3 部分引物组合的扩增产物(未列全)Fig.3 Amplified products of several primer pairs
图3 显示了筛选差异片段以下5种情况。
1)在干旱胁迫和对照中的表达无明显差异的,如图3中第9和第10泳道。
2)某一基因在干旱胁迫处理下比在对照条件下减弱,如图3中A指示的谱带。
3)某一基因在干旱胁迫后表达,而在对照情况下没有表达,如图3中B指示的谱带。
4)某一基因在干旱胁迫处理下,比在对照条件下强,如图3中C指示的谱带。
5)某一基因在对照条件下表达,而在干旱胁迫情况下不表达,如图3中D指示的谱带。
2.3 差异表达片段的分析和功能预测
由于cDNA-AFLP技术显示的是植物基因在表达水平上的差异,所以无论扩增的是质的差异还是量的差异,均能正确反应出基因在整个发育阶段的表达变化。
为了能进一步阐明棉花对干旱胁迫条件的适应调节机制,将回收的232条片段进行二次扩增,选择出102条表达稳定的差异条带进行测序,Blast比对结果表明:与已知基因有同源性的片段有45条,约占测序数的44%,另有57条片段与已知基因或序列无任何同源性,可能是因为片段较短或是尚未发现的新基因。
表1列出了与耐旱性密切相关的13个cDNA片段的信息。有些基因只与生物的基本生长和代谢有关,在此未全部列出。

表1 与棉花耐旱性相关的cDNA片段Tab.1 cDNA sequences related to cotton reaction to drought-stress
3 讨论
干旱是作物生产面临的主要环境问题。高等植物对干旱胁迫的耐受性在一定程度上具有相似的分子基础,很多基因的表达受干旱胁迫的诱导并在植物抵抗干旱胁迫中起作用。
本试验利用cDNA-AFLP技术从棉花中克隆了一些与干旱胁迫反应相关的cDNA片段,它们有可能在棉花的耐旱中起重要或决定性作用。
首先得到了几个与胁迫有关的基因片段,如水稻渗透响应蛋白(12号)、反转录转座子蛋白(29号)等。反转录转座子可分为L TR(long terminal repeats)反转录转座子和非L TR反转录转座子[14],其为真核生物中一类可移动因子。反转录转座子的转录可以被多种生物或非生物的逆境所激活,如外伤、细胞培养等[15]。现有的研究证实,植物在逆境胁迫情况下,反转录转座子的活化可以调节植物抗逆相关基因的表达,是植物自我保护的一种反应[16],因此推测转座可能与植物发生防卫反应有关。本研究在干旱条件下表达的1个序列(29号)与黄瓜的反转录转座子蛋白具有较高的同源性,也说明了反转录转座子与植物的抗旱可能有关。但关于反转录转座子在植物抗旱方面的具体机制有待于进一步研究。
其次,分离到一个与离子转运有关的片段(33号),其编码液泡膜A TPase B亚基。学者们[17-19]从棉胚珠中克隆出液泡H+-A TPase(v-ATPase)的A(69 kDa)、B(57 kDa)、c 亚基(16 kDa),这三种亚基以A3B3c6形式组成 H+-ATPase全酶。A亚基和B亚基组成位于液泡膜朝细胞质一侧的Vl部分,A亚基为催化肤,具有水解A TP酶的能力,而B亚基具有调控功能,c亚基为16 kDa的蛋白脂质,构成与膜结合的VO部分,形成一个胞质 H+跨膜进入液泡的通道。当土壤中存在高盐、干旱和重金属等胁迫时,细胞的存活主要依赖V型 H+-ATPase活性的维持和调整[20]。
第三,得到了几个与信号传导途径有关的基因片段,如1,4-α-葡聚糖分支酶(1号)、ATP结合蛋白(3号)、磷脂酰甘油磷脂酶C(61号)。其中磷脂酶C(phospholipase C,PLC)是磷脂酰肌醇信号通路的关键酶,在体内分布极为广泛。许多细胞外信息分子,如激素、神经递质、免疫球蛋白、细胞因子、生长因子等都可以激活磷脂酰肌醇特异性 PLC。活化的PLC能水解磷脂酰肌醇-4,5-二磷酸(PIP2),从而产生2种重要的第二信使(二酯酰甘油(DAG)和三磷酸肌醇(IP3)),进而将细胞外信息传递给下游效应分子,调节细胞的生命活动[21]。另外 PLC与甘油二酯激酶(DGK)协同作用产生磷脂酸(PA),在植物的生长、分化、繁殖等多种生物和非生物胁迫的信号传导中,PA均有调控作用。多种生物和非生物胁迫都可以诱导PA的产生,如病原体的侵入、干旱、盐胁迫及冷害等[22]。
从差异片段中分离到的另外几条片段,如预测蛋白(84号)、假拟蛋白(89号)、非常规肌球蛋白(93号),均在胁迫后增强表达,初步推测与耐旱相关,具体功能有待进一步研究。
本研究克隆分离的13个cDNA特异片段的大小为93~231 bp,片段偏短。其原因可能是本研究所采用的cDNA-AFLP技术中进行cDNA酶切的酶为典型的EcoRⅠ和MseⅠ,这样经过2种酶切成的cDNA模板片段可能较短,要获得更多的信息可以通过 RACE(rapid amplification of cDNA ends)的方法得到全长cDNA序列。
4 结论
本研究利用cDNA-AFLP技术,以棉花耐旱品种晋棉13号幼苗为研究对象,对干旱胁迫早期叶片基因表达进行了mRNA指纹分析。通过64对引物组合的筛选,共分离得到232个差异表达的转录衍生片段(TDFs),对其中102个 TDFs进行了克隆、测序和序列分析。生物信息学分析的结果表明:45个 TDFs与NCBI中已有序列同源,功能涉及信号传导、转录调控以及逆境诱导蛋白等,这为棉花耐旱分子育种的进一步研究奠定了基础。另外有57个TDFs无同源序列或同源性低,因此预测其为一些未知功能基因。相信还有更多未知功能基因有待发现。
[1]Ashraf M,Foolad M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance[J].Environ Exp Bot,2006,59:206-216.
[2]聂新辉,曲延英,尤春源,等.mRNA差异显示分离棉花抗旱耐盐基因的相关cDNA片段[J].新疆农业大学学报,2007,30(4):72-75.
[3]赵红英,祝建波,王爱英,等.HARDY转录因子原核表达的研究[J].石河子大学学报:自然科学版,2009,27(4):397-400.
[4]赵胡.基因差异表达技术及其在植物抗逆基因工程中的研究进展[J].阜阳师范学院学报:自然科学版,2007,24(2):46-51.
[5]Money T,Reader S,Li J Q.AFLP-based mRNA fingerprinting[J].Nucleic Acids Research,1996,24(13):2616-2617.
[6]Cooper B.Collateral gene expression changes induced by distinct plant viruses during the hypersensitive resistance reaction in Chenopodium amaranticolor[J].The Plant Journal,2001,26(3):339-349.
[7]Vander Biezen E A,Juwana H,Parker J E,et al.cDNAAFLP display for the isolation ofPeronospora parasitica genes expressed during infection inA rabidopsis thaliana[J].Molecular Plant-Microbe Interactions,2000,13(8):895-898.
[8]Petters J,Gbel C,Scheel D,et al.A pathogen-responsive cDNA from potato encodes a protein with homology to a phosphate starvation-induced phosphatase[J].Plant Cell Physiology,2002,43(9):1049-1053.
[9]Durrant W E,Rowland O,Piedras P,et al.cDNA-AFLP reveals a striking overlap in race-specific resistance and wound response gene expression profiles[J].The Plant Cell,2000,12:963-977.
[10]戴必胜,杨敏,陈秀虎.霍格兰溶液培养对水仙生长发育的影响[J].武汉植物学研究,2006,24(5):485-488.
[11]蒋建雄,张天真.利用CTAB/酸酚法提取棉花组织总RNA[J].棉花学报,2003,15(3):166-167.
[12]Yue-HuaXiao,Zheng-ShengZhang,Meng-HuiYin,et al.Cotton flavonoid structural genes related to the pigmentation in brown fibers[J].Biochemical and Biophysical Research Communications,2007(358):73-78.
[13]张莉,陈文霞,刘桂伶,等.新疆棉花枯萎病菌7号生理小种的AFLP分析[J].石河子大学学报:自然科学版,2009,27(3)298-301.
[14]王子成,李忠爱,邓秀新.植物反转录转座子及其分子标记[J].植物学通报,2003,20(3):287-294.
[15]Grandbastien M A.Activation of plant retrotransposons under stress condition[J].Trends Plant Sci,1998(3):181-187.
[16]Yosuke K,Yukio T,Saorio S,et al.OARE-1,a Ty1-copia retrotransposon in oat activated by abiotic and biotic stresses[J].Plant Cell Physiol,2001,42:1345-1354.
[17]Wilkins T A.Vacuolar H+-ATPase 69-kilodalton catalytic subunit cDNA from developing cotton(Gossypium hirsutumL.)ovules[J].Plant Physiol,1993,102:679-680.
[18]Wan C Y,Wikins T A.Isolation of multiple cDNAs encoding the vacuolar H+-ATPase subunit B from developing cotton(Gossy pium hirsutumL.)[J].Plant Physiol,1994,106:393-394.
[19]Hasenfratz M P,Tsou C L,Wilkins T A.Expression of two related vacuolar H+-ATPase 16-kilodation proteolipid genes is differentially regulated in a tissue-specific manner[J].Plant Physiol,1995,108:1395-1404.
[20]Dietz K J,Tavakoli N,Kluge C,et al.Significance of the V-type ATPase for the adaptation to stressful growth conditions and its regulation on the molecular and biochemical level[J].Journal of Experimental Botany,2001,52:1969-1980.
[21]刘丽荣,夏时海.磷脂酶C结构及活化机制的研究进展[J].武警医学院学报,2006,15(2):175-177.
[22]袁苑,武玉叶,李德全.植物甘油二酯激酶信号转导作用[J].植物生理学通报,2007,43(6):1009-1014.
Analysis of the Responsive Genes during Drought in Cotton by Means of cDNA-AFLP
DENG Xiaoyan1,LIU Jiangna2,LI Zhibo2,LIU Feifei2,ZHANGJie2,XI Zhongling1,WEI Yinong2
(1 College of Life Science,Shihezi University1,Shihezi 832003,China;2 College of Agriculture,Shihezi University/Key Laboratory of Oasis Ecology Agriculture of Xinjiang Production and Construction Group,Shihezi 832003,China)
S332.1;Q78
A
1007-7383(2010)05-0537-05
2009-12-24
国家自然科学基金项目(30760124)
邓晓艳(1983-),女,硕士生,专业方向为植物遗传;e-mail:shzdxy@sina.com。
魏亦农(1964-),男,教授,从事棉花遗传育种研究;e-mail:weiyinong@163.com。
