桑叶多糖的组成及结构表征
2010-10-19罗晶洁曹学丽
罗晶洁,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
桑叶多糖的组成及结构表征
罗晶洁,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
利用高效凝胶色谱(high performance gel permeation chromatography,HPGPC)分析桑叶多糖两个组分MPL1和MPL2的重均分子质量分别为11800D和7630D,利用GC分析MPL1和MPL2是由D-果糖(D-Flu)、L-阿拉伯糖(L-Ara)、L-鼠李糖(L-Rha)、D-木糖(D-Xyl)和D-葡萄糖(D-Glu)5种单糖组成,其物质的量比分别为58:9.9:5.8:5.1:21.2和45:6.74:17.2:7.3:24.1。而通过高碘酸氧化和Smith降解反应的方法得到MPL1和MPL2的主链是由1→3位键合的糖基组成,支链为1→2位键合的糖基组成。红外光谱分析桑叶多糖中存在α构型的C—H吸收峰。
桑叶多糖;高效凝胶色谱;结构表征;链接方式
Abstract:In the present study, we characterized the composition and structural attributes of two polysaccharide fractions(named MPL1 and MPL2) in mulberry leaves obtained after microwave-assisted extraction and Sephadex G50 purification. The HPGPC analysis showed that the weight-average molecular weights of MPL1 and MPL2 were 11800 D and 7630 D, respectively.According to the GC analysis, both polysaccharide fractions were composed of five monosaccharide, namelyD-Flu,L-Ara,L-Rha,D-Xyl andD-Glu, and their molar ratio was 58:9.9:5.8:5.1:21.2 for MPL1 and 45:6.74:17.2:7.3:24.1 for MPL2. By using the classic methods of periodate oxidation and Smith Degradation reaction, both the backbones of MPL1 and MPL2 were found to consist of 1→3 glycosyl bonds and the side chains consisted of 1→2 glycosyl bonds. C-H absorption peak ofαconfiguration was contained in both polysaccharide fractions according to the IR analysis.
Key words:mulberry leaf polysaccharides;HPGPC;characterization;link mode
桑叶异名铁扇子,为桑科植物桑的干燥叶[1],具有疏散风热、清肝明目、清肺润燥等功效[2],可用于风热感冒、头晕头痛、肺热燥咳、目赤昏花[3]。国内外研究表明,桑叶在调控血糖、防治糖尿病及其并发症方面具有明显的功效[4-6]。桑叶的这些保健功能,多糖在其中起到了相当重要的作用[7-8]。目前国内外对桑叶多糖的研究进展,大多是在桑叶多糖的提取和功效方面有一定的研究[9-11],但鉴于桑叶种类的多样性和多糖结构的复杂性,对其结构的研究则主要集中在一级结构的组成和链接方式上面[12-14]。
本实验利用微波辅助水提取得到桑叶粗多糖,再经过Sephadex-G50分离纯化得到两个不同分子质量的桑叶纯多糖MPL1和MPL2,通过HPGPC、GC、IR以及经典的高碘酸氧化和Smith降解反应对桑叶多糖的分子质量和一级结构进行了表征,以期为今后研究其分子修饰和构效关系提供一定参考。
1 材料与方法
1.1 材料与试剂
桑叶多糖 自制;碘酸钠、高碘酸钠、乙二醇天津光复精细化工研究所;盐酸羟胺 北京红星化工厂;醋酸酐、吡啶、丙三醇 北京化工厂;各种单糖标样(D-Xyl、L-Ara、L-Rha、D-Flu、D-Glu、DMan、D-Gal) 北京拜尔迪生物公司;Sephadex-G50 美国法玛西亚公司;以上试剂均为分析纯。
1.2 仪器与设备
SpectraMax 190型酶标仪 美国MDS公司;Nicolet 380型傅里叶红外光谱仪 美国Nicolet公司;Agilent 6890N型气相色谱仪 美国Agilent公司;LC-20AD型泵、CTO-20A柱温箱 日本岛津公司;DAWN HELEOS-Ⅱ型激光多角度散射检测器、Optilab rex示差检测器 美国Wyatt公司。
1.3 方法
1.3.1 桑叶多糖的dn/dc值及其重均分子质量的测定
dn/dc是衡量生物大分子在不同溶液中的一个技术参数,它具体是指其在溶液中的折光率随着浓度变化的比值,从这个值可以大致的判断大分子的种类。另外,dn/dc值是激光散射法测定重均分子质量一个必不可少的参数,它的大小将会直接影响到分子质量的大小。dn/dc值的测定方法:分别配制5个不同浓度梯度的桑叶多糖样品,利用示差检测器测定dn/dc值。
分子质量测定方法:利用HPGPC检测。色谱条件:色谱柱:Shodex SB-803(300mm×8mm);流动相:0.1mol/L的NaCl溶液,流速0.5mL/min;柱温箱温度:40℃,进样体积200μL;检测器:多角度激光散射检测器和示差检测器。
1.3.2 桑叶多糖的单糖组成分析
水解:将桑叶多糖MPL1和MPL2溶解于2mol/L三氟乙酸(TFA)10mL,于110℃水解2h后,减压蒸干。加适量甲醇,减压蒸干,重复两次以除尽三氟乙酸TFA,置真空干燥箱减压干燥过夜。
乙酰化:将水解后的产物和各种单糖标样(D-Xyl、L-Ara、L-Rha、D-Flu、D-Glu、D-Man、D-Gal)加无水吡啶1.0mL,无水醋酸酐1.0mL,封管后置于100℃水浴反应60min,减压蒸干,加0.5mL氯仿溶解,进行气相色谱分析。
色谱条件:色谱柱:Agilent HP-5(30m×0.32mm);进样口温度:250℃;检测器:FID;检测器温度:250℃;升温程序:初温50℃,20℃/min升温到190℃,3℃/min,升温到250℃;载气:N2,流速:1.0mL/min。
1.3.3 桑叶多糖链接方式的确定
1.3.3.1 高碘酸氧化
高碘酸钠消耗量标准曲线的制作:将0.15mo1/L的高碘酸钠和碘酸钠溶液以不同比例混合,取混合液0.4mL置于100mL容量瓶中用水稀释至刻度,在波长223nm处测定吸光度[15],以高碘酸的浓度为横坐标,吸光度为纵坐标,得到高碘酸钠消耗量的标准曲线。
称取桑叶多糖MPL1和MPL2各30mg,置于250mL棕色瓶中,加入0.015mol/L NaIO460mL,加塞置于4℃冰箱黑暗处氧化,每隔一定时间取样,每次取样0.2mL并用水稀释至50mL,再测定波长223nm处吸光度,直至吸光度基本稳定。通过标准曲线计算每摩尔糖基消耗的高碘酸摩尔数,同时取样5.0mL,加2滴乙二醇,放置20min,以酚酞为指示剂,用0.0086mol/L NaOH标准液滴定甲酸的生成量。
1.3.3.2 Smith降解反应
经高碘酸氧化后的多糖溶液,加入乙二醇4mL,搅拌30min终止反应。去离子水透析48h,减压浓缩至小体积。加入100mg NaBH4,暗处放置24h。调节反应液pH值至5.5左右,透析除去过量的NaBH4,冷冻干燥得到多糖醇产物[15]。将多糖醇产物采用1.3.2节的方法进行气相色谱分析。
1.3.4 桑叶多糖的红外图谱分析
将桑叶多糖MPL1和MPL2,经过KBr压片,用红外光谱仪扫描得到红外图谱。
2 结果与分析
2.1 桑叶多糖的dn/dc值及分子质量的测定
将桑叶多糖配制成1.2、1.6、2.0、2.4、2.8、3.2mg/mL的溶液,示差检测器检测,如图1所示。以图1中各个台阶信号强度的大小为纵坐标,每个台阶对应的质量浓度为横坐标,描点作图,并线性回归,所得斜率即为dn/dc值,即图2所示。结果表明:桑叶多糖的dn/dc值为(0.1305±0.0017)mL/g,R2=0.999。

图1 桑叶多糖dn/dc值测定色谱图Fig.1 dn/dc Chromatogram of mulberry leaf polysaccharides

图2 dn/dc值的计算Fig.2 dn/dc calculation
将桑叶多糖MPL1和MPL2上HPGPC进行测定,其结果如图3、4所示。其中,(1)显示的是Optilab rex示差检测器的信号,它测定的是各个组分浓度的变化,将各个峰手动积分,根据峰面积的大小即可计算出各个组分的纯度;(2)显示的DAWN HELEOS-Ⅱ型激光多角度散射检测器的信号,它测定的是各个组分分子质量的大小。结果表明:MPL1重均分子质量MW为11800D,纯度为94.55%,多分散性系数为1.25,MPL2重均分子质量MW为7630D。纯度为96.64%,多分散性系数为1.12。

图3 MPL1 GPC色谱图Fig.3 GPC Chromatogram of MPL1

图4 MPL2 GPC色谱图Fig.4 GPC Chromatogram of MPL2
2.2 桑叶多糖单糖组成分析

图5 7种单糖标样气相色谱图Fig.5 GC Chromatogram of mixed seven monosaccharide standards
将各种单糖标样和桑叶多糖MPL1和MPL2乙酰化的产物,经气相色谱分析,其结果如图5~7所示。结果表明:MPL1由D-Flu、L-Ara、L-Rha、D-Xyl和DGlu组成,其物质的量比分别为58:9.9:5.8:5.1:21.2。MPL2单糖组成和MPL1相同,但物质的量比不同,分别为45:6.74:17.2:7.3:24.1。

图6 MPL1单糖组成气相色谱图Fig.6 GC Chromatogram of MPL1 monosaccharide composition
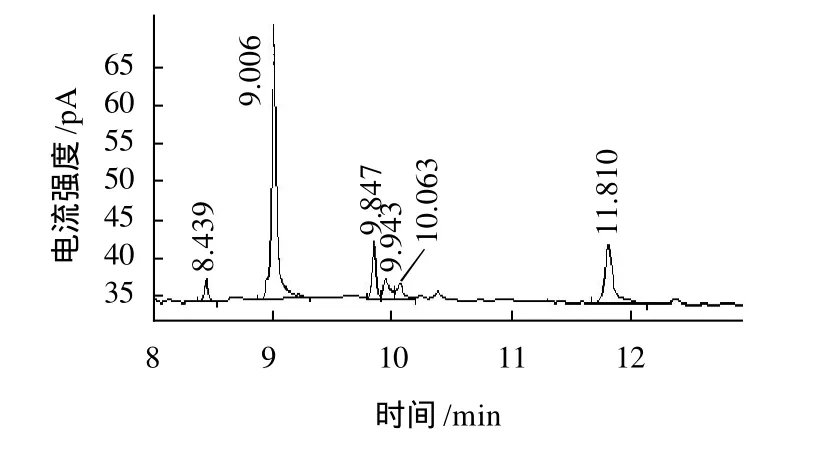
图7 MPL2单糖组成气相色谱图Fig.7 GC Chromatogram of MPL2 monosaccharide composition
2.3 高碘酸消耗量标准曲线
将碘酸钠和高碘酸钠以不同比例混合后,波长223nm处测定吸光度,得高碘酸消耗量标准曲线,结果如图8所示。

图8 高碘酸消耗量标准曲线Fig.8 Standard curve of periodic acid consumption
2.4 高碘酸氧化
将桑叶多糖MPL1和MPL2分别溶于0.015mol/L的高碘酸钠溶液中,分别在第1、3、5、7天测定吸光度,反应到第5天时达到平衡,代入标准曲线,计算高碘酸的消耗量。计算结果如表1所示。

表1 桑叶多糖MPL1和MPL2高碘酸氧化结果Table 1 Experimental data of periodate oxidation reaction of MPL1 and MPL2
从表1可以看出,反应生成了微量的甲酸,说明结构中存在微量以1→6位键合的糖基,而高碘酸的消耗量大大多于甲酸消耗量,说明结构中存在大量的以1→2或者1→4位键合的糖基。
2.5 Smith降解反应
经过高碘酸氧化得到的产物,还原得到多糖醇产物,再通过水解和乙酰化,经气相色谱分析产物,结果如图9、10所示。结果表明:MPL1产物甘油和葡萄糖的物质的量比为26.7:73.3,MPL2产物甘油和葡萄糖的物质的量比为57.2:42.8,检测出甘油说明结构中存在大量以1→2或者1→6位键合的糖基,而高碘酸氧化的结果显示1→6位键合的糖基仅微量的存在,因此可以推断出该结构中存在1→2位键合的糖基。产物中还检测到了大量的葡萄糖的存在说明主要存在以1→3位键合的糖基,MPL1中1→2 位键合糖基与1→3键合糖基物质的量比为0.18:1,MPL2中1→2 位键合糖基与1→3键合糖基物质的量比为0.66:1,因此可以推断出桑叶多糖的主干为1→3位键合的糖基,而1→2位键合的糖基存在于分子的支链,1→6位键合的糖基位于分子的末端。

图9 MPL1 Smith反应气相色谱图Fig.9 GC Chromatogram of the Smith reaction products of MPL1
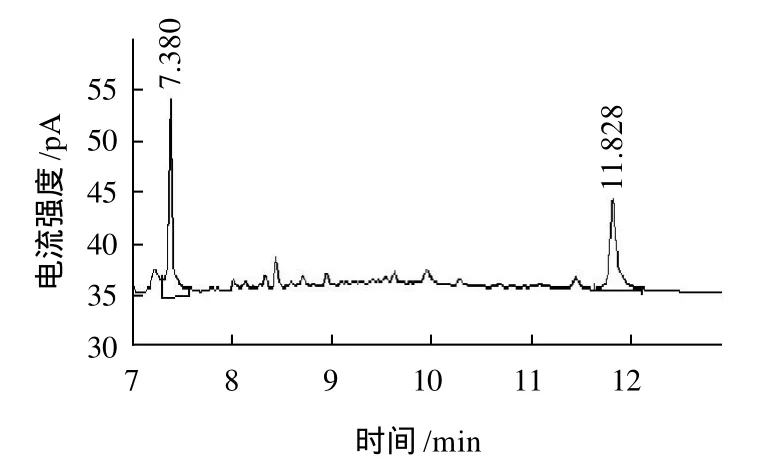
图10 MPL2 Smith反应气相色谱图Fig.10 GC Chromatogram of the Smith reaction products of MPL2
2.6 桑叶多糖红外光谱分析

图11 MPL1红外光谱图Fig.11 IR Chromatogram of MPL1

图12 MPL2红外光谱图Fig.12 IR Chromatogram of MPL2
由图11、12分析可知,3428cm-1左右出现的宽峰是糖类物质O—H和分子内或者分子间氢键的伸缩振动,1670cm-1为乙酰基的酰胺基团吸收峰,1384cm-1则很可能是C—H的变角振动吸收峰,1060cm-1则可能是C—O—C或者C—O伸缩振动吸收峰,835cm-1为C—H的α构型吸收峰。
综上所述,MPL1的主链重复单元可能为:→3)-α-D-Glu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→3) -α-D-Flu-(1→3)-α-D-Glu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→3)-α-D-Glu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→;支链重复单元可能为:2→)-α-D-Xyl-(1→2)-α-L-Rha-(1→2)-α-L-Ara-(1→2)-α-L-Ara-(1→。
MPL2的主链重复单元可能为:→3)-α-D-Glu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1→3)α-D-Glu-(1→3)-α-D-Flu-(1→3)-α-D-Flu-(1;支链重复单元可能为:→2)-α-L-Ara-(1→2)-α-D-Xyl-(1→2)-α-L-Rha-(1→2) -α-L-Rha- (1→。
3 结 论
本实验采用了HPGPC对桑叶多糖的dn/dc值以及分子质量进行了测定,结果表明桑叶多糖的dn/dc值为0.1305mL/g,MPL1的重均分子质量为11800D,纯度为94.55%,多分散性系数为1.25,MPL2的重均分子质量为7630D,纯度为96.64%,多分散性系数为1.12。利用GC对单糖组成进行了分析,MPL1和MPL2均由D-果糖(D-Flu)、L-阿拉伯糖(L-Ara)、L-鼠李糖(L-Rha)、D-木糖(D-Xyl)和D-葡萄糖(D-Glu)组成,其物质的量比MPL1为58:9.9:5.8:5.1:21.2。MPL2为45:6.74:17.2:7.3:24.1。高碘酸氧化和Smith降解反应表明桑叶多糖的主干为1→3位键合的糖基,而1→2位键合的糖基存在于分子的支链,1→6位键合的糖基可能位于分子的末端。IR结果显示其结构为α构型。
[1] 国家药典委员会. 中国药典[M]. 北京:中国医药科技出版社, 2005.
[2] 江苏新医学院. 中药大辞典:下册[M]. 上海:上海科学技术出版社,1999:1963.
[3] 王小伙, 郭金, 王军文. 桑茶的营养和药理初探[J]. 蚕桑茶叶通讯,2000(3):32-34.
[4] KIM S. Antionxiative flavonoids from the leaves ofMorus alba[J]. Arch Pharm Res, 1999, 208:108-109.
[5] LIN H Y, LAI L S. Isolation and viscometric characterization of hydrocolloids from mulberry (Morus albaL.) leaves[J]. Food Hydrocolloids, 2009, 23(3):840-848.
[6] 野田信三. 桑叶功能性研究[J]. 食品科学, 1998, 19(2):102-108.
[7] ASANO N, OSEKI K, TOMIOKA E, et al.N-containing sugars fromMorus albaand their glycosidase inhibitory activities[J]. Carbohydr Res, 1994, 259(9):243-248.
[8] 陈福君, 卢军, 张兵煌. 桑叶降糖有效组分对糖尿病动物代谢的影响[J]. 沈阳药科大学学报, 1996, 13(1):24-27.
[9] 薛长勇, 腾俊英, 邱继红. 桑叶多糖肽复合物的降血糖作用[J]. 营养学报, 2005, 27(2):167-168.
[10] KIMURA M, CHEN F, NAKASHIMA N, et al. Antihyperg1ycemic effects ofN-containing sugars derived from mulberry leaves in streptozocininduced diabetic mice[J]. Wakan Iyakugaku Zasshi, 1995, 12(3):214-219.
[11] 王芳, 郑海雪. 桑叶多糖的提取工艺研究[J]. 浙江师范大学学报,2008, 31(1):77-79.
[12] 夏玮, 张文清. 桑叶多糖SJB的结构分析和蛋白酪氨酸磷酸酯酶PTP1B抑制活性[J]. 高等学校化学学报, 2008(11):2205-2208.
[13] 夏玮, 刘书琦, 沈方红, 等. 桑叶中多糖的结构性质研究[J]. 中国药学杂志, 2009, 44(2):99-102.
[14] 赵明, 常钰, 王佩香, 等. 桑叶多糖PMP12的分离纯化及结构初步分析[J]. 江苏大学学报:医学版, 2010, 20(2):153-155.
[15] 张惟杰. 糖复合物生化研究技术[M]. 上海:上海科学技术出版社,1999:89-95.
Composition and Structure Characterization of Two Mulberry Leaf Polysaccharide Fractions
LUO Jing-jie,CAO Xue-li*
(Beijing Key Laboratory of Plant Resources Research and Development, College of Chemical and Environmental Engineering,Beijing Technology and Business University, Beijing 100048, China)
TS201.23
A
1002-6630(2010)17-0136-05
2010-06-30
罗晶洁(1985—),男,硕士研究生,研究方向为生物分离工程。E-mail:luojingjie268@163.com
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离技术。E-mail:caoxl@th.btbu.edu.cn
