重组人kallistatin蛋白在毕赤酵母中的高效表达及生物活性分析
2010-10-16黄晓平王晓董浩赵小峰李招发王启钊许瑞安刁勇
黄晓平,王晓,董浩,赵小峰,李招发,2,王启钊,2,许瑞安,2,刁勇,2
1 华侨大学分子药物学研究所,泉州 362021 2 分子药物教育部工程研究中心,泉州 362021
重组人kallistatin蛋白在毕赤酵母中的高效表达及生物活性分析
黄晓平1,王晓1,董浩1,赵小峰1,李招发1,2,王启钊1,2,许瑞安1,2,刁勇1,2
1 华侨大学分子药物学研究所,泉州 362021 2 分子药物教育部工程研究中心,泉州 362021
为了研究kallistatin(Kal)的生物活性,本实验构建了可分泌表达Kal的毕赤酵母菌株。首先通过PCR方法从pAAV-Kal中扩增出Kal cDNA,并克隆至酵母表达载体pPIC9,得到甲醇酵母分泌型表达载体pPIC9-Kal,然后将载体线性化并电击转化毕赤酵母GS115(his4),通过MD平板筛选出阳性表达菌株。阳性表达菌株在BMMY培养基(pH 7.0)中29℃培养,经2%甲醇诱导表达96 h,摇瓶表达量可达14 mg/L。表达上清经Phenyl Superose、Heparin Sepharose FF分离纯化,目的蛋白纯度达到98%,分子量为58 kDa。生物活性实验显示,所得到的Kal蛋白具有较好的抗氧化活性,过氧化物酶活性达到(163±4)U/(mg·min),可有效降低H2O2对LX-2细胞的氧化损伤。另外,重组产生的Kal还能抑制HUVEC细胞的增殖。本研究首次成功地利用毕赤酵母表达系统分泌表达了有生物活性的Kal,为继续开展其抗肿瘤活性奠定了基础。
kallistatin,毕赤酵母,表达,活性
Abstract:In order to research the bioactivity of kallistatin(Kal), we obtained the recombinant Kal using Pichia pastoris expression system.Kal cDNA was amplified from pAAV-Kal and inserted into pPIC9 vector to generate a recombinant vector of pPIC9-Kal.Then, pPIC9-Kal was linearized and transformed into Pichia pastoris strain GS115(His4)by electroporation.The positive transformants were selected by MD plate and confirmed by PCR.High level of Kal was obtained in BMMY medium(pH 7.0)after 96 hours induction of 29°C and 2% methanol, with the highest yield of 14 mg/L in shake flask culture.Kal protein was purified from the supernatant with Phenyl Superose and Heparin Sepharose FF chromatograph.The recombinant Kal had a molecularweight of 58 kDa with 98% purity, showing by SDS-PAGE.Moreover, it had a high peroxidase activity(163±4)U/(mg·min), which could protect LX-2 cell against oxidation of H2O2.Recombinant Kal also effectively inhibited HUVEC proliferation.In this report,we successfully established the expression system using Pichia pastoris and obtained the bioactive recombinant human Kal.It lays a foundation for its further anti-cancer therapy.
Keywords:kallistatin, Pichia pastoris, expression, activity
Kallistatin(Kal)是由401个氨基酸组成、分子量为58 kDa的内源性蛋白,具有多种生物学活性,如降血压[1]、舒张血管[2]、促进血管新生内膜的形成[3]、抗炎[4]和抗氧化[5]等。最近的研究表明,Kal具有广谱的抗肿瘤活性,符合抗肿瘤药物应具有多靶点和多信号通路阻断的要求,值得深入开发。其抗血管生成作用与已上市药物内皮抑素(Endostatin)类似,可以与VEGF和bFGF等生长因子竞争结合硫酸肝素糖蛋白(HSPGs)受体,因此可阻断这些生长因子引发的血管生成。本课题组发现,在Kal的作用下,肿瘤细胞中作为细胞增殖的标志物Ki-67染色降低,显示 Kal可以直接抑制肿瘤细胞增殖[6]。Kal可以从不同途径抑制血管生成,是肿瘤抗血管生成治疗的良好候选者,又可以直接作用于肿瘤细胞,抑制肿瘤细胞增殖,是一种广谱的抗肿瘤内源性因子。
1989年Chao等[7]首次从人血浆中分离出 Kal蛋白,并鉴定其为激肽释放酶(Kallikrein)抑制蛋白,主要功能集中于心血管系统,如降血压、舒张血管、促进血管新生内膜形成等。1993年Chao等[8]曾采用大肠杆菌表达Kal重组蛋白,但表达量很低。之后进行的 Kal的功能研究,基本上均采用基因转导的方法进行。在最近一篇有关 Kal抗炎和抗氧化的研究论文中,Chao等提议应开展Kal蛋白的功能研究[4]。
自从 2002年Miao等[6]首次报道 Kal具有抑制新生血管生成,并抑制肿瘤生长的作用后,其抗肿瘤活性引起广泛的关注。本课题组采用基因治疗的方法,进行了大量的 Kal抗肿瘤作用的研究,发现Kal基因药物具有广谱的抗肿瘤活性,既可以抑制肿瘤新生血管的形成[9-10],又可以直接诱导肿瘤细胞的凋亡,具有很好的开发前景。但研究采用的方法均为基因治疗手段,而基因治疗一般需要采用病毒载体,其长期应用的风险是各国卫生部门重点关注的问题,目前尚不明朗,很难在短期内实现上市并广泛应用于肿瘤病人。而多种重组蛋白药物已广泛地应用于临床,相关技术比较成熟,是开发基因重组药物最常规的手段。所以本实验试图建立一种高效生产 Kal重组蛋白的方法,研究其蛋白形式对肿瘤的作用,为新型抗肿瘤药物的开发奠定基础。
本课题组也曾用E.coli表达人Kal蛋白,但表达量极低,且杂蛋白多难以纯化。毕赤酵母表达系统是近年来建立起来的一种真核表达系统,已成功地表达了大量的重组蛋白[11],它既具有原核表达系统繁殖快、操作简单的优点,同时又具有原核表达系统所没有的优势:如能对表达的目的蛋白进行正确加工、折叠及适度糖基化,分泌表达的杂蛋白少,易于分离纯化等,因此越来越广泛地用于重组蛋白的表达。国内外文献尚未有利用毕赤酵母表达 Kal蛋白的报道。本研究利用毕赤酵母表达人Kal蛋白,以克服用E.coli表达人Kal蛋白遇到的表达量小、杂蛋白多难以纯化的困难。所表达纯化的人 Kal蛋白能有效地抑制血管内皮细胞 HUVEC的增殖,且表现出很好的过氧化物酶等生物活性,有望进行深度的抗肿瘤药物开发研究。
1 材料与方法
1.1 材料
E.coli DH5α、GS115(His4)、pPCI9 和 pAAV-Kal均为本实验室保存。血管内皮细胞(HUVEC)购自ScienCell。T4 DNA连接酶为NBI公司产品。Xho I、EcoR I、Stu I等内切酶购自大连宝生物公司。凝胶回收试剂盒购自OMGE公司。酵母氮基(含硫酸铵/无氨基酸Yeast Nitrogen Base)购自BD公司。D-生物素、D-山梨醇(D-Sorbitol)购自Sigma公司。层析介质Heparin Sepharose FF、Phenyl Superose均购自Amersham Pharmacia Biotech(GE)公司。鼠抗人kallistatin单抗、山羊抗鼠二抗均购自Santa Cruz。ELISA试剂购自R & D公司。
1.2 方法
分子生物学操作参见《细胞生物技术实验指南》[11],酵母发酵操作参见Invitrogen公司的Pichia Fermentation Process Guidelines操作手册,纯化介质的使用参见GE公司的实验手册。
1.2.1 表达载体pPIC9-kal的构建
选用pAAV-Kal为模板,上游引物HK-F5: 5′-aac ctcgag aaaagagatggtgagagttgcagtaacagct-3′(下 划 线部分为Xho I酶切位点)和下游引物HK-R5:5′-ccag aattc ctatggtttcgtggggtcgacgacc-3′(下 划 线 部 分 为EcoR I酶切位点),用Pyrobest DNA聚合酶,经PCR得到人Kal成熟蛋白对应的DNA。目的片段回收、酶切后插入至pPIC9载体的Xho I/EcoR I位点之间。转化后经菌落PCR、酶切等方法筛选出符合要求的阳性克隆,委托大连宝生物公司对pPIC9中插入的Kal基因序列进行测序。
1.2.2 工程菌株的构建与鉴定
pPIC9-Kal表达载体经Stu I线性化,电转化毕赤酵母GS115(His4)宿主菌,涂布MD平板,菌落PCR鉴定。将阳性克隆接种于含有3 mL BMMY酵母培养液的试管中,培养24 h,用2%甲醇诱导48 h,ELISA法测定目的蛋白含量。发酵上清液经SDS-PAGE分离后电转至硝酸纤维素膜上,用封闭液封闭2 h,滴加一抗室温孵育2 h,洗涤液洗3次,滴加二抗室温孵育 2 h,洗涤液洗 3次,最后使用BeyoECL荧光检测试剂检测目的蛋白,X胶片曝光后显影、定影。
1.2.3 发酵条件的优化
对筛选出的阳性菌株进行发酵培养基、pH、培养时间、甲醇浓度等条件的优化,以得到摇瓶内最佳发酵工艺,为在反应器内批量生产奠定条件。
1.2.4 Kal蛋白的分离纯化
发酵上清液经硫酸铵溶液(终浓度 1.5 mol/L)预处理后,通过疏水作用(Phenyl Sepharose)及肝素亲和(Heparin Sepharose FF)两步层析得到 Kal蛋白,SDS-PAGE电泳检测纯度。
1.2.5 表达产物活性分析
1)Kal蛋白对血管内皮细胞HUVEC增殖的影响:采用DMEM培养基(含10% FBS)培养HUVEC细胞,待细胞丰度达到80%,以0.25%胰酶消化,制备成1×105细胞/mL的细胞悬液,接种至96孔板,100 µL/孔。贴壁后按照设置的浓度梯度加入Kal蛋白,孵育48 h后MTT法检测细胞存活率。
2)Kal蛋白过氧化物酶活性的测定:利用愈创木酚法测定重组 Kal蛋白的过氧化物酶活性。将波长470 nm处反应体系每分钟吸光值A变化0.01定义为一个过氧化物酶活性单位(U/(mg·min))。实验重复3次,得出纯化后的重组Kal蛋白过氧化物酶活性。
3)Kal蛋白抗氧化作用:利用H2O2对LX-2细胞的氧化模型来研究 Kal蛋白抗氧化作用。以DMEM培养LX-2至丰度达到80%,0.25%胰酶消化,制备成1×105细胞/mL的细胞悬液,接种至 96孔板,每孔100 µL。贴壁后按照设置的浓度梯度分别加入Kal蛋白和GSH,随后加入H2O2(终浓度为300 µmol/L)氧化刺激,培养48 h后MTT法检测细胞存活率。
2 结果与分析
2.1 表达载体pPIC9-Kal的构建与鉴定
PCR法从pAAV-Kal中扩增人Kal基因序列,回收DNA片段长度约1200 bp,与预计值相符。Xho I/EcoR I酶切PCR产物与pPIC9载体连接并转化至E.coli DH5α感受态细胞;菌落PCR、质粒酶切图谱(图1)及测序结果显示pPIC9-Kal重组质粒构建成功。
2.2 工程菌株的构建与筛选
pPIC9-Kal经 Stu I线性化后,电转化 GS115(His4)宿主菌,涂布MD平板,经菌落PCR扩增出1200 bp片段的菌落为阳性克隆(图2)。阳性克隆按甲醇酵母发酵的常规方法进行发酵。3个候选克隆的发酵液经ELISA法测定,均检出Kal蛋白的表达,其中 1个克隆表达水平较高,其发酵液经 Western blotting分析,呈现Kal表达阳性结果(图3),而未转化的GS115/pPIC9菌落未检出Kal。

图1 重组表达质粒pPIC9-Kal的PCR和酶切鉴定Fig.1 Identification of recombinant expression vector pPIC9-Kal by PCR and enzyme digestion.1: DNA ladder; 2: pPIC9-Kal digested with EcoR I and Xho I; 3: pPIC9-Kal digested with EcoR I; 4: pPIC9-Kal; 5−7: PCR products of pAAV-Kal, E.coli DH5α/pPIC9-Kal, and pPIC9-Kal.

图2 菌落PCR法鉴定GS115(His4)阳性转化子Fig.2 GS115(His4)positive transformants identified by PCR.1: DNA ladder; 2: pAAV-Kal cDNA; 3−5: GS115/pPIC9-Kal cDNA; 6: GS115/pPIC9 cDNA.

图3 Western blotting鉴定发酵液中的Kal蛋白Fig.3 Western blotting analysis of Kal expression in fermentation supernatant.1: sample from GS115 /pPIC9; 2: sample from GS115/pPIC9-Kal.
2.3 发酵条件的优化
2.3.1 培养基
选取 BMM和 BMMY两种常用培养基进行培养,将培养上清进行电泳分离,BMMY培养基的上清液可见清晰的Kal条带,而 BMM培养基的上清液中Kal蛋白条带非常模糊。经ELISA测定BMM、BMMY培养基中的Kal表达水平见表1。可能由于BMM培养基缺少胰蛋白胨和酵母浸膏,导致水解蛋白酶将诱导表达的Kal蛋白水解。
2.3.2 pH值
选用不同pH的BMMY培养基进行发酵,ELISA测得发酵上清液中 Kal蛋白含量(表 2)。可见该菌种表达的最佳pH值为7.0。
2.3.3 甲醇浓度
选用不同浓度的甲醇诱导 Kal蛋白的表达,ELISA法测得发酵上清液 Kal蛋白含量(表3)。可见诱导Kal蛋白表达的最佳甲醇浓度为2%。
2.3.4 发酵时间
在不同的发酵时间取样,ELISA法测定发酵上清中Kal蛋白含量。随着发酵时间的延长,Kal的表达逐渐增加,产物的时间积累效果显著,在96 h达到最高水平(图4),之后上清中杂蛋白条带增多,Kal蛋白含量降低(图5)。
表1 培养基成份对Kal蛋白表达量影响(±s,n=3)Table 1 Effect of culture medium on the expression of Kal(±s, n=3)

表1 培养基成份对Kal蛋白表达量影响(±s,n=3)Table 1 Effect of culture medium on the expression of Kal(±s, n=3)
Medium Kal concentration(mg/L)BMM 4.6±0.9 BMMY 13.6±1.2
表2 pH对Kal蛋白表达量影响(±s,n=3)Table 2 Effect of pH on the expression of Kal(±s, n=3)

表2 pH对Kal蛋白表达量影响(±s,n=3)Table 2 Effect of pH on the expression of Kal(±s, n=3)
pH Kal concentration(mg/L)5.0 5.4±0.8 6.0 8.0±1.2 7.0 14.0±1.4 8.0 12.2±0.7
表3 甲醇浓度对Kal蛋白表达影响(±s,n=3)Table 3 Effect of methanol concentration on the expression of Kal(±s, n=3)

表3 甲醇浓度对Kal蛋白表达影响(±s,n=3)Table 3 Effect of methanol concentration on the expression of Kal(±s, n=3)
Methanol concentration(%)Kal concentration(mg/L)0.25 1.8±0.5 0.5 3.5±0.6 1 9.5±1.1 2 13.8±1.1

图4 发酵时间对重组Kal蛋白表达的影响(±s, n=3)Fig.4 Effects of fermentation time on the expression of Kal(±s, n=3).

图5 发酵时间对重组Kal蛋白表达的影响Fig.5 Effects of fermentation time on the expression of Kal,the arrow indicates the band of Kal.1: protein marker; 2:GS115/pPIC9 incubated for 96 h; 3–7: GS115/pPIC9-Kal incubated for 24 h, 48 h, 72 h, 96 h and 120 h, respectively.
2.4 Kal蛋白的纯化条件
Kal蛋白纯化过程包括发酵上清液的硫酸铵预处理和连续的两步层析:预处理后的上清液经过Phenyl Superose介质疏水层析,平衡缓冲液为20 mmol/L Tris-HCl,1.5 mol/L 硫酸铵,pH 6.0,用缓冲液(20 mmol/L Tris-HCl,0.4 mol/L硫酸铵,pH 6.0)洗脱;洗脱液透析后经过Heparin Sepharose FF介质亲和层析,用缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 6.0)洗脱,此步洗脱液经过透析后过滤除菌就得到Kal蛋白原液。纯化的Kal蛋白经Western blotting鉴定为阳性,用ELISA测定Kal蛋白原液浓度为0.404 mg/L。通过该纯化工艺,可以从每升发酵上清中获得7 mg纯度大于98%的Kal蛋白。纯化过程中Kal蛋白产物的纯度分析见图6。
2.5 活性分析
2.5.1 对血管内皮细胞HUVEC增殖的影响
将 HUVEC细胞(1×105细胞/mL)接种至 96孔板,每孔100 µL,细胞贴壁后加入重组Kal蛋白,培养48 h 后MTT法检测细胞活性。结果发现,3 µmol/L Kal蛋白组抑制率为55%±3%,1.5 µmol/L Kal蛋白组抑制率为25%±3%,0.75 µmol/L Kal蛋白组抑制率为12%±3%,表现出量效关系,阳性对照药内皮抑素(3 µmol/L)抑制率为 35%±4%(图7)。
2.5.2 过氧化物酶活性
利用愈创木酚法测得纯化后的 Kal蛋白的过氧化物酶的比活为(163±4)U/(mg·min)。
2.5.3 抗氧化作用
将 LX-2细胞(1×105细胞/mL)接种至 96孔板,每孔 100 µL,贴壁后加入 Kal蛋白(终浓度0.6 µmol/L和 0.2 µmol/L),阳性对照组加入 GSH(0.6 µmol/L),随后加入 H2O2(终浓度 300 µmol/L)。12 h后阴性对照组细胞变圆、死亡,而加入Kal蛋白和GSH的细胞状态良好。培养48 h后经MTT法检测,结果阴性对照组细胞存活率为 51%±5%,而加入0.6 µmol/L Kal蛋白组细胞存活率为102%±10%,加入0.6 µmol/L GSH组细胞存活率为85%±7%(图8)。
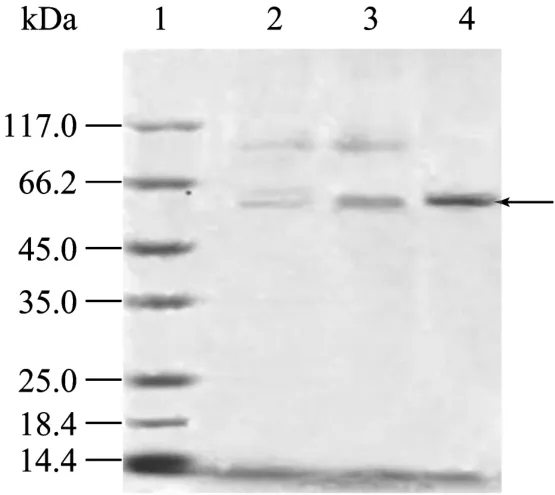
图6 SDS-PAGE法分析纯化过程中重组Kal蛋白的纯度Fig.6 SDS-PAGE analysis of different products from Kal purification process.1: protein marker; 2: fermentation supernatant of GS115/pPIC9-Kal; 3: purified of Phenyl Superose; 4: purified of Heparin Sepharose FF.

图7 Kal蛋白对HUVEC细胞增殖的影响Fig.7 Effects of Kal protein on HUVEC cell proliferation.1: normal control; 2: 0.6 µmol/L Kal; 3: 1.5 µmol/L Kal;4: 3 µmol/L Kal; 5: 3 µmol/L endostatin.

图8 Kal蛋白的抗氧化作用Fig.8 The antioxidation of Kal protein.1: normal control; 2:300 µmol/L H2O2; 3: 300 µmol/L H2O2and 0.6 µmol/L GSH; 4:300 µmol/L H2O2and 0.2 µmol/L Kal; 5: 300 µmol/L H2O2and 0.6 µmol/L Kal.
3 讨论
本实验首次选择毕赤酵母表达系统,采用廉价的BMMY培养基成功分泌表达Kal蛋白。由于毕赤酵母自身分泌的蛋白成分少,下游纯化非常方便,克服了采用大肠杆菌表达量小、表达后需要经过离心收集菌体和超声破碎细胞才能获得表达蛋白的缺点,降低了生产成本,且纯度也可以达到更高。表达上清经疏水和肝素亲和层析即可得到纯度达98%的目的蛋白。
本试验得到的Kal分子量约为58 kDa,与从人血浆中纯化得到的Kal蛋白基本吻合,分子量要比大肠杆菌表达的Kal蛋白(40 kDa)大。这种差异可能是由于毕赤酵母表达的Kal蛋白具有一定程度的糖基化。
本试验初步的活性研究表明 3 µmol/L 重组Kal蛋白对血管内皮细胞的增殖作用与内皮抑素类似[11],也具有较好的抗氧化活性,与Kal可以抑制H2O2诱导的胞内过氧化物形成的报道一致[12]。
肿瘤生长依赖于血管生成,通过抑制肿瘤血管生成从理论上就能够饿死肿瘤细胞,并且阻止肿瘤的转移。研究人员建立了一系列模型对饿死肿瘤的假说进行了验证,并在实验基础上奠定了整个肿瘤新生血管生成的框架。Kal可以抑制肿瘤新生血管的形成[7-8],Kal不仅可以抑制VEGF或bFGF诱导的体外培养血管内皮细胞的增殖、迁移和粘附,还可以抑制小鼠皮下埋植 Matrigel Plug中经 VEGF或bFGF诱导的毛细血管密度和血红蛋白含量,是一种极具开发潜力的新型血管生成抑制蛋白,日益受到药物研究人员的关注。本研究所制备的重组 Kal蛋白能有效抑制血管内皮细胞的增殖,表明其具有抑制肿瘤新生血管形成的能力,而且其活性与已上市药物内皮抑素基本类似。
肿瘤的发生发展都与体内的氧化系统有关,体内的氧化物质过度积累使细胞膜脂质过氧化而破坏细胞的 DNA而引起肿瘤的产生。实验证实抗氧化剂对多种肿瘤的生长有抑制作用,对肿瘤细胞凋亡则有促进作用[13]。其机制一方面可能是抗氧化剂封闭自由基在肿瘤细胞增殖中的信号传导;另一方面是它们通过提高非特异免疫增加了NO的释放,因此直接抑制肿瘤细胞的增殖[14]。本研究首次报道纯化的 Kal蛋白具有过氧化物酶活性,可以抑制H2O2引起的细胞死亡。而Kal的转基因表达还可以提高eNOS的活性,从而使NO表达水平提高,且能抑制NADPH氧化活性[12]。这也预示Kal的抗氧化作用与其抗炎和抗肿瘤功效密切相关,是有别于单纯抗肿瘤新生血管生成药物的独特优点,值得深入研究。
REFERENCES
[1]Chao J, Chao L, Robert Q, et al.Novel roles of kallistatin,a specific tissue kallikrein inhibitor, in vascular remodeling.Bio Chem, 2001, 382(1): 15–21.
[2]Chao J, Chao L, John N, et al.Kallistatin is a potent new vasodilator.J Clin Invest, 1997, 100(1): 11–17.
[3]Miao RQ, Murakami H, Song Q, et al.Kallistatin stimulates vascular smooth muscle cell proliferation and migration in vitro and neointima formation in balloon-injured rat artery.Circ Res, 2000, 86(4): 418–424.
[4]Chao J, Yin H, Chao L, et al.Novel role of kallistatin in protection against myocardial ischemia–reperfusion injury by preventing apoptosis and inflammation.Hum Gen Ther,2006, 17(12): 1201–1213.
[5]Shen B, Chao J, Hagiwara M, et al.Salutary effect ofkallistatin in salt-induced renal injury, inflammation, and fibrosis via antioxidative stress.Hypertension, 2008,51(5): 1358–1365.
[6]Miao RQ, Agata J, Chao L, et al.Kallistatin is a new inhibitor of angiogenesis and tumor growth.Blood, 2002,100(9): 3245–3252.
[7]Wang MY, Day J, Chao L, et al.Human kallistatin, a new tissue kallikrein-binding protein: purification and characterization.Adv Exp Med Biol, 1989, 247: 1–8.
[8]Chai KX, Chen LM, Chao J, et al.Kallistatin: a novel human serine proteinase inhibitor.Molecular cloning,tissue distribution and expression in Escherichia coli.J Biol Chem, 1993, 268(32): 24498–24505.
[9]Diao Y, Ma J, Xiao WD, et al.Inhibition of angiogenesis and HCT-116 xenograft tumor growth in mice by kallistatin.World J Gastroenterol, 2007, 13(34): 4615–4619.
[10]Tse LY, Xu RA, Sun XY, et al.Adeno-associated virus-mediated expression of kallistatin suppresses local and remote hepatocellular carcinomas.J Gene Med, 2008,10(5): 508–517.
[11]Zhao X, Huo KK, Li YY.Synonymous codon usage in Pichia pastoris.Chin J Biotech, 2000, 16(3): 308–312.赵翔, 霍克克, 李育阳.毕赤酵母的密码子用法分析.生物工程学报, 2000, 16(3): 308–312.
[12]Diao Y, Xu RA.Protocols of Cellular and Molecular Biotechnology.Beijing: Chemical Industry Press, 2008:208–216.刁勇, 许瑞安.细胞生物技术实验指南.北京: 化学工业出版社, 2008: 208–216.
[13]Ye Q, Qin SK, Yin XJ, et al.Effect of Endostar on angiogenesis and inhibition of angiogenesis induced by liver cancer.China Pres Drug, 2008, 9(78): 81–81.叶庆, 秦叔逵, 殷晓进, 等.Endostar对血管新生和肝癌诱导的血管新生的抑制作用.中国处方药, 2008, 9(78):81–81.
[14]Gao L, Yin H, Smith S, et al.Role of kallistatin in prevention of cardiac remodeling after chronic myocardial infarction.Lab Invest, 2008, 88(11): 1157–1166.
[15]Mates JM, Sanchez-Jimenez FM.Role of reactive oxygen species in apoptosis: implications for cancer therapy.Int J Biochem Cell Biol, 2000, 32(2): 157–170.
[16]Locigno R, Castronovo V.Reduced glutathione system:role in cancer development, prevention and treatment.Int J Oncol, 2001, 19(2): 221–236.
High level expression of recombinant human kallistatin in Pichia pastoris and its bioactivity
Xiaoping Huang1, Xiao Wang1, Hao Dong1, Xiaofeng Zhao1, Zhaofa Li1,2, Qizhao Wang1,2,Ruian Xu1,2, and Yong Diao1,2
1 Institute of Molecular Medicine, Huaqiao University, Quanzhou 362021, China 2 Molecular Medicine Engineering Research Center of the Ministry of Education, Huaqiao University, Quanzhou 362021, China
Received:November 3, 2009;Accepted:December 25, 2009
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2008AA02Z135), National Special Key
Program of China(No.2009ZX09103-643), National Natural Science Foundation of China(No.30973591).
Corresponding author:Yong Diao.Tel/Fax: +86-595-22692516; E-mail: diaoyong@hqu.edu.cn国家高技术研究发展计划(863计划)(No.2008AA02Z135),国家科技重大专项课题(No.2009ZX09103-643),国家自然科学基金(No.30973591)资助。
