Feridex标记胎盘来源的间充质干细胞分化为神经干细胞的实验研究
2010-09-17尹晓娟
陈 霞,尹晓娟
(1.中国人民解放军第324医院儿科,重庆 400020; 2.中国人民解放军北京军区总医院八一儿童医院,北京 100700)
间充质干细胞是临床研究最常用的细胞来源,在组织工程研究、创伤修复、疾病终末期治疗等领域应用广泛,种子细胞的来源已成为国内外学者探讨的热点。胎盘作为胚胎发育过程中维系母体和胎儿氧气及营养物质交换的重要暂时性器官,主要由起源于细胞滋养层和胚外中胚层的胎儿丛密绒毛膜和母体子宫基蜕膜共同组成,被视为产后“废弃物”,因而具有最佳的伦理学优势和应用前景。笔者主要对胎盘来源的间充质干细胞的生物学特性和向神经前体细胞分化的特点进行研究,并用菲立磁标记成功,期望下一步研究能将胎盘间充质干细胞用于新生儿缺血缺氧性脑病等神经系统疾病。
1 材料与方法
1.1 仪器与材料
倒置相差显微镜(日本Olympus公司);CO2培养箱、恒温培养箱(法国Jouan公司);流式细胞仪(美国Beckman-Coulter公司);6孔、24孔培养板(美国Corning公司);菲立磁(美国先进磁力公司)。低糖DMEM培养基(DMEM-LG,美国Gibco公司);胎牛血清(美国Hyclone公司);重组人碱性成纤维生长因子(bFGF),脑源性神经营养因子(BDNF),胶质细胞系源性神经营养因子(GDNF),表皮生长因子(EGF)均为美国R&D公司产品;淋巴细胞分离液(Ficoll,密度1.077 g/mL,上海试剂二厂);鼠抗人 CD14,CD34,CD105,CD73,单克隆抗体和Ⅳ型胶原酶,多聚左旋赖氨酸(PLL)均为美国Sigma公司产品。
1.2 方法
1.2.1 胎盘间充质干细胞的分离
取足月剖宫产胎儿的胎盘(根据医院规定并经家属同意),剥离母体蜕膜面和胎儿面羊膜,取小块胎儿的胎盘组织100 g,经磷酸盐缓冲液(PBS)冲洗3~5遍,剪成碎片,加入0.1%Ⅳ型胶原酶,37℃下消化60 min,见组织液浑浊后用4层纱布过滤。过滤后的悬液用胎牛血清中和,1 200 r/min离心10 min后,再以500 r/min离心5 min。去除上清液,加入完全培养基[含低糖DMEM,10%胎牛血清(FBS),100 U/mL青、链霉素],置37℃及5%CO2饱和湿度培养箱培养,每3~4 d进行换液,待细胞90%铺满培养瓶底时,用0.25%胰蛋白酶消化,3~5 d传代1次。
1.2.2 间充质干细胞的表面分子鉴定
将长满90%的细胞去掉培养液后,加入2.5 g/L胰酶消化,形成的细胞悬液以1 000 r/min离心5 min,去除上清液,加入全培养基 2 mL重悬细胞,调整细胞密度为 4×105个/mL。加入 CD34,CD45,CD73,CD105一抗,室温、避光反应 1 h,上流式细胞仪检测。
1.2.3 间充质干细胞向神经前体细胞分化
制作细胞爬片,加入6孔板中,取第3代胎盘来源的间充质干细胞种于爬片上,以DMEM/F12+10%FBS培养液培养,细胞长至铺满70% ~80%玻片时,吸去培养液,PBS洗涤3遍,换10 ng/mL EGF+10 ng/mL bFGF+DMEM/F12,并分别添加相应浓度的血清,预诱导3 d后,吸去培养液,洗净后加入DMEM/F12+0.1 μmol/L全反式维甲酸(RA)、10 ng/mL GDNF+10 ng/mL BDNF进行正式诱导,并添加相应浓度的血清,每6~8 h于倒置显微镜下观察细胞。
1.2.4 Feridex标记神经前体细胞
用含15%胎牛血清的L-DMEM培养液稀释Feridex至25mg/L,加入PLL(最终质量浓度为0.75 mg/L)37℃孵育1 h。将分化的神经前体细胞调整细胞密度为2×106/mL,移入细胞培养瓶培养,12 h后提取细胞离心,细胞沉淀用PBS洗涤3次,更换无铁的培养基继续培养2 d,细胞提取行普鲁士蓝染色鉴定所分化细胞及常规ABC法进行抗Nestin免疫组织化学染色,DAB-H2O2棕色法呈色,显微镜下观察结果。
2 结果
初接种的细胞种类较多,大部分呈圆形。接种24 h后可见部分圆形单核细胞贴壁。原代培养36~48 h后贴壁的单核细胞开始增多,但仍保留圆形。72 h后细胞开始增殖迅速并出现多种形态。大多数细胞呈梭形并带有2~3个长的突起;细胞核较大,扁圆形,可见1~2个核仁。少部分细胞呈不规则形,形态多样,胞体大;胞核为圆形或椭圆形,有多个核仁;胞浆可向不同方向伸出突起;细胞集落间相互融合成单层,排列具有一定方向性。细胞倍增时间7~10 d。反复换液和传代培养去除非贴壁细胞,至第3代的PMSCs形态基本单一,为梭形或扁平形,增殖至细胞融合时,倒置相差显微镜下观察呈漩涡状排列(图1)。流式细胞仪鉴定表面分子标志见图2。PMSCs经诱导3 d后可见转化的细胞增殖分裂成小圆形,呈团簇状半悬浮状态。对这些细胞进行连续观察,发现其胞体逐渐增大,并有突起逐渐伸出、延长,诱导7 d后可见大量具有2个或多个突起的细胞,胞体呈大多角形或不规则形,类似于神经元和胶质细胞形态,折光性较强,细胞突起间相互连接成网状,具有典型的神经元细胞样形态。Feridex标记分化的神经干细胞见图3。
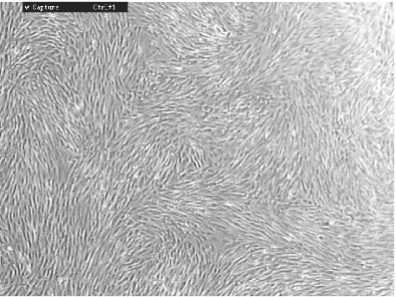
图1 PMSCs培养至3代,细胞呈漩涡状排列40×1
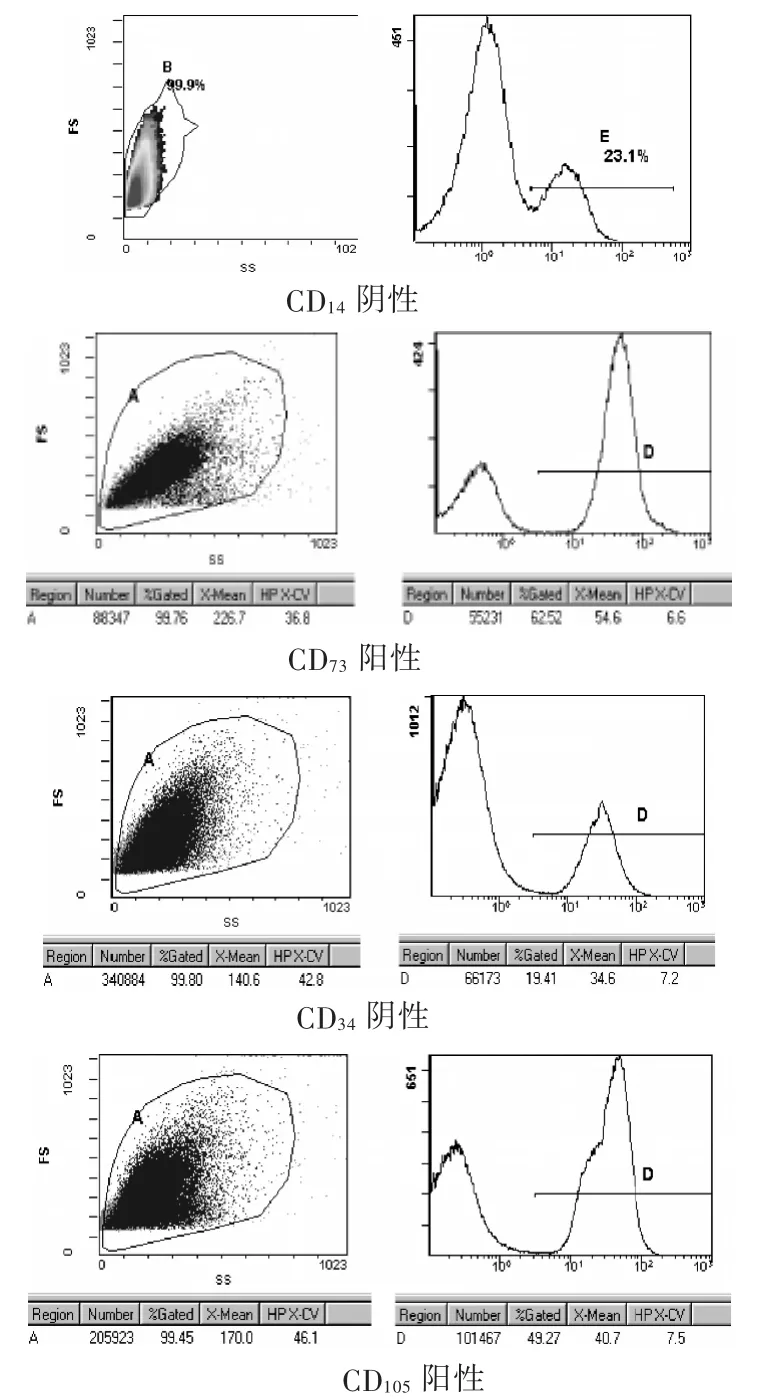
图2 流式细胞仪鉴定表面分子标志图
3 讨论
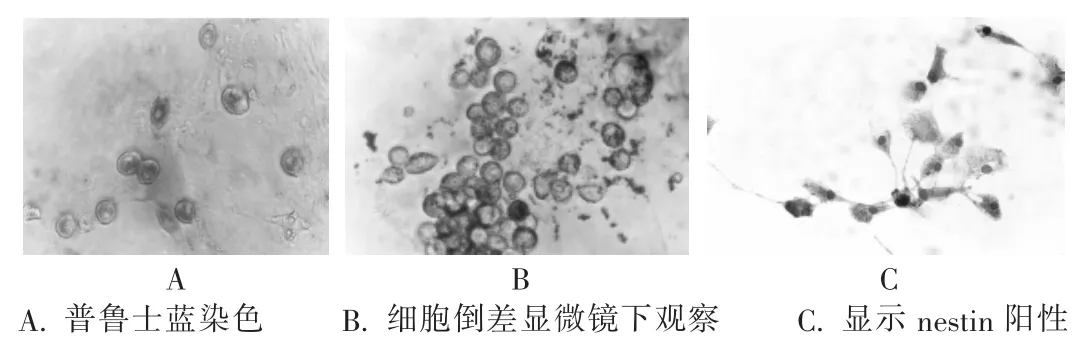
图3 Feridex标记分化的神经干细胞图
人类的胎盘在胚胎发育、营养、免疫耐受过程中不仅扮演了基础和重要的角色,而且含有大量的祖/干细胞[1]。一个成熟的胎盘直径15~20 cm,厚度2~3 cm,一般分为羊膜上皮、羊膜间质、绒毛滋养层、绒毛间质4个部分,从这些部分可以分离人羊膜上皮细胞、人羊膜间充质干细胞、人绒毛间充质干细胞、人绒毛滋养层细胞[2]。研究表明,人羊膜和绒毛间充质干细胞具有自我更新能力,呈成纤维细胞样克隆生长,表达特殊的表面抗原,具有多向分化能力以及为胚胎来源[3-4]。国外报道,将胎盘来源的间充质干细胞分化为神经干细胞用于神经系统疾病,取得了良好效果[5-6]。它与骨髓来源的间充质干细胞比较具有以下优点:在来源方面,胎盘是产后“废弃”组织,来源广泛、取材方便,且满足伦理学要求。成体组织如骨髓、脂肪组织、外周血都必须通过穿刺获得,不仅对供者造成创伤,还会增加受污染的概率,同时也无法大量获取。骨髓组织中间充质干细胞的含量极低,这也是骨髓来源的间充质干细胞的一个缺点,而且供者年龄在一定程度上也限制了骨髓来源的间充质干细胞的进一步应用,而胎盘作为产后组织则可避免年龄的影响。此外,胎盘组织如脐带和脐带血可以低温保存,可用于建立细胞库,而骨髓却很难实现[7]。
本研究应用胶原酶消化法从胎盘中获得了呈成纤维样漩涡样生长的细胞,间充质干细胞的标志物表达阳性(CD105,CD73),间充质干细胞标志物表达阴性(CD34,CD14)。用10 ng/mL EGF+10 ng/mL bFGF+DMEM/F12预诱导后,改为 DMEM/F12+0.1 μmol/L RA,10 ng/mL GDNF+10 ng/mL BDNF正式诱导,7 d后细胞分化成类似于神经元和胶质细胞形态。将终质量浓度为0.75 mg/L的Feridex标记分化的细胞,普鲁士蓝显示90%以上的干细胞胞质内出现细小的蓝色铁颗粒,倒差显微镜下观察显示nestin阳性,证实诱导分化成功。本研究成功地将胎盘来源的间充质干细胞诱导分化为神经干细胞,希望在下一步的研究中能应用于儿童不可逆的神经系统疾病如缺血缺氧性脑病。
[1]Yen BL,Huang HI,Chien CC,et al.Isolation of multipotent cells from human term placenta[J].Stem Cells,2005,23(1):3-9.
[2]Ilancheran S,MoodleyY,ManuelpillaiU.Human fetalmembranes:a source of stem cells for tissue regeneration and repair?[J].Placenta,2009,30(1):2-10.
[3]Zipori D.The stem state:plasticity is essential,whereas self-renewal and hierarchy are optional[J].Stem Cells,2005,23(6):719-726.
[4]Delorme B,Chateauvieux S,Charbord P.The concept of mesenchymal stem cells[J].Regen Med,2006,1(4):497-509.
[5]Portmann-Lanz CB,Schoeberlein A,Portmann R,et al.Turning placenta into brain:placental mesenchymal stem cells differentiate into neurons and oligodendrocytes[J].Am J Obstet Gynecol,2010,202(3):294.e1-294.e11.
[6]Yen BL,Chien CC,Chen YC,et al.Placenta-derived multipotent cells differentiate into neuronal and glial cells in vitro[J].Tissue Eng Part A,2008,14(1):9-17.
[7]Miao Z,Jin J,Chen L,et al.Isolation of mesenchymal stem cells from human placenta:comparion with human bone marrow mesenchymal stem cells[J].Cell Bio Int,2006,30(9):681-687.
