重金属胁迫对2种地被竹抗氧化酶与脂质过氧化的影响
2010-08-21王兵曹帮华蔡春菊
王兵 曹帮华 蔡春菊
(山东农业大学 山东 泰安 271014)
重金属胁迫对2种地被竹抗氧化酶与脂质过氧化的影响
王兵 曹帮华 蔡春菊
(山东农业大学 山东 泰安 271014)
采用盆栽法对4种重金属(Cd2+、Pb2+、Cu2+、Zn2+)胁迫下的菲黄竹与菲白竹叶片中的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性及脂质过氧化产物(MDA)进行了研究。结果表明,菲黄竹的SOD、POD、及CAT活性随着重金属浓度的增加总体趋势是先增大,之后降低,最后又增大;而菲白竹则是先升高,后降低;过氧化产物(MDA)则于酶活性的变化趋势相反。表明重金属胁迫下,2种地被竹体内的抗氧化酶活性被诱导,且菲白竹比菲黄竹有更强的耐重金属胁迫性。
重金属胁迫;抗氧化酶;地被竹
竹为禾本科竹亚科植物,在中国分布有400多种,是我国主要的经济植物,素有第二森林之称[1]。竹子在园林绿化中的应用愈来愈广,尤其观赏竹的发展已经颇受重视,但是日益复杂的生态环境常常限制了竹类产业的发展,尤其在重金属的源地,大多植物都不能生存,为了筛选出对重金属具有一定抗性的地被竹种,特以菲黄竹和菲白竹做试验材料,进行抗性生理研究。
重金属对植物的生长发育危害极大,可以通过植物的各种生理指标得到反映。进入植物体的重金属通常会改变细胞膜透性,也可使叶绿体结构发生明显的变化,以致叶绿素含量下降, 破环光合系统的完整性,打破细胞内自由基的产生和清除之间的平衡,另外,还会影响植物的呼吸作用[2],从而引起植物一系列生理代谢紊乱[3]。在正常环境下,氧自由基的浓度维持低水平是由于抗氧化酶的活性能够处于平衡状态。在胁迫条件下,氧自由基增加,诱发了植物体内抗氧化酶的活性[4]。MDA是细胞脂质过氧化的毒性产物,也是一种植物组织遭受自由基持续破坏的一个重要指标(Ohkawa,1979)。因此,细胞膜的稳定性已经广泛用于研究胁迫对植物的影响。对于地被竹植物的抗性研究,以往主要集中于对低温、水分亏损、耐荫性等方面,对于它们在重金属条件下的生理及生化机制研究则未见报道。
1 材料和方法。
1.1 材料
于2009年6月,从山东农业大学林学试验站的大田中选择长势良好的菲黄竹和菲白竹定植到规格为28cmx19cm的塑料花盆中,装入盆土10kg左右,摆放到大田中,进行正常的田间管理。于8月中旬苗木生长稳定后,选择长势均匀的盆栽竹苗移入防雨棚中,在每个花盆下面垫一个托盘,连续在土壤饱和水分条件下平衡几天,使盆栽材料达到稳定生长状态。采用随机区组试验设计,单盆小区,6次重复,以浓度梯度进行地被竹的抗重金属的测定。
1.2 金属处理方法
根据国家铅镉污染标准,将铅(Pb)、镉Cd) 与铜(Cu)锌(Zn)重金属按不同的浓度混合,分为4个处理的复合污染,其中Cd以CdCl2•2.5H2O盐溶液的形式加入,Pb以Pb(NO3)2盐溶液的形式加入,Cu以CuCl2•2H2O盐溶液的形式加入,Zn以ZnS04•7H2O的形式加入。以不加重金属溶液为对照设为L0,其他水平因素如下表所示。在15 d、30 d和45 d时,分别取样测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性及MDA的含量。
1.3 酶液的提取
(1)酶的提取: 取0.5 g新鲜的叶片洗净后,加入5 mL 50 mmol/L PBS(pH 7. 8,含1.0 mmol/L EDTA和2% PVP)。 于冰浴中研磨至匀浆,并在4 ℃、12 000 r/min离心10 min,所得上清液即可用于酶活性测定。
(2)酶活性测定方法:SOD活性测定参照李美茹等[5]的方法;POD及CAT活性测定参照波钦诺克[6]的方法;MDA含量的测定参照孟庆伟[7]的方法。

表1 不同处理下的重金属离子浓度Table1 The heavy metal ion concentration under different treatment(mg/kg)
2 结果与分析
2.1 SOD活性
超氧化物歧化酶(SOD)活性是反映植物抗逆性强弱的重要指标之一[8]。它能够消除O2,降低膜的过氧化,维持细胞膜的稳定性[9]。不同浓度的复合重金属处理下,2种地被竹的SOD活性变化如图1所示。
由图1可以看出,菲白竹与菲黄竹在重金属胁迫下,随着复合重金属浓度的不断增大,SOD活性总的变化趋势是相似的,即先增大后再降低。对于菲黄竹来说,其SOD活性在L1水平时出现最高值,在L3水平时出现最低值,对于菲白竹来说,其SOD活性在L2水平时出现最高值,在L3水平时出现最低值,而对于2种地被竹,L1水平和L2水平处理其SOD活性均高于对照,而L3水平和L4水平均低于对照。且3次不同时间的测定表明,在一定的时间范围内,这种变化趋势是大体一致的,但是随着时间的推移,不同处理水平下的SOD活性都有不同程度的降低。通过2种地被竹比较可以看出,45d时在L3水平和L4水平上,其SOD的活性开始超过15d和30d的活性时,说明了重金属胁迫下的2种竹子的SOD酶已经趋于稳定。

2.2 POD活性
POD可以催化活性氧H2O2,H2O2是氧化过程中一个主要的毒性中间体,因此POD在抗氧化过程中起到重要的作用,且POD活性的变化是监测植物受重金属毒害的重要指标之一[10]。2种地被竹在复合重金属胁迫下POD的活性变化如图2所示。在3个处理时间内,菲黄竹与菲白竹POD活性的总的变化趋势是随复合重金属浓度的升高,先一定程度的上升,后降低,后又上升。对于菲黄竹来说,其POD活性的最高值出现在L1水平,最低值出现在L3水平。除在LI水平,其POD活性高于对照外,其余水平都低于对照,对于菲白竹来说,其POD活性的最高值出现在L2水平,最低值也出现在L3水平,但是其活性除15d时的L3水平低于对照外,其余的都高于对照,以15d时的L2水平为最高,其活性为对照组活性的141.9%。 2种地被竹POD活性相比,菲黄竹的POD活性总体上高于菲白竹,但是在重金属胁迫下,菲黄竹POD活性却表现出整体下降的趋势,说明菲黄竹在重金属胁迫环境下的抗性是低于菲白竹的。
2.3 CAT活性
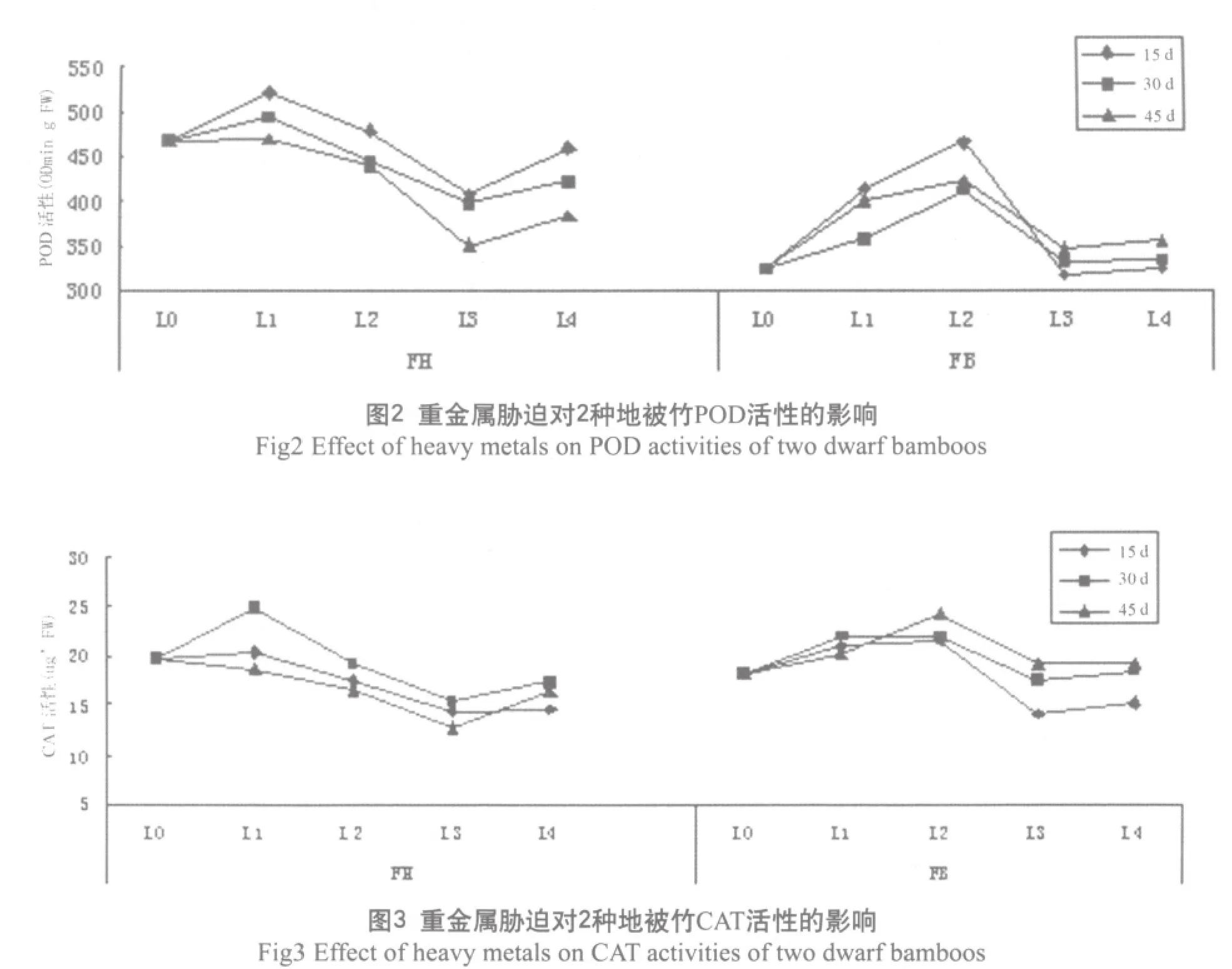
CAT是清除H2O2的另一种关键酶,CAT主要存在于过氧化体中,负责过氧化体中产生的H2O2的清除,并与POD起协同作用,清除植物体内过多的氧自由基[11,12]。重金属胁迫下,菲黄竹与菲白竹的CAT活性变化见图3。可以看出,菲黄竹CAT活性随重金属浓度的增大,保持先升高,后降低,再上升的趋势。在L1水平达到最大值, 以30d时的L1水平为最高,为对照组的126.05%。在L3达到最低值。除在L1水平其活性高于对照外,其它的处理水平均低于对照。而菲白竹的CAT活性随重金属浓度的增大,先升高,后下降。在15d和45d时,在L2水平达到最大值,30d时,在L1水平达最大,以45d的L2水平活性最高,且为对照组的133.6%,但3次测定均在L3水平时达最低值。通过比较可以看出, 菲白竹在重金属胁迫下, 其CAT活性相对菲黄竹较稳定, 有更强的耐重金属能力.
2.4 脂质过氧化产物
脂质过氧化通常以MDA的含量来衡量[13]。菲黄竹与菲白竹的MDA含量如图4所示。可以得出,菲黄竹的MDA含量呈现出总体上升的趋势,以L3水平的为最高,分别为对照的96.5%,114.8%,108.6%,在L4水平时有一定程度的降低。而菲白竹的MDA含量则表现出整体下降的趋势,但是下降幅度较小,以15d时L2水平为最小值,为对照的79.17%。且处理组的MDA含量均低于对照, 说明菲白竹的抗氧化酶系统起到了稳定清除自由基的作用。从图4还可以看出,菲黄竹的总的MDA的含量远远高于菲白竹,这说明在重金属胁迫的过程中,菲黄竹产生的净过氧化产物远远多于菲白竹,对其膜系统的伤害程度更大。说明菲白竹比菲黄竹在重金属逆境下有更强的抗氧化能力,即菲白竹的抗逆性更强。
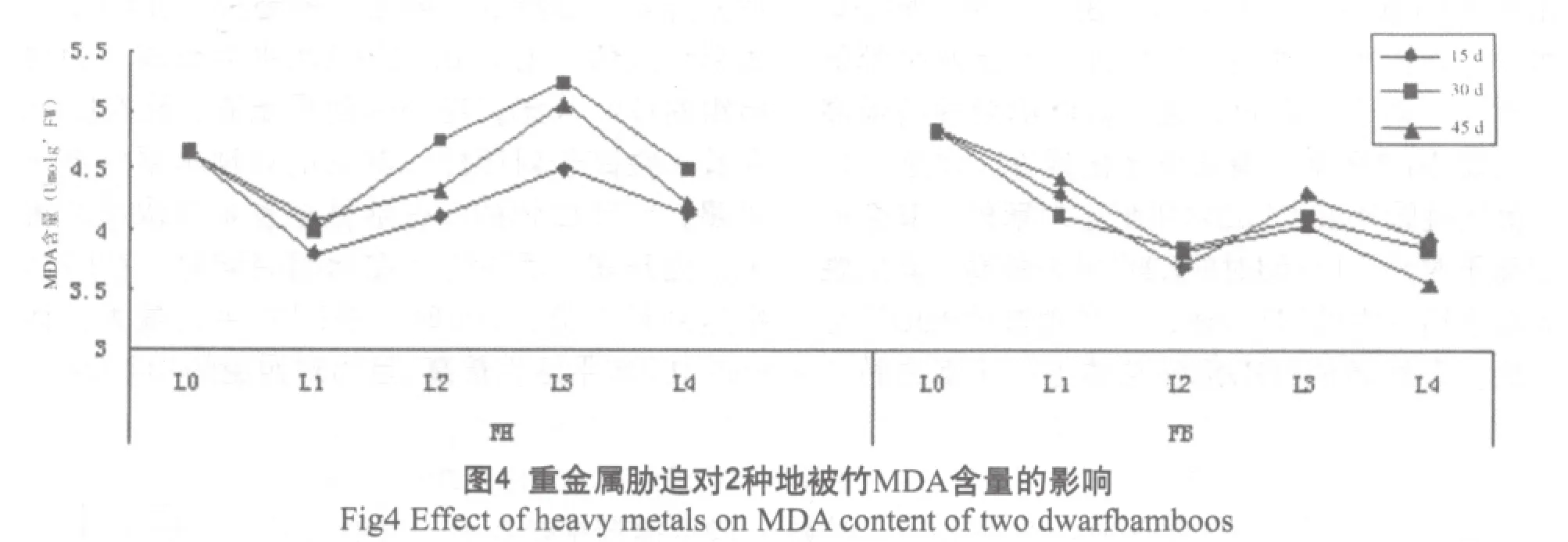
3 结论与讨论
(1)正常情况下,植物体内的活性氧代谢保持平衡。当重金属处理植物时,细胞内自由基的产生和清除之间的平衡受到破坏,导致大量的O2、OH、NO、HOO、RO、ROO、O2、H2O2、ROOH等活性氧自由基产生,从而使蛋白质和生物大分子变性、细胞膜脂过氧化加剧,伤害植物[14]。目前认为活性氧水平升高导致的膜脂过氧化加剧是膜损伤的重要原因[15-17]。SOD、POD及CAT作为植物体内的保护酶系统,能够有效的清除胁迫过程中产生的活性氧,使植物体内的活性氧维持在一个低水平上。SOD是清除自由基的最关键酶类之一[18],它能催化分子氧活化的第一个中间产物O2发生歧化反应生成O2和H2O2,而H2O2的清除则需要POD或者CAT2种关键酶,三者互相协调, 从而减小自由基对膜的伤害程度,但是随着自由基水平的升高,保护酶系统不能及时的清除较多的自由基时,就会积累有害的过氧化产物,如丙二醛等,植物细胞受到一定程度的伤害[19]。
(2)当菲黄竹和菲白竹受到重金属胁迫时,2种地被竹的SOD、POD及CAT活性均有不同程度的升高,说明外界的复合重金属对这些抗氧化酶活性具有一定的诱导能力,随重金属浓度的不断增大,SOD、POD及CAT活性整体都表现出升高的趋势,菲黄竹的SOD、POD及CAT活性L1水平时出现最高值,L3水平时出现最低值,菲白竹的SOD、POD及CAT活性在L2水平时出现最高值,也在L3水平时出现最低值。说明这些抗氧化酶的活性表现是大体一致的。而MDA含量则表现出相反的趋势,在L3水平时出现最大值,与酶活性表现出了一定的负相关性。在轻度的胁迫下,即重金属浓度在L1水平L2水平时,3种抗氧化酶的活性比对照都有不同程度的上升,但是,菲白竹的上升程度明显高于菲黄竹,但在高浓度即L3水平时,其活性降低,酶活性的下降导致了植株体内自由基的代谢平衡被打破,造成了过氧化产物MDA含量的增加。但是在L4水平时,虽然重金属浓度最大,但是各种酶活性却有一定的上升,这可能是由于高浓度的重金属之间的一种拮抗作用,导致重金属对植株的胁迫能力有所下降。
总之,在外界重金属的胁迫下,2种地被竹的抗氧化酶(SOD、POD、CAT)保护系统活性均被诱导,以消除积累的活性氧对膜系统的破坏,但是随着金属浓度的不断增大,抗氧化酶活性受到一定程度的影响,可能干扰了这些酶的合成,破坏了酶蛋白的结构,使活性氧自由基数量超过了植株本身的清除能力,最终这些酶的活性下降,导致两种地被竹的生长受到抑制[20]。两种地被竹通过抗氧化机制来抵御不同的重金属胁迫,从而保证植株受到不良外界的最小的伤害。
1 戴宪德,徐传保,戴庆敏.竹子资源及研究进展[J].山东林业科技,2009,1(5):107-110.
2 江行玉,赵可夫.植物重金属伤害及其抗性机理[J].应用与环境生物学报,2001,7(1):92-99.
3 任安芝,高玉葆,刘爽.铬、镉、铅胁迫对青菜叶片几种生理生化指标的影响[J].应用与环境生物学报,2000,6(2):11-116.
4 张凤琴,王友绍,董俊德,等.重金属污水对木榄幼苗几种保护酶及膜脂质过氧化作用的影响[J].热带海洋学报,2006,25(2):66-70.
5 李美如,刘鸿先,王以柔,等.钙对水稻幼苗抗冷性的影响[J].植物生理学报,1996,22 (4) :379-384.
6 波钦诺克X H.植物生物化学分析方法[M]. 荆家海,丁钟荣,译.北京:科学出版社,1981.
7 孟庆伟等,植物生理实验技术[M].
8 王建华,刘鸿先,徐同.超氧化物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989(1):1-7.
9 Shraddha S, Susan E, D’Souza S F. Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant, Bacopa monnieri L. [J].Chemosphere, 2006, 6(2): 233-246.
10 徐勤松,施国新,周红卫,等.Cd、Zn复合污染对水车前叶绿素含量和活性氢清除系统的影响[J].生态学杂志,2003,22(1):5-8.
11 江行玉,赵可夫.植物重金属伤害及其抗性机理[J].应用与环境生物学报,2001,7(1):92-99.
12 杨刚,伍钧,唐亚.铅胁迫下植物抗性机制的研究进展[J].生态学杂志,2005,24(12):1507-1512.
13 Feng-Qin Zhang ,You-Shao Wang, Zhi-Ping Lou,Jun-De Dong.Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings(Kandelia candelandBruguiera gymnorrhiza)[J],Sciencedirect Chemosphere , 2007, 6 (7): 44-50.
14 牛明功,王贤,陈龙,等.干旱、渍涝和低温胁迫对小麦生理生化特征的影响[J].种子,2003,(41):19-21.
15 徐勤松,施国新,周红卫,等.Cd、Zn复合污染对水车前叶绿素含量和活性氢清除系统的影响[J].生态学杂志,2003,22(1):5-8.
16 Huang YS , Luo OH , Kwan KM. Peroxidation damage of oxygen free radicals induced by cadmium to plant [J]. Acta. Bot .Sin. , 1997,3(9) :522-526.
17 Korlcheva J , Roy S ,Vralljlc JA , et al .Antioxidant responses to simulated acid rain and heavy metal deposition in birchseedlings[J].Envi ron. Poll . , 1997,9 (5) :249-258.
18 龚双姣,马陶武,姜业芳,等.铅胁迫对3种藓类植物抗氧化酶活性的影响[J].西北植物学报,2007,27(10):2035-2040.
19 Liu, Y. G., Wang, X., Zeng, G. M., Qu, D.,Gu, J. J., Zhou, M.,et al. Cadmium-induced oxidative stress and response of the ascorbateglutathione cycle in Bechmerianivea (L.) Gaud.Chemosphere, 2007, 6(9): 99-107.
20 Mittler, R. Oxidative stress, antioxidants and stress tolerance. Trends Plant Science, 2002, (7):405-410.
21 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
22 李合生.现代植物生理学[M].北京:高等教育出版社,2001.
Effect of Heavy Metal Stress on Antioxidative Enzymes and Lipid Peroxidation in Two Dwarf Bamboos(Sasa auricomaandArundinaria fortunei)
Wang Bing, Cao Banghua, Cai Chunju
(Agricultral University of Shandong, Taian 271014)
Superoxide dismutase (SOD) , peroxidase (POD) , catalase (CAT) and product of lipid peroxidation(MDA) in leaves of two dwarf bamboos,Sasa auricomaandArundinaria fortuneiunder multiple heavy metal stress (Cd, Pb, Cu and Zn) were studied through potting culture method. The results showed that in leaves of heavy- metal-stressed plants the activities of SOD, POD and CAT ascended at first, then declined and ascended at last with stress levels increasing inSasa auricoma, reaching its maximum at L1. In comparison with the control, the activities of SOD, CAT, and POD ofArundinaria fortuneiin heavy- metalstressed condition all ascended at fi rst and then declined, reaching its maximum is at L2, while the peroxidation products (MDA) represented the opposite trend in terms of activity. These results indicate that in heavy-metalstress, antioxidative activities may play an important role in the two dwarf bamboos, andArundinaria fortuneiis more tolerant to heavy metals thanSasa auricoma.
heavy-metal-stress, antioxidative enzymes, dwarf bamboo
* 依托项目:十一五支撑计划,项目编号为1632009009。
王兵 (1986-), 汉族,女,在读研究生。研究方向为森林培育。
