大鼠骨髓间充质干细胞向神经元样细胞定向诱导分化及免疫组化鉴定
2010-08-21赵兴利邵佳甲郭永川梁前垒李衍鑫
于 音,赵兴利*,田 宇,邵佳甲,郭永川,付 尧,梁前垒,李衍鑫
(1.吉林大学中日联谊医院神经外二科,吉林 长春 130033;2.长春职业技术学院)
大鼠骨髓间充质干细胞向神经元样细胞定向诱导分化及免疫组化鉴定
于 音1,赵兴利1*,田 宇1,邵佳甲2,郭永川1,付 尧1,梁前垒1,李衍鑫1
(1.吉林大学中日联谊医院神经外二科,吉林 长春 130033;2.长春职业技术学院)
目的建立体外分离、培养大鼠骨髓间充质干细胞(MSCs)的方法,体外诱导其向神经元样细胞方向分化。方法应用细胞培养技术从大鼠股骨、胫骨中分离、纯化骨髓间充质干细胞并在体外进行培养,以形态学方法鉴定间充质干细胞,在倒置显微镜下观察细胞的形态特征,利用含10 ng/ml bFGF的LG-DMEM及含200μ mol/L BHA、2%DMSO的无血清DMEM诱导其向神经元样细胞分化,并通过免疫组化方法鉴定。结果经原代及传代培养的骨髓间充质干细胞呈梭形,类似于成纤维细胞;成神经元诱导24 h后,多数MSCs变为典型的神经元样细胞,胞体向胞核收缩并有较多的长突起,免疫组化显示神经元特异性标志NSE、神经巢蛋白Nestin染色阳性。结论体外成功的进行了MSCs原代及传代培养,细胞生长稳定、增殖迅速并可多次传代,经诱导后具有向神经元样细胞分化潜能。
骨髓;间充质干细胞;诱导;大鼠;分化
(Chin J Lab Diagn,2010,14:0991)
骨髓间充质干细胞是存在于骨髓组织中多种干细胞的混和体,因其具有取材方便、扩增迅速、可自体移植并且具有多分化潜能等特点[1,2]近年来越来越受到关注。MSCs与神经组织修复、骨、软骨组织修复、肌组织、肌腱组织修复以及皮肤创面愈合等都有很密切的关系。
本实验从大鼠骨髓中取出骨髓基质细胞后进行体外原代及传代培养,经过多次传代以获得较纯的MSCs,从形态学上观察和鉴定MSCs,诱导其向神经元样细胞方向分化,证实其具有神经元样分化潜能。
1 材料与方法
1.1 主要材料与试剂 120-180 g Wistar大鼠20只;低糖DMEM培养基,胎牛血清FBS,0.25%胰蛋白酶,Percoll分离液,bFGF,BHA,DMSO。
1.2 实验方法
1.2.1 骨髓间充质干细胞的培养 取Wistar大鼠,3%戊巴比妥钠按10mg/kg体质量的剂量行腹腔注射麻醉。无菌条件下,暴露左右两侧股骨及胫骨表面,用一只固定有18号针头内含0.1 mL肝素(3 000 U/mL)的5 mL注射器从骨髓中抽取2 mL骨髓液,抽吸物用PBS溶液冲洗3次后,用DMEM培养基悬浮,将单细胞悬液缓慢加在1.073 g/cm3的Percoll分离液上部,350 g离心30 min,然后小心吸取位于分离液中间的乳白色细胞层,DMEM重悬后180 g离心5 min,以3×106密度接种于培养瓶中。将细胞置于37℃、体积分数为5%CO2、95%空气的培养箱内培养,接种后72 h首次换液,置换以新鲜的含10%胎牛血清的DMEM培养基,每3 d换液,第7天首次传代,将已经70%-80%长满的细胞用0.25%胰蛋白酶消化,再用10%胎牛血清的DMEM培养基重悬,以1∶2比例接种于新培养瓶中,以后每3 d换液,待细胞70%-80%长满时再次传代。
1.2.2 倒置显微镜观察 40及100倍倒差显微镜下逐日观察细胞的生长情况及形态特征。
1.2.3 MSCs向神经元样细胞定向诱导分化及免疫组化鉴定
1.2.3.1 定向诱导分化 取第3代细胞,接种于24孔培养板,每孔约1×105个细胞,分对照组及诱导组,对照组不加入诱导剂,待细胞80%融合时,诱导组加入含10 ng/ml bFGF的LG-DMEM(10%FBS)预诱导24 h,更换培养液,PBS洗涤3次,再加入含200 μ mol/L BHA、2%DMSO的无血清DMEM 诱导,每3 d换液,共培养6 d;
1.2.3.2 免疫组化鉴定 诱导细胞用4%多聚甲醛固定30 min,PBS洗涤5次,每次3 min,3%过氧化氢室温孵育10 min,以消除内源性过氧化物酶,之后用正常山羊血清封闭,室温10 min,分别加入兔抗大鼠NSE 多抗(1∶100稀释)、Nestin多抗(1∶100稀释)、GFAP多抗(1∶100稀释),湿盒4℃过夜后洗涤,生物素标记二抗37℃孵育30 min,链霉亲合素-过氧化物酶溶液37℃孵育30 min,DAB显色,苏木素复染,梯度酒精脱水(75%,85%,95%,100%),二甲苯透明,中性树胶封片,镜下观察计算阳性细胞数,随机数取10个非重叠视野(×100),计算NSE和Nestin阳性细胞数占总细胞数的比例,以PBS代替一抗做阴性对照。
2 实验结果
2.1 骨髓间充质干细胞原代培养及传代培养 细胞约24 h贴壁,48 h后贴壁细胞明显增多,并开始分裂增殖,圆形细胞变形伸出伪足,约7 d可70%-80%长满培养瓶壁,此时细胞逐渐融合成单层,形态变为圆形、多角形、梭形或不规则形,呈集落状生长,并出现核分裂相,细胞常围绕集落中央呈岛状分布,可重叠生长,并分泌大量基质。传代后细胞约24h贴壁,逐渐伸展为梭形、纺锤形、多角形,胞体较原代略膨大,3-5 d即可长满培养瓶壁。连续传代后,细胞逐渐变为形态更均一、排列更有序的成纤维细胞样。
2.2 神经元样细胞定向诱导分化及免疫组化鉴定
2.2.1 诱导后细胞形态观察 预诱导24 h后,原来梭形的MSCs胞体发生收缩,体积变小,立体感增强,细胞边缘变得不规整,并出现许多细的突起,胞体类似于锥形或球形(见图1)。诱导2 h后,少数MSCs开始出现明显的形态变化,胞质向胞核收缩,呈典型的核质体形态,胞体逐渐变成圆形或锥形,且折光性增强,胞体周围具有较强的光晕,突起继续延长(见图2);在诱导后5-24 h中,MSCs逐渐开始向神经元样细胞转化,数量随时间不断增多,形成双极或多极细胞,类似于树突结构(见图3);24 h后,多数MSCs变为典型的神经元样细胞,其胞体向胞核收缩成锥形且变得致密而有折光性,有较多的长突起,有些长突起末端形成长锥样的膨大及丝状伪足。多个神经元样细胞的突起可相互延伸并形成网状(见图4)。
2.2.2 免疫组化鉴定 为了进一步证实诱导分化出来的神经元样细胞,分别进行了神经元特异性标志NSE、神经巢蛋白Nestin和星形胶质细胞特异性标志GFAP的免疫组化染色分析,发现神经元样细胞的胞体及部分突起NSE和Nestin染色呈阳性(DAB显色棕色者为阳性细胞),GFAP染色为阴性,对照组染色均为阴性。从而进一步说明诱导分化所得的细胞为神经元,而不是星形胶质细胞。
2.2.3 神经样细胞的定量分析 经过定量计数分析发现用上述方法定向诱导MSCs后出现NSE阳性的细胞约为(79.5±3.2)%,Nestin阳性的细胞约为(73.8±2.6)%。说明用上述定向诱导分化方法可获得比例较高的神经元样细胞。

图1 预诱导24 h:胞体收缩,边缘不规整,类似于球形(100×)
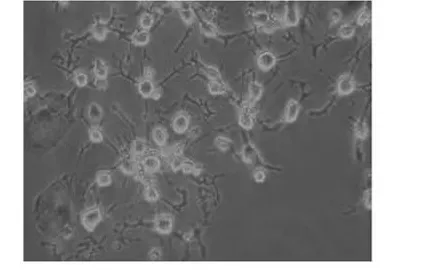
图2 诱导2 h:胞体变成圆形或锥形,折光性增强,突起延长(100×)
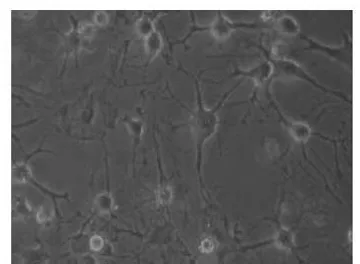
图3 诱导5 h:细胞形成双极或多极结构,类似于树突结构(100×)
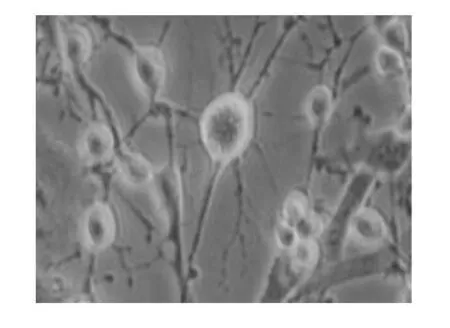
图4 诱导24 h:典型的神经元样结构,有较多的长突起,突起末端形成长锥样的膨大及丝状伪足,相互延伸形成网状(100×)
3 讨论
德国病理学家Cohnheim首先提出在骨髓基质中存在有向非造血系统多向分化的干细胞[3]。1968年Friedenstein等首先证实骨髓间充质干细胞在骨髓组织中的存在。近年来,MSCs的多向分化潜能[4,5]越来越受到研究者的关注,因其具有取材方便安全、来源丰富、损伤小,易于体外培养扩增,在体外可长时间保持未分化状态,体外基因转染率高,并能稳定高效表达多种治疗性外源基因,而且自体获取的MSCs回植后不会发生免疫排斥反应等优点[6,7],骨髓间充质干细胞已经成为重要的组织工程种子细胞,因此随着组织细胞工程学和基因工程学的兴起,骨髓间充质干细胞必将为神经组织修复、骨缺损、创伤愈合等的治疗开辟广阔前景[8]。
体外获得的MSCs为各种细胞的混合体,至今尚未形成一套理想的分离纯化MSCs的方法。目前用于分离MSCs常用的方法主要有3种[9,10],即贴壁筛选法、流式细胞仪分离法和密度梯度离心法。本实验采用了密度梯度离心法与贴壁培养法相结合的方法,在取出兔的骨髓细胞后,用比重为1.073的Percoll密度梯度分离液分离骨髓细胞,经梯度离心后,由于比重差别能有效地将绝大部分红细胞、粒细胞、脂肪细胞和血小板除去,获得纯度较高的单个核细胞,然后根据MSCs与血细胞贴壁性能差异,经体外贴壁培养,随换液弃除悬浮生长的血细胞。原代培养贴壁的细胞主要是MSCs,也可能混有单核细胞、淋巴细胞,利用它们在培养瓶壁的贴壁性不同,每次传代用0.25%胰蛋白酶消化3-5分钟,MSCs迅速从培养瓶上脱落,而淋巴细胞、单核细胞由于贴附性强仍附于培养瓶壁,严格掌握消化酶的量和消化时间,保证MSCs在短的作用时间内与培养瓶壁分开,从而使MSCs得到进一步纯化[11]。
原代培养骨髓间充质干细胞约24-48小时贴壁,细胞初为淋巴细胞样小圆细胞,24-48小时后贴壁细胞明显增多,并开始分裂增殖,圆形细胞变形伸出伪足。约8-10天可铺满培养瓶壁,细胞逐渐融合成单层。此时细胞为圆形、多角形、梭形或不规则形,呈集落状生长,并出现核分裂相。不传代细胞,可以持续生长,细胞常围绕集落中央呈岛状分布,呈多角形并可重叠生长,并分泌大量基质。传代培养细胞接种后24小时贴壁,逐渐伸展为梭形、纺锤形、多角形,胞体较原代略膨大,3-5天即可长满。连续传代后,随着传代次数增多,细胞变为形态更均一、排列更有序的成纤维细胞样。向神经元方向诱导中,bFGF作为预诱导剂可能参与骨髓间充质干细胞向神经干细胞分化的启动,纤维生长因子家族成员在胚胎干细胞分化为神经干细胞中起重要作用,而且bFGF对神经干细胞的增殖也有作用。正式诱导时加入的BHA、DMSO均为强抗氧化剂,其对骨髓MCSs定向诱导作用与其能将细胞从氧化状态中释放出来有关[12]。成神经元诱导24小时后,多数MSCs变为典型的神经元样细胞,其胞体向胞核收缩成锥形且变得致密而有折光性,有较多的长突起,有些长突起末端形成长锥样的膨大及丝状伪足。免疫组化鉴定显示神经元特异性标志NSE、神经巢蛋白Nestin染色阳性。说明MSCs具有体外向神经元样细胞的分化潜能,为今后开展神经干细胞移植修复受损神经组织奠定了基础。
[1]Devine SM.Mesenchymal stem cells:will they have a role in the clinic[J].J cell Biochem Suppl,2002,38:73.
[2]Minguell JJ,Conget P,Eriecs A.Biology and clinical utilization of mesenchymal progenitor cells[J].Braz J Med Res,2000,33(8):881.
[3]Prockop DJ.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276:71.
[4]Vogel W,Grunebach F,Messam CA,Kanz L,Brugger W,Buhring HJ.Heterogeneity among human bone marrow-derived mesenchymal stem cells and neural progenitor cells[J].Haematologica,2003,88:126.
[5]Lee H-S,Huang G-T,Chiang H,et al.Multipotential mesenchymal stem cells from femoral bone marrow near the site of osteonecrosis[J].Stem Cells,2003,21:190.
[6]Paolo Bianco,Parmela Gehro Robey.Marrow stromal stem cells[J].J Clin Invest,2000,105(12):1663.
[7]Leek,Majumdar MK,Buyaner D,et al.Human mesenchymal stem cells maintain transgene expression during expansion and differentiation[J].Mol Ther,2001,3(6):857.
[8]Van Damme A,Vanden Driessche T,Collen D,et al.Bone marrow stromal cells as targets for gene therapy[J].Curr Gene ther,2002,2:195-198.
[9]Tohnstone B,Yoo JU.Autologous mesenchymal progenitor cells in cartilage repair[J].Clin Orthop,1999,367(Suppl):S156.
[10]Hildebrand KA,Jia F,Woo SL.Response of donor and recipient cells after transplantation of cells to the ligament and tendon[J].Microsc Res Tech,2002,58(1):34.
[11]于 音,赵 刚,等.兔骨髓间充质干细胞体外培养向成骨和成脂方向的诱导分化[J].中国组织工程研究与临床康复,2008(8):1449.
[12]Prockop DJ.Marrow stromal cells as stem cells for nonhe-matopoietic tissues[J].Science,1997,276(5309):71.
neuron cell formation of mesenchymal stem cells of rats by induction differentiation and immunohistochemistry identification
YU Yin,ZHAOXing-li,TIAN Yu,et al.(Department of Neurosurgery,China-Japan Union Hospital of Jilin University,Changchun130033,China)
ObjectiveTo establish method of isolation and culture of rat bone marrow mesenchymal stem cells in vitro and to induce it differentiate to neuro cell.MethodsMSCswere isolated from the femurs and tibias bones and purified and cultured in vitro,MSCs',quality was evaluated with morphology.States ofMSCsgrowing in culture were observedwith invertedmicroscope.MSCs were induced to neuro cell by LG-DMEM including 10 ng/ml bFGF and DMEM including 200μ mol/L BHA 、2%DMSO.They are identified by immunohistochemistry.ResultsThe morphous of MCSswas fusiform shape and fibroblast cell-shape after cultivation of primary and subcultured.Typical neuron cell appear after 24 hours nerve cell induction,NSE and Nestin are expressed positively by immunohistochemistry staining.ConclusionThe method of isolation and culture of rat bone marrow mesenchymal stem cells in vitro is ideal and MCSs have the potency of neuron cell differentiation.
Bone marrow;Mesenchymal stem cells;Induction;Rat;Differentiation
R329.2+8
A
1007-4287(2010)07-0991-03
吉林省科委资助课题(20030536-2)
*通讯作者
2009-03-12)
