大白菜抗软腐病性状的SRAP标记分析
2010-08-09徐莹莹崔崇士屈淑平
徐莹莹,崔崇士,屈淑平
(东北农业大学园艺学院,哈尔滨 150030)
大白菜(Brassica campestris L.ssp.pekinensis)是二年生的十字花科芸薹属蔬菜作物,原产于中国,是我国栽培面积最大的蔬菜作物之一,在蔬菜周年供应中占有重要地位。软腐病是大白菜生产中的细菌性病害,因其危害性也被称为大白菜三大病害之一。该病害是由胡萝卜软腐欧文氏菌胡萝卜亚种(Erwinia.carotovora.subsp.carotovora Ecc.)引起的[1]。该病害在前期干旱、后期多雨或灌水不当情况下,很容易在生产中大面积流行,从而造成严重减产,该病是影响大白菜优质、稳产的重要因素[2]。由于大白菜种质资源中缺少抗源材料,以及对植物抗病机制认识的匮乏,软腐病抗病育种一直是大白菜育种中的重大难题。
近年来,基因组研究的迅速发展为许多农作物提供了大量分子标记技术和多种多样的检测手段,使分子标记辅助选择(Marker-assisted selection,MAS)应用于作物遗传改良成为现实,并取得了一系列成就,MAS是通过利用与目标性状紧密连锁的分子标记对目标性状进行早期、间接、准确选择的现代育种技术[3]。SRAP分子标记是MAS的一种方法,它是一种新型的基于PCR的标记系统[4],主要针对基因外显子里GC含量丰富,而启动子和内含子里AT含量丰富的特点来设计引物进行扩增,因不同个体的内含子、启动子与间隔区长度不等而产生多态性。SRAP具有试验操作简单,扩增谱带清晰,结果稳定,多态性好等优点,应用较广[5-6],本研究将SRAP应用于大白菜抗软腐病性状的分子标记辅助选择中,为建立大白菜软腐病抗性育种分子标记辅助选择系统和开展抗软腐病分子生物技术育种奠定技术基础。
1 材料与方法
1.1 供试材料
以高抗软腐病的大白菜高代自交系A32-2和感病自交系A19-2杂交后代构建F2代分离群体,共计225个单株。2007年5月在东北农业大学园艺实验站将亲本、F1、F2代种子种于防虫温室内。
1.2 方法
1.2.1 抗病性鉴定
亲本材料及F2代分离群体采用史国立等的苗期抗性鉴定方法[7],当幼苗长至7~8片真叶时进行人工接种,接种时先用锋利的刀片在叶柄基部轻轻划4道小伤口,接种浓度为1013cfu·mL-1,然后用注射器慢慢地把0.01 mL菌液注入到伤口表面,形成悬浮滴。发病温度28℃,相对湿度100%,接种后7 d调查病情。
1.2.2 DNA的提取和SRAP分析
结果见表1。

表1 供试验分析的SRAP引物Table 1 SRAP primers for analysis
采用CTAB法[8]提取亲本及每个单株的DNA,参照张书芬等使用的引物[9],从中选出10条正向引物和17条反向引物(见表1),正向引物和反向引物两两搭配成170个引物组合,引物由上海生工生物技术服务有限公司合成。扩增条件为:94℃变性3 min;94℃变性30 s,35℃复性30 s,72℃延伸1.5 min,5个循环;94℃变性30 s,50℃复性30 s,72℃延伸1.5 min,35个循环;72℃延伸7 min;4℃保存。SRAP-PCR反应体系参见文献[10],扩增产物在6%的变性聚丙烯酰胺凝胶上采用恒功率80 W电泳2 h,电泳仪采用Bio-rad垂直电泳仪,加样量为7.5 μL。然后进行银染,扫描或照相保存。
1.2.3 连锁图谱构建及QTL分析
统计在亲本之间产生的多态性并且在F2群体中有分离的条带。与亲本A32-2带型相同者赋值为1,与亲本A19-2带型相同者赋值为0,由于各种原因造成的数据不清楚或数据缺失者赋值为“-”。采用Mapmaker3.0进行分析,利用Kosambi函数将重组率转化为遗传图距(cM),以最大图距50 cM作为划分连锁群和排列Markers的基准距离。运用软件Windows QTL Cartographer V2.5和复合区间作图法对所考察的性状进行全基因组扫描,扫描区间为1 cM,以LOD≥3.0为阈值,检测软腐病性状相关 QTL的存在(P<0.05)。
2 结果与分析
2.1 软腐病抗性表型及其遗传特点
结果表明,本研究所选抗性材料对软腐病具较强抗性。对抗病亲本A32-2、感病亲本A19-2以及两者杂交所产生的F1代接种软腐病菌后发现,两个亲本和F1代的平均病情指数分别为17.54,82.86和23.54。F1代的平均病情指数低于双亲病情指数的平均值,其抗性介于双亲之间,趋向抗病亲本。
根据F2代病情分级和各病级的株数利用SAS 8.2 univariate程序进行正态分布检验。结果表明,F2代单株人工接种软腐病菌后症状表现为连续分布,呈现出数量遗传学特征,其偏度为0.1836,小于0.5,峰度为0.1358,符合正态分布,适于进行QTL定位。
2.2 SRAP标记多态性引物分析
用父母本对170对SRAP正、反引物组合进行筛选,得到24对条带清晰、多态性高的引物组合,检测到139个多态性位点。不同引物扩增的多态性条带差异很大,最多的11条,少的只有3条,平均每对引物5.8条。在139个SRAP标记中,来自A32-2的标记有79个,占56.8%,来自A19-2的标记有60个,占43.2%,比例大致持平,基本符合1:1的分离比。群体在总体上未出现严重的偏分离,为理想的作图群体。结果见表2。

表2 24对SRAP引物组合产生的多态性条带数Table 2 Numbers of polymorphic bands generated using 24 SRAP primer pairs
2.3 大白菜SRAP分子连锁图谱的构建
以225个F2代单株为作图群体,共获得139个SRAP多态标记,用Mapmaker/EXP3.0构建遗传连锁图。共获得10个连锁群(见图1),编号为LG1到LG10,包含103个标记,总长1 223.6 cM,每个连锁群有4~25个标记,最长的连锁群为348.0 cM,最短的连锁群为40.5 cM。标记间最大间距为33.1 cM,最小间距为2.2 cM,标记间平均间距11.9 cM。

图1 连锁图谱及QTL分布Fig.1 Linkage map and distribution of QTL for resistant to the soft rot of Chinese cabbage
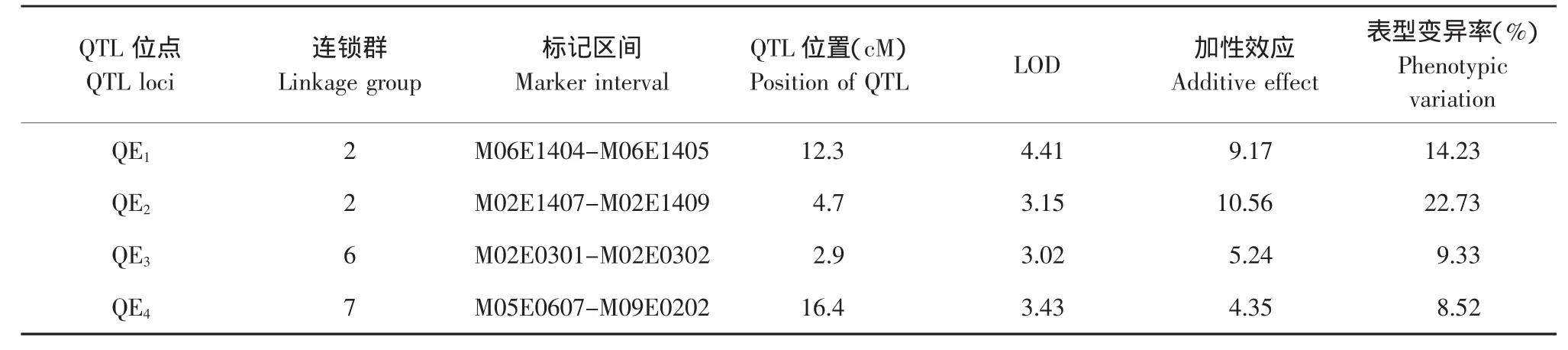
表3 大白菜F2群体软腐病抗性复合区间作图定位QTLTable 3 Genetic parameters estimated by interval mapping of the QTLs identified in the F2population from cross A32-2×A19-2
2.4 大白菜抗软腐病的QTL分析
用Windows QTL Cartographer V2.5软件进行分析,采用复合区间作图法,LOD值大于3.0作为QTL存在的阈值。通过对抗软腐性状QTL分析发现4个不同的QTL位点(见表1)。4个QTL位点分别位于LG2、LG6和LG7连锁群上,如图1所示,暂时命名为 QE1、QE2、QE3和 QE4。QE1位于M06E1404和M06E1405之间,与最近的标记M06E1404的距离为12.3 cM,加性效应为9.17,可以解释表型变异的14.23%;QE2位于M02E1407和M02E1409之间,与最近的标记M02E1407的距离为4.7 cM。加性效应为10.56,可解释表型变异为22.73%;QE3位于M02E0301和M02E0302之间,与最近的标记M02E0301的距离为2.9 cM,加性效应为5.24,可解释表型变异为9.33%;QE4位于M05E0607和M09E0202之间,与最近的标记M05E0607的距离为16.4 cM,加性效应为4.35,可解释的表型变异为8.52%;当QE1、QE2、QE3和QE4表现亲本A32-2的基因型时,分别能降低病情指数9.17%、10.56%、5.24%、4.35%。由此推断大白菜抗软腐病抗性为不完全显性基因控制,支持数量性状基因控制软腐病抗性的观点。
3 讨论与结论
本研究选用大白菜高抗软腐病A32-2自交系和高感软腐病A19-2自交系为亲本,用24对SRAP引物对两亲本产生的F2群体进行SRAP分析,共检测到139个多态性位点。不同引物扩增的多态性条带差异很大,最多的11条,少的只有3条,平均每对引物5.8条,其多态性产生的频率与已报道的大致相同[11],可以满足遗传图谱的构建。
目前,关于大白菜软腐病的遗传规律和抗性机制的报道很少,遗传规律与抗病机制目前还不是很明确。邹学校等用一个参数和二个参数的直线回归法研究了大白菜不同生育期软腐病严重度的遗传稳定性[12]。结果表明,特别抗病和特别感病的杂交种稳定性较好,中间类型的杂种稳定性较差,一般杂种抗性稳定性好的组合,其抗性杂种优势的稳定性也较好,但也有例外情况。估算不同生育期软腐病抗性遗传参数表明,结球始、后期抗性表现较强的杂种优势,遗传力高,选择的遗传进度大,但其抗性杂种优势和遗传力高低与外界环境有关。韩香婷研究表明,大白菜对软腐病的抗性为数量性状,受多基因控制[13]。牟晋华等以抗、感软腐病的大白菜材料为亲本,以其F2代分离群体为试材,研究其遗传规律[14],表明该群体对软腐病的抗性受单基因隐性控制,并采用AFLP分析技术结合BSA分组法,以E2M3引物组合筛选出一个150 bp的与感病基因连锁的标记。本研究结合大白菜软腐病苗期接种鉴定及SRAP标记分析共检测到4个QTL位点,由此推断大白菜软腐病为不完全显性,受多对基因控制,支持数量性状基因控制软腐病抗性的观点,与韩香婷等的研究结果一致[13]。大白菜软腐病遗传规律研究存在的分歧,可能是由于病原材料、抗病亲本、接种程度、接种苗龄以及环境条件等差异造成的。
[1]刘宜生.中国大白菜[M].北京∶中国农业出版社,1998.
[2]臧威,崔崇士,孙剑秋,等.大白菜软腐病的研究现状[J].北方园艺,2005(3)∶59-60.
[3]刘志文,傅廷栋,刘雪平,等.作物分子标记辅助选择的研究进展、影响因素及其发展策略[J].植物学通报,2005,22(增)∶82-90.
[4]Li G,Quiros C F.Sequence-related amplified polymorpgism(SRAP)a new marker system based on a simple PCR reaction∶its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,103∶455-461.
[5]Ruiz J J,Garcia-Martinez S,Pico B,et al.Genetic variability and relationship of closely related Spanish traditional cultivarsof tomato as detected by SRAP and SSR markers[J].J Am Soc Horticult Sci,2005,130(1)∶88-94.
[6]张彤,屈淑平,崔崇士.SRAP标记在蔬菜作物遗传育种中的应用[J].东北农业大学学报,2009,40(1)∶119-122.
[7]史国立,崔崇士,张耀伟.大白菜对软腐病抗性的快速鉴定方法研究[J].植物保护,2006,32(6)∶135-138.
[8]Murray M.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Res,1980,8(4)∶321-325.
[9]张书芬,傅廷栋,李媛媛,等.SRAP标记分析甘蓝型油菜多态性[J].华北农学报,2006,21(1)∶50-54.
[10]徐莹莹,屈淑平,崔崇士.大白菜SRAP-PCR反应体系的优化[J].东北农业大学学报,2008,39(8)∶31-34.
[11]林忠旭,张献龙,聂以春.新型标记SRAP在棉花F2分离群体及遗传多样性评价中的适用性分析[J].遗传学报,2004,31(6)∶622-626.
[12]邹学校,龙新.大白菜杂种一代软腐病抗性遗传稳定性分析[J].北方园艺,1989(5)∶3-6.
[13]韩香婷.大白菜抗软腐病性状的SSR分子标记分析[D].北京∶首都师范大学,2006.
[14]牟晋华,徐文玲,张一卉,等.大白菜软腐病抗性的分子标记筛选[J].山东农业科学,2008(4)∶1-4.
