猪细小病毒病国内流行状况以及防治策略
2010-08-04蔺文成崔玉东钱爱东崔尚金
蔺文成,胡 峰,,任 梅,,崔玉东,钱爱东,崔尚金,,
(1.中国农科院哈尔滨兽医研究所 兽医生物技术国家重点实验室 猪传染病学研究室,黑龙江 哈尔滨 150001;2.黑龙江八一农垦大学动物科学技术学院,黑龙江 大庆 163319;3.吉林农业大学,吉林 长春 130118)
猪细小病毒病是由猪细小病毒(porcineparvovirus,PPV)引起的一种繁殖障碍疾病,同时与猪渗出性皮炎、断奶仔猪多系统衰弱综合征等疾病有关,对妊娠母猪与仔猪具有极大的威胁,给养殖业造成了巨大的经济损失。
1 病原学
猪细小病毒(porcineparvovirus,PPV)属于细小病毒科、细小病毒属,耐热能力极强,对脂、酶溶剂及有机溶剂抵抗力强,耐酸范围大,感染能力在pH值3.0~10.0范围内无明显的改变。具有血凝性,能凝集人、猴、豚鼠、小鼠和鸡的红细胞,对豚鼠红细胞血凝效果最好。因此,临床上常利用这一特性检测PPV的存在。PPV几乎能在所有的猪原代细胞(如猪肾、猪睾丸细胞)和传代细胞(如PK15、ST、IBRS2等细胞)中生长,甚至能在牛肾原代细胞及人的某些传代细胞中增殖。
目前国内PPV只有一个血清型,哈尔滨兽医研究所的崔尚金研究员按照PPV的致病性与组织嗜性对其代表毒株进行了分类(如表1),包括非致病性毒株(KBSH、NADL-2)、对免疫不完全胎儿致病并能导致胎儿死亡的毒株(如NADL-8、IAF-76)、对免疫不完全胎儿致病并能引起皮炎的毒株(高致病性,如Kresse、IAFA54)、肠炎型毒株和呼吸道型毒株[1]。
2 流行病学
1966年,Mayr进行猪瘟病毒组织培养时发现了PPV[1];1967年,Cartwright和Huck等人首次在流产胎儿中分离到PPV;此后相继在德国、美国、荷兰、日本、澳大利亚等国发现,中国在1982年首次分离到猪细小病毒,随后潘雪珠等学者相继在上海、四川、广西、黑龙江、天津、湖北等地分离到了病毒,这表明猪细小病毒呈全国性分布。上世纪80年代到90年代中期,国内猪群PPV感染率极高,此阶段的抽样检测结果(如表2)显示:全国范围内,猪群PPV的阳性感染率普遍在60%以上,个别省份的阳性感染率甚至达到87.50%,极大的威胁到了养猪业的发展,造成了巨大的经济损失。

表1 五种猪细小病毒的生物型分类

表2 国内部分地区猪群PPV阳性感染率抽样检测结果
随着PPV疫苗的投入使用,PPV疫情得到了有效的控制,自90年代中期开始,猪群的发病率显著下降。但近年来,猪细小病毒病感染率和发病率都呈不断升高的趋势。以贵州遵义地区为例,自2006年开始,该区内规模养猪场的PPV阳性感染率分别为4.80%、7.22%、10.38%、14.20%,呈现逐年递升的趋势(如图1)。
2005年以来,国内多个省份陆续对猪细小病毒阳性感染率进行了调查,结果发现:全国范围内,猪群的阳性感染率较高,有暴发猪细小病毒病的可能性;西南地区、华南地区和华北地区的阳性感染率显著高于其他地区。
3 发病机理

图1 贵州遵义地区猪细小病毒检测阳性率
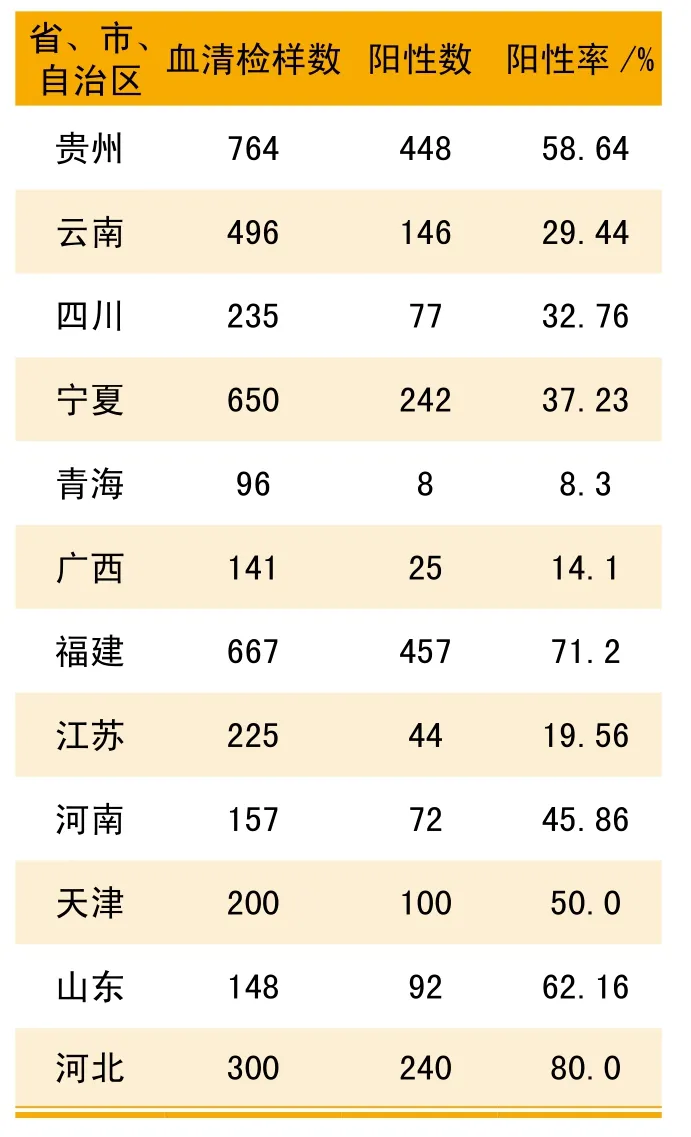
表3 国内部分地区猪群PPV阳性感染率抽样检测结果
PPV在心脏、肺脏、脾脏和性腺中复制,主要攻击母猪子宫,子宫内病毒含量最高可达1012拷贝/mL;对仔猪而言,病毒同样在心脏、肺脏、脾脏和性腺中复制,以性腺含量最高。由此可见,病毒对母猪的致病位置主要在繁殖器官,同时也破坏肺脏等呼吸器官和脾脏等免疫器官;而对小猪的损伤主要在于破坏脾脏、性腺等的正常生理功能,同时破坏心脏等中枢器官,从而造成死亡。
目前PPV具体的致病机理研究多集中在猪感染PPV后体内激素水平变化和病毒对作用方式的角度。相关研究发现:PPV可以吸附在猪受精卵细胞上,部分PPV能穿过透明带进入受精卵细胞,病毒可能在受精卵细胞内起一定的作用从而导致流产、死胎、胎儿木乃伊化及新生仔猪死亡;PPV还能使母猪黄体发生萎缩,而妊娠黄体的主要作用是分泌孕激素,支持胎儿发育,PPV造成黄体萎缩使母猪失去了这一生物学功能。这些作用可能是导致猪细小病毒病发生繁殖障碍和仔猪死亡的原因之一。母猪经口鼻感染PPV后,母体与胎儿结合处的绒毛膜的间质细胞和内皮细胞内病毒含量随妊娠期的发展而明显增加,而子宫内皮细胞和滋养外胚层未检测到病原,这表明母猪与胎儿间的病毒传染可能通过这些组织进行,但也有学者认为病毒在母体之间是通过巨噬细胞传播的。
PPV不同毒株的致病方式和组织嗜性有较大的差异,不同毒株的复制具有显著的组织选择性。NADL-8株和NADL-2株的区别在于能否通过胎盘感染胎儿从而造成胎儿的死亡,其中NADL-2株可作为弱毒疫苗使用。Molitor等发现NADL-2毒株感染的细胞中存在缺损性病毒颗粒NADL-2*,这种颗粒能干扰NADL-2毒株的复制,从而为免疫反应提供足够的时间,阻止继发胎盘感染和毒血症等的发生。Oraveetakul等利用原位杂交技术证实了NADL-8株与Kresse株在胎儿体内复制部位和数量的差异,二者的DNA在肝脏内的数量差异不大,但脑组织和脾脏内仅有Kresse株的DNA。
4 混合感染
PPV可以和许多病毒发生混合感染,包括猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)和猪伪狂犬病毒(PRV)等;同时还可以与某些细菌、寄生虫等发生混合感染,如附红细胞体原虫、沙门氏菌和大肠杆菌等
邬捷等(1987)报道了我国猪细小病毒与乙型脑炎病毒混合感染,这是国内首次对细小病毒混合感染的报道,随后相继有人报道猪细小病毒和圆环病毒、繁殖与呼吸障碍综合征病毒(PRRSV)混合感染的情况。
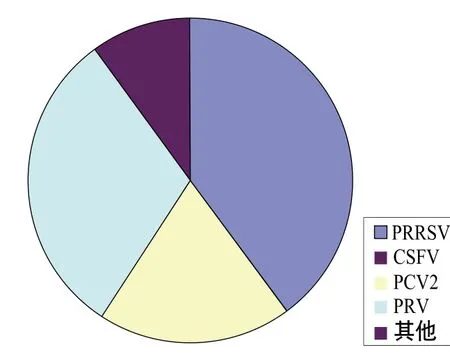
图2 与PPV混合感染的病原示意图
2004年,华东地区(上海、江苏、浙江及山东等四省市)猪场的调查情况显示:PCV2与PPV二重混合感染样品占样品总数的26.9%,PPV、PCV2与PRRSV三重感染的病例占检测样本总数7.5%[3];2006年,广西南宁、玉林、贵港、柳州、钦州和桂林6个市的检测结果显示:PPV与PRRSV、CSFV、PCV2和/或PRV4种病毒均有混合感染现象,混合感染样品占PPV阳性样品的48.00%[4];Krakowka等应用PCV2分离毒株实验感染未经母乳哺育的仔猪或悉生仔猪仅产生轻微的PMWS症状,但如将PPV及PCV2共同实验感染仔猪则可以成功复制出典型的PMWS症状及病变,但如用PPV单独感染没有任何症状和病变[5]。2007年,云南省屏边县发生PPV与猪附红细胞体病混合感染疫情,混合感染率高达60%;2008年,四川省眉山市发生PPV与沙门氏菌混合感染病例;2009年,贵州省贵阳市发生PPV与仔猪水肿病混合感染病例,都给当地养殖业造成了巨大的损失。
如图2所示,目前国内与PPV混合感染的主要病原是PRRSV、PCV2和PRV等,与其他病原混合感染的程度明显小于这3种病原。现阶段各地猪场中PPV的混合感染现象非常普遍,与其他病原的混合感染趋势可能会进一步扩大,感染方式可能会逐渐呈现多元化,感染范围也可能会逐步扩大,出现除目前已知的繁殖障碍、肠炎、皮炎、呼吸道感染、PMWS以外的其他新情况,因此防控混合感染的任务任重而道远。
5 基因与表达
PPV为单股负链DNA病毒,大小约为5000bp,成熟的病毒颗粒只含有负链DNA。猪细小病毒与同属的其他病毒有很高的序列同源性和结构相似性,基因组两端具有发夹结构,3'端形成长约102bp的Y字型发夹结构,其中2-16nt、27-40nt为保守序列;5'端构成长约127bp的U型回文序列。病毒基因组具有两个开放阅读框(ORF),靠近3'端的ORF主要编码结构蛋白,靠近5'端ORF主要编码非结构蛋白,编码区基因相互重叠,各自有独立的启动子。
PPV遵循滚筒式复制原则,在细胞周期的S期晚期和G2期早期依赖于宿主DNA的复制机制进行自身复制,在宿主DNA多聚酶的作用下,从基因组3'端的羟基开始合成互补链,将感染的负链DNA转变为双链复制型DNA(RFDNA),再以RFDNA为模板,合成病毒mRNAs和子代病毒基因组。PPV感染宿主细胞后,启动子P4与P40分别从基因组225nt和2035nt处起始转录,共同终止于4833nt的终止序列区,终止序列区包括poly(A)(CAATAAA,4813nt)、CA二核苷酸(4833nt)、GT富集区(TGTGTTT,4843nt),转录产物经不同的拼接方式形成4种转录终产物,即R1(4.7kb)、R2(3.3kb)、R3和R4(均为2.9kb),可进一步分别编码非结构蛋白NS1、NS2、NS3和结构蛋白VP1、VP2。
本实验室曾对国内收集到的毒株和GenBank中收录的毒株的序列进行分析,发现VP1/VP2终止密码子处存在一段重复序列,从疫苗株到疫苗前毒株、中等毒力毒株、古典型毒株、皮肤型毒株、高致病力毒株,碱基缺失从0到44、45、63、127、128各自不同,缺失数目有越来越多的趋势,由此推断,猪细小病毒的毒力变化可能与此有关[7]。进一步的分析发现,所有弱毒疫苗株都存在127的重复序列,这可作为区分弱毒疫苗株和其他流行病毒株的依据。李昌文等(2001)的分析结果表明,不同毒株VP2基因序列的同源性在99%左右,并含有细小病毒属的保守序列,即UFPNGQIWDKEL,在无感染性缺损病毒NADL-2的基因组中并没有类似的保守序列,因此推测这段保守序列可能是产生完整的病毒结构蛋白和成熟的病毒粒子必不可少的功能区域。
6 PPV的诊断方法
6.1 病原学检测
PPV在细胞中进行培养后分离,从而确诊PPV的感染,此方法在早期PPV诊断中发挥了重要作用。但病毒分离繁琐,成本高、时间长,易受其他病毒干扰,而且PPV的感染力会随着胎儿死亡时间的延长而降低,因此在临床应用上颇受限制。
6.2 血清学诊断
6.2.1 血凝试验和血凝抑制试验
血凝试验(HA)用于检查组织提取物中的病毒抗原。李永江[8]等人采用生理盐水、PBS、巴比妥缓冲液3种缓冲液进行血凝试验,结果表明经生理盐水作稀释,血凝滴度最高,达1∶8192,比PBS高2个滴度,较巴比妥缓冲液高3个滴度。
血凝抑制试验(HI)用于感染后抗体检测。HI试验方法具有较高的特异性,操作简便、快速,能大量诊断,是基层兽医检测PPV较为经典的方法,但该方法灵敏度低,只能检出被PPV感染,但在低滴度感染时难以检出,不能区分灭活疫苗免疫的猪和野毒感染的猪,只能作为辅助诊断方法。
6.2.2 血清中和试验
血清中和试验(SN)就是利用被检血清的抗体中和PPV,根据细胞病变来计算抗体滴度,JooHS[9]等人研究表明SN比HI更敏感。但该方法首先需要对毒力进行测定,低剂量不能引起细胞病变,花费的时间长,对细胞培养和细胞病变结果的判定要求较高,不适用于基层诊断。
6.2.3 酶联免疫吸附试验
姜永厚[10]等人建立了从胎猪脏器中检测PPV抗原的酶联免疫吸附试验(ELISA)双抗体夹心法,该方法与猪瘟病毒、乙脑病毒无交叉反应,具有较高特异性。同时还将ELISA与HA的敏感性进行比较,结果表明ELISA可以检出稀释度为10-4~10-10的培养物,而HA在稀释度为10-7~10-8时检不出现血凝活性,ELISA的敏感性比HA高100倍,而且检测时间比HA短,对54份自然感染样品的检测结果ELISA的阳性检出率是59.3%,HA是31.5%。双抗体夹心ELISA操作简便、敏感、特异,用于快速诊断,便于基层使用。冉旭华等[11]初步建立了检测PPV抗体的PPV-NS1-ELISA方法,与猪圆环病毒、伪狂犬病病毒、猪繁殖与呼吸综合症无交叉反应,表明特异性高。与Western-blot比较,二者符合率是87.4%。采用HI和PPVNS1-ELISA方法对256份血清检测,其中有73份ELISA检测结果为阴性,而HI为阳性。与PPVELISA抗体试剂盒比较,该方法检出的阳性率高6%,二者的符合率是94%,表明该方法的敏感性高。同时还可以区分灭活疫苗免疫猪和自然感染猪。付利之[12]等人建立了间接斑点辣根过氧化物酶标记葡萄球菌A蛋白免疫试验(间接Dot-PPAELISA)用来检测PPPV抗体。该方法特异性强,不与伪狂犬病病毒、猪瘟病毒、猪乙型脑炎病毒发生交叉反应。与HI相比间接Dot-PPA-ELISA检测抗体效价最高时1∶4096,而HI检测抗体最高效价是1∶1024,证明该方法的灵敏度高于HI。
6.2.4 免疫荧光技术
该方法包括直接免疫荧光技术和间接免疫荧光技术。直接荧光抗体技术是将荧光色素标记在抗体上与相应的抗原反应,在荧光显微镜下观察特异性荧光反应,但PPV较小,使检出率较低。蕫齐等[13]建立了间接免疫荧光技术,先是PPV高免血清与PPV抗原反应,再加荧光标记的二抗,荧光显微镜下观察。该方法与猪伪狂犬病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒不发生交叉反应,特异性强。对PPV人工感染猪7头胎儿的肝、肺、肾冰冻切片均检出了特异性荧光阳性细胞,敏感性强,检出率高,耗时短。但该方法需利用荧光显微镜等精密仪器,对操作人员要求高,所以只适用于实验室诊断,不适合基层运用。
6.2.5 乳胶凝集试验
何启盖等[14]建立了乳胶凝集试验(LAT),并与HI试验检测了203份猪血清,二者阳性符合率是93.1%,差异不显著。该方法可用于对大量血样进行血凝抑制试验前的初选,简便准确,结果稳定,值得广大基层推广。但该方法只能检测IgM用于PPV定性诊断,不能进行抗体滴度的检测。
6.3 分子生物学诊断技术
6.3.1 PCR检测技术
吴淑芳等[15]人建立了PPVPCR检测方法,能检测的最小病毒滴度值是0.398,在混合感染组织中检测的最小滴度值是0.500TCD50的特异性。岳丰雄等[16]人建立了检测多种病毒的多重PCR技术,最低检测量为8.64×10-3μg,具有良好的敏感性和特异性。荧光定量PCR是一种比常规PCR敏感性更高、特异性更强、快速的诊断技术,宋传敏等建立了SYBRGreenⅠ荧光定量PCR,灵敏度可达1.0×102拷贝/μL,对10份疑似病料进行检测,发现10份均为荧光定量PCR,而常规PCR检出7份阳性。
6.3.2 核酸探针技术
核酸探针技术具有快速、敏感、特异性强等特点,适用于疾病的早期诊断和类症鉴别诊断。Krell等首先将核酸探针技术应用于PPV的诊断,侯喜林等[17]利用地高辛标记的PUP重组质粒探针,对PPV培养物的DNA进行斑点杂交检测PPV,结果表明地高辛标记与32P标记探针有相同的敏感性,同时克服了生物素标记探针敏感性差、背景深的不足。与HA试验比较,两者检测结果基本一致,但该方法对操作技术要求高,只适合实验室检测。
6.3.3 单克隆抗体技术
国外1984年就研制出PPV单克隆抗体应用于临床诊断,目前国内已制备出了PPVNADL-2和PPV7909株的单克隆抗体。谢琴等[18]人研制出了抗猪细小病毒单克隆抗体,与ELISA结合对308份猪血清进行检测,阳性检出率达66.6%,与HI试验相比,敏感性更高,阳性检出率比HI高出5.7个百分点。谢红玲等制备了抗PPV单克隆抗体细胞株15株,该单抗不与猪圆环病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒发生交叉反应,特异性极强。单克隆抗体的成本高,制备复杂,限制了其在基层的使用,只能用于实验室诊断。
6.3.4 基因芯片技术
王温田等[19]人克隆猪细小病毒基因保守序列作为探针固定到硝酸纤维素膜上,制备了诊断基因芯片,对样品的检测结果表明该方法有良好的特异性和重复性。符芳等[20]建立了针对5种猪病病毒的基因芯片,能特异性的检测出5种病毒,敏感性优于多重PCR,同时检测的病毒种类比荧光定量PCR多。
7 疫苗防治
猪细小病毒主要引起母猪流产、不孕、死胎、畸形胎、木乃伊胎及弱仔等。但带毒母猪临床表现不明显,血清学调查表明PPV感染在猪群中普遍存在,给养猪业造成重大损失。目前能有效预防猪细小病毒还没有其他方法,只能通过使用疫苗进行免疫预防。猪细小病毒疫苗主要分为灭活疫苗、弱毒疫苗、基因工程亚单位疫苗、基因工程活病毒载体疫苗、基因疫苗等。
7.1 灭活疫苗
灭活疫苗是一种传统疫苗,具有安全性好,诱导产生抗体时间长,不需要低温保存等优点。中国农业科学院哈尔滨兽医研究所的科研人员,经过几年的努力,研制成猪细小病毒氢氧化铝灭活疫苗。该产品是以猪细小病毒PKZ株接种新生仔猪肾原代细胞培养增殖,收获的毒液灭活后,再加入一定比例的氢氧化铝佐剂而制成的。此产品可用于初产母猪和种公猪的免疫接种,预防猪细小病毒感染。该产品已用100余万头份,证明安全有效,受到用户欢迎和好评。张超范等[21]对猪细小病毒灭活疫苗安全性及佐剂的筛选进行试验,对2种灭活剂灭活的病毒液分别用3种佐剂制备10种灭活疫苗,然后分别对动物进行免疫效果对比试验。初步确认甲醛灭活的病毒液与佐剂ISA15AVG的组合为PPV灭活疫苗的最佳灭活剂和佐剂组合。Joo等应用β-丙内酯和福尔马林灭活PPV研制出凝胶佐剂PPV灭活疫苗;Mengeling等用乙酰二甲亚胺灭活PPV制成的灭活疫苗;Mengeling等用PPV、伪狂犬病病毒二联灭活疫苗,免疫猪都有良好的效果。但是灭活疫苗产生抗体慢,不能诱导细胞免疫反应,抗体水平相对活疫苗较低,需重复接种,使用剂量大,费用较高,免疫效果不稳定。
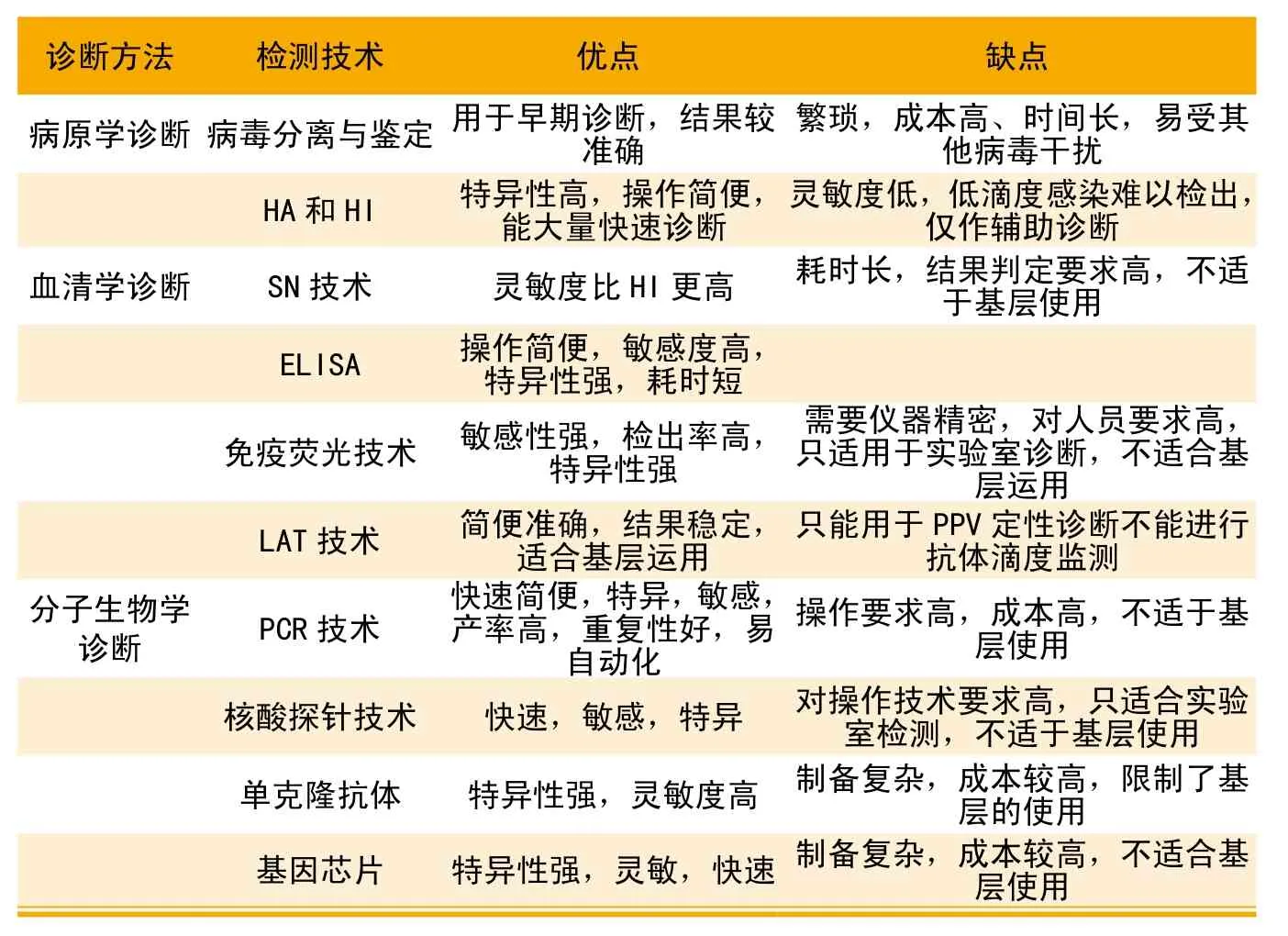
表4 各种诊断方法的优劣比较
7.2 弱毒苗
弱毒疫苗免疫力较强,能同时诱导细胞和体液免疫反应。产生抗体快,用量少,成本低。目前弱毒疫苗主要是通过强毒株的连续传代致弱而制的。白安斌等[22]研制出能预防该病感染的猪细小病毒N株弱毒疫苗(PPV-N株)并对3个规模化猪场的后备母猪进行田间试验,结果表明1579头免疫猪和108头未免疫猪(对照)产仔成绩,平均每窝免疫猪比对照猪多产活仔3.95头,少产死胎、木乃伊胎3.5头,对照猪死仔占产仔总数43.84%,而试验猪仅为6%,免疫效果良好。盘宝近也用该弱毒苗进行动物实验,证明该苗有良好免疫原性和保护性。Fujisaki等得到HT株的弱毒株,并进行免疫实验,试验猪无病毒血症,无病毒排出,不会将病毒传染给别的猪,但可以维持长时间的PPV抗体。虽然弱毒苗在预防PPV中发挥重要作用,但有些弱毒苗还存在安全性问题,即毒力反强产生不良影响。由于PPV具有独特的生物学特性,目前已研制开发并成为商品化生产的PPV弱毒疫苗还非常少。
7.3 基因工程亚单位疫苗及活病毒载体疫苗
基因工程亚单位苗是在受体中高效表达某种特定蛋白质,然后提取所表达的特定多肽,加入佐剂制成的一种新型疫苗。病毒活载体疫苗是将异源性病毒的保护性抗原基因及启动子序列插入到作为载体的另一种病毒如弱毒疫苗株的基因组非必需区中而构建的疫苗,可达到1针防2病或多病目的。目前有的将PPVVP2基因克隆到原核表达载体上表达蛋白如司艳红等;也可以克隆到真核表达载体上,如范京惠等[23]构建了同时含有PPVVP2基因和CSFV特异性T细胞表位基因的重组杆状病毒,并在昆虫细胞中得到了高效表达。QHong等应用伪狂犬病毒基因缺失株TK-/gE-/LacZ+作为一个活病毒载体成功重组出可预防猪的伪狂犬病、口蹄疫、细小病毒病的新型三联疫苗的候选毒株。亚单位疫苗不含感染性组分,因而无需灭活,也无致病性,免疫原性好,但技术要求高,成本昂贵,难以在临床上推广应用。活病毒载体疫苗与弱毒疫苗相似,能诱导强而持久的免疫反应,而且改造过的活病毒疫苗其安全性较传统弱毒疫苗大为提高。但其生产技术复杂,成本较高,还处于实验室研究阶段。
7.4 核酸疫苗
核酸疫苗是将编码病毒保护性抗原基因克隆到真核表达质粒直接注射到动物体内,合成抗原蛋白,诱导宿主产生保护性免疫应答。魏战勇等[24]成功将PPVVP2基因克隆至pCI-neo真核表达载体中并转染PK-15细胞中,并以小鼠为模型进行免疫,经检测1周后能诱导机体产生抗体,4周时达到最大,能诱导产生细胞免疫和体液免疫。基因疫苗以其成分单一、易于构建、生产工艺简单、免疫剂量小、成本低廉、免疫原性好、可构建多基因或多价疫苗。但是构建的核酸载体可能面临以下问题:是否与宿主的染色体发生整合,改变宿主的基因;载体本身是否会产生免疫应答;是否会诱发癌症等。
由于目前对PPV的防治只能是通过疫苗预防,所以选择合适的PPV疫苗对养猪业来说是非常重要的。随着人们对本病研究的不断深入以及生物学技术的飞速发展,将来会有更多的疫苗用于对PPV的防治。现将目前研究的各种疫苗的优缺点列出,以便选择使用(见表5)。

表5 不同疫苗优缺点比较
8 问题与展望
近年来,随着高致病性猪繁殖与呼吸综合征病毒(PRRSV)以及2型猪圆环病毒(PCV2)的出现,二者逐渐被视为引起大范围母猪繁殖障碍和仔猪死亡的主要原因,而对PPV感染的危害性估计不足,相关调查发现,PPV和PRRSV、PCV2混合感染的现象非常普遍,仍然是引起繁殖障碍的重要原因。PPV的早期研究主要集中在病原、理化性质与防治方面,随后在分子水平上明确了病毒基因组的一级结构、转录与翻译图谱,但实际研究中仍然存在着许多问题。
1)由于缺少前期的基础研究,现阶段的PPV研究中,无法深入地探究病毒各个基因和蛋白的功能,不能明确病毒与宿主、细胞的相互作用机制,无法从基因角度区分毒株致病力的强弱、改造毒力基因,因此构建PPV的感染性克隆,从分子生物学角度探究PPV的相关情况将成为PPV研究的重要内容;
2)病毒的致病机理研究尚停留在理论分析上,对于为什么引起死胎、畸形胎、木乃伊胎、流产及病弱仔猪,对母猪有无影响等一系列问题都有待于试验的探索与验证;
3)宿主的免疫机制、混合感染的协同作用机制等方面了解还不深入,有待进一步的研究。
[1]崔尚金,苗岚飞.猪细小病毒病流行的新特点、流行趋势与防控对策[J].养猪,2008(6):65-68.
[2]MayrA,BachmanPA.CharacterizationofaamallporcineDNAvirus[J].ArchGesamteVirusforsh,1968,25(l):38-51.
[3]贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[4]黄夏,陈义祥,何丹,等.广西猪细小病毒与PRRSV、CSFV、PCV2、PRV混合感染的检测[J].广西畜牧兽医,2007,23(2):54-56.
[5]KrakowkaS,AllanGM,EllisJ,etal.Experimentalinfectionofcolostrumsdeprivedpigletswithporcinecircovirus2andporcinereproductiveandrespiratorysyndromeviruspotentiatesPCV2replication[J].VetPathol,2000,37:254-263.
[6]崔立,姚从斌,芦银华,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒猪细小病毒混合感染的流行病学调查[J].上海交通大学学报,2006,24(4):330-334.
[7]BergeronJ.IdentificationoftheallotropicdeterminantandcomparisonwiththoseofNADL-2andfieldisolates[J].JVirol,1996,70(4):2508-2515.
[8]李永江,郭雪靖,武晓东.猪细小病毒血凝试验的几点体会[J].畜牧兽医科技信息,2006,31.
[9]JooHS,DonaldsonWoodCR,JohnsonRH.Amicroneutralizationtestfortheassayofporcineparvovirusantibody[J].ArchVirol,1975,47(4):337-341.
[10]姜永厚,孙宗禹,刘文周,等.应用ELISA双抗体夹心法检测猪细小病毒抗原的研究[J].黑龙江畜牧兽医,1997(04):1-3.
[11]冉旭华,闻晓波,孟凡,等.猪细小病毒NS1蛋白主要抗原表位区的原核表达及间接ELISA方法的建立[J].中国预防兽医学报,2009,29(8):964-968.
[12]付利芝.间接Dot-PPV-ELISA检测猪细小病毒抗体的研究[D].四川:四川农业大学,2001.
[13]蕫齐,韩孝成,王润芝.应用间接免疫荧光技术快速检测猪细小病毒抗原[J].中国预防兽医学报,1999,21(1):56-59.
[14]何启盖,陈焕春,吴斌,等.检测猪细小病毒血清抗体乳胶凝集试验方法的建立及初步应用[J].中国预防兽医学报,1999,21(6):457-459.
[15]吴淑芳,付瑞,邢瑞昌,等.猪细小病毒PCR检测方法的建立与应用[J].中国生物制品学杂志,2007,20(4):292-295.
[16]岳丰雄,等.多重PCR方法用于检测猪圆环病毒2型、猪细小病毒、猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒诊断方法的建立[J].养猪,2010(3):41-44.
[17]侯喜林,甘孟侯,余丽芸.应用地高辛探针诊断猪细小病毒病[J].中国兽医科技,1998,28(10):11-13.
[18]谢红玲,等.抗猪细小病毒单克隆抗体杂交瘤细胞株的制备及鉴定[J].中国预防兽医学报,2009,31(10):813-815.
[19]王温田,田振宇,徐守振.猪瘟病毒和猪细小病毒检测基因芯片的构建[J].中国动物检疫,2009,26(10):36-37.[20]符芳,杨玉菊,陈微晶,等.五种重要猪病病毒基因芯片探针的建立及其应用[J].中国兽医科学,2010,40(5):501-505.
[21]张超范,等,猪细小病毒灭活疫苗安全性试验及佐剂的筛选[J],中国预防兽医学报,2009,31(6):462-465.
[22]白安斌,杜坚,姚瑞英,等.猪细小病毒N株弱毒苗田间试验[J],广西畜牧兽医,2006,22(6):248-250.
[23]范京惠,左玉柱,王玉玲,等.猪瘟病毒T细胞表位与猪细小病毒VP2融合基因在重组杆状病毒中的表达[J].中国兽医科学,2007,37(8):661-665.
[24]魏战勇,王学斌,崔保安,等,猪细小病毒核酸疫苗的构建及其对小鼠免疫原性的研究[J].中国生物工程杂志,2006,26(12):63-67.
