液体发酵技术培养桑黄的工艺条件优化试验
2010-07-25李瑞雪汪泰初贾鸿英
李瑞雪 汪泰初 贾鸿英 胡 飞
(1安徽省农业科学院蚕桑研究所,安徽合肥 230061; 2安徽省农业科学院植保研究所,安徽合肥 230061)
桑黄(Phellinusigniarius)又名桑耳、胡孙眼和桑黄菇,是一类具有重要药用价值的大型真菌,属担子菌纲、多孔菌目、多孔菌科、层孔菌属[1]。桑黄的药用价值早在《本草纲目》中就有记载,中医认为桑黄性甘、平、味苦、味辛,入血分以化瘀,瘀血循经而行出血止,有化瘀之功效,用于治疗血崩、血淋、脱肛泻血、带下、闭经、脾虚泄泻等[2]。现代医学研究证明:桑黄中的活性成分具有抗菌、抗癌、保肝、提高免疫力的功效[3-7],是目前国际公认的生物抗癌领域中疗效非常好的药用真菌;同时,桑黄几乎无毒副作用,是开发保健食品的重要原料,因此已成为药用真菌研究领域的一个热点。
由于桑黄菌生理状态的特殊性和复杂性,生长周期又很长,需 3~4年[8],并且桑黄的生长对外部环境有一定的要求,故野生的成熟子实体很少。目前,市场上的桑黄大多以桑黄子实体及其粗加工的制品形式出现,在国际医药市场上价格昂贵、供不应求。利用液体发酵技术,可以在短期内获得大量的桑黄菌丝体,从而降低桑黄的开发成本,这对于保护天然资源、解决桑黄子实体资源缺乏、服务医疗保健、满足市场需要、提高社会和经济效益等,均具有十分重要的意义。为此,我们对利用液体发酵技术培养桑黄的工艺条件进行了优化,以期为提高桑黄产量、生产与利用桑黄及其开发相关产品提供技术支撑。
1 材料和方法
1.1 材料及主要试剂
1.1.1 试验菌种 桑黄菌种 L6由安徽大学生命科学学院糖复合物与糖工程实验室提供。
1.1.2 培养基及试剂 ①斜面母种培养基(PDA培养基):马铃薯 200g/L,葡萄糖 20g/L,琼脂20g/L,蒸馏水定容。②液体种子培养基(基础培养基):马铃薯 200g/L,葡萄糖 20g/L,蒸馏水定容。③碳源优化基础培养基:蛋白胨 10g/L,酵母粉10g/L,蒸馏水定容。④氮源优化基础培养基:葡萄糖40g/L,蒸馏水定容。碳、氮源及无机盐等生物试剂为国产化学纯。
1.1.3 试验仪器 手提式压力蒸汽灭菌器 YXQ.S G4/280型(上海华线医用核子仪器有限公司),全温振荡培养箱 HZP-250型(上海精宏实验设备有限公司),循环水式真空泵 SHZ-D型(河南巩义英豫华仪器厂),电热鼓风干燥箱(南京实验仪器厂),梅特勒电子天平 AE200型(上海沪西分析仪器厂)。
1.2 桑黄菌种的培养方法
1.2.1 母种的活化 将保存的桑黄的菌种接种到斜面母种培养基上,在恒温光照培养箱中 26℃的条件下培养 8d后,活化 2次备用。
1.2.2 液体种子的制备 在 250mL三角瓶中装入100mL液体种子培养基,将活化 2次的 L6斜面菌株取一定量菌丝接入液体种子培养基上,在全温震荡培养箱 26℃、140r/min,培养 5d,再用高速分散器将菌丝打碎,获得桑黄菌种子液备用。
1.3 菌丝体生物量的测定
用布氏漏斗真空抽滤摇瓶发酵醪,用蒸馏水反复冲洗 3次菌体后,收集湿菌体置于电热鼓风干燥箱中,用 50(±5)℃烘干至恒重后,用电子天平准确称其质量(精确至 0.001g),得菌丝体干物质量(即生物量,单位 mg/mL)。
1.4 培养桑黄工艺的优化
1.4.1 培养基碳源的选择 将供试碳源,麦芽糖、葡萄糖、白砂糖、蔗糖、麸皮、玉米粉、甘油(其中麸皮、玉米粉煮沸 20min,2层纱布过滤,取滤液)按40g/L的比例,分别加入碳源优化基础培养基,用250mL三角瓶装入 100mL培养基,按 15%接种量分别接种备用的桑黄菌种液,于 26℃,140r/min的振荡培养箱培养 7d后,测定桑黄菌丝体生物量。
1.4.2 培养基氮源的选择 供试氮源 9种,分别为蛋白胨、酵母粉、牛肉膏、蚕蛹粉、马铃薯、黄豆粉、NaNO3、(NH4)2SO4、NH4NO3(其中蚕蛹粉、马铃薯 、黄豆粉煮沸 20min,2层纱布过滤,取滤液)。它们在配制 1L培养基中的添加量,根据各自的全氮含量相对于 10g蛋白胨的含氮量进行折算(不同氮源全氮含量如表 1),分别加入氮源优化基础培养基,按 1.4.1的接种方法和培养条件培养 7d后,测定桑黄菌丝体生物量。
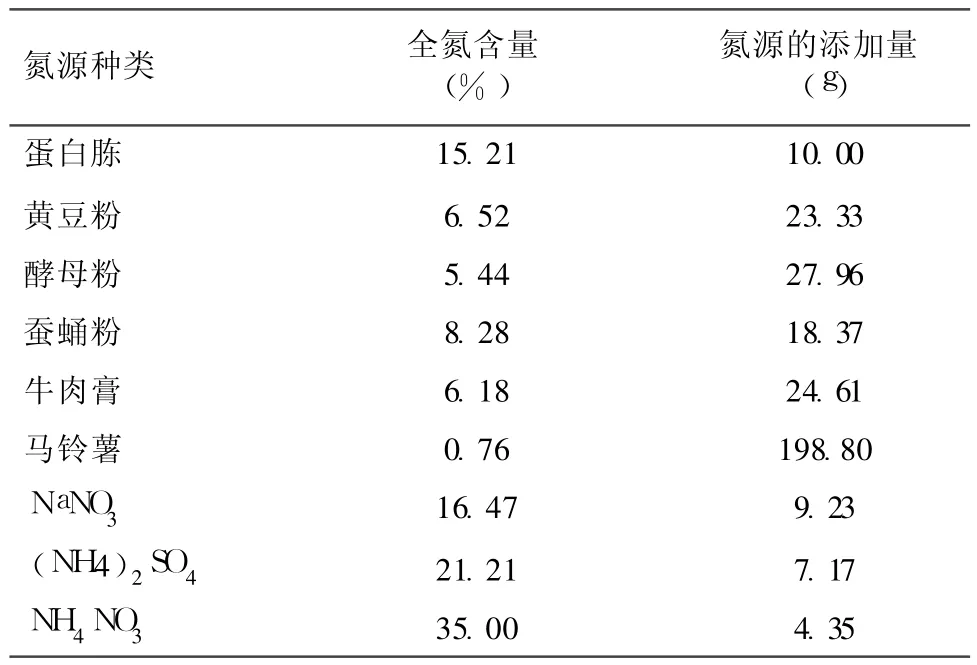
表1 配制 1L培养基中不同氮源的添加量
1.4.3 培养基浓度配比优化正交试验 为了进一步探讨培养基中碳源、氮源和营养生长因子等各成分的交叉影响,根据确定的最佳碳源—玉米粉、最佳氮源—马铃薯、KH2PO4及丝氨酸做营养生长因子,设计了一个 4因素 3水平的正交表 L9(34),各因素、水平见表 2。按 1.4.1的接种方法和培养条件培养 7d后,测定桑黄菌丝体生物量。
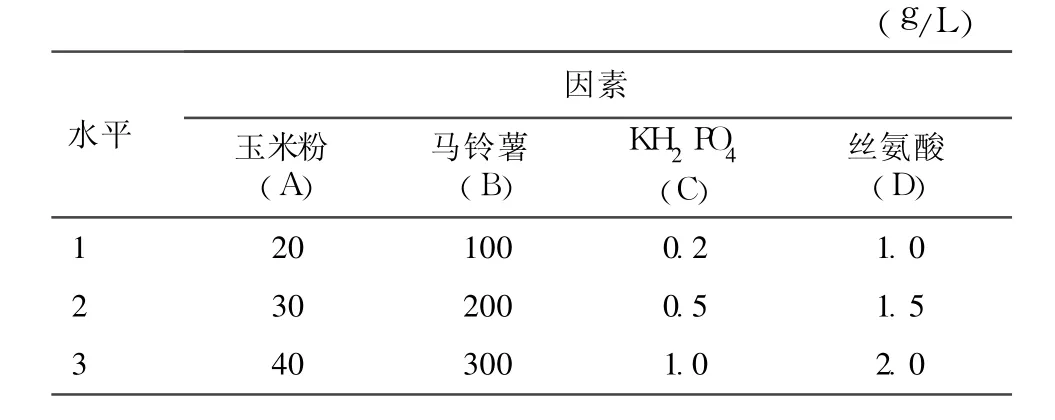
表2 培养基正交因素水平表
1.4.4 非营养性因素的选择与优化 培养最适温度的选择:利用基础培养基培养,接入菌种后,分别在 25、26、27、28、29 ℃的温度条件下,自然初始 pH值,140r/min的振荡培养箱培养 7d,分别测定 L6菌丝体生物量,确定最适温度。
初始 pH值的选择:将基础培养基的 pH值分别调至 5.0、5.5、6.0、6.5、7.0、7.5、8.0,接入菌种,于27℃下 140r/min的振荡培养箱培养 7d,分别测定L6菌丝体生物量,确定最适 pH值。
培养时间的选择:利用基础培养基培养,接入菌种后,于 27℃下 140r/min的振荡培养箱,自培养第1天起,每隔 24h测定 1次 L6菌丝体生物量,连续测 12d,确定最适培养时间。
种龄、接种量、装液量及转速的优化:为综合确定种龄、装液量、接种量和培养箱转速各条件参数,设计了一个 4因素 3水平的正交试验,各因素、水平见表 3。利用基础培养基接入菌种后,分别于初始pH值 6.0,27℃,培养 6d,分别测定 L6菌丝体生物量,确定最适种龄、接种量、装液量及转速。

表3 培养条件正交因素水平表
1.5 培养工艺优化前后菌丝体生物量比较
优化前培养工艺:培养基为马铃薯 200g/L、葡萄糖 20g/L,蒸馏水定容;培养条件为在自然初始 pH值、摇床转速 140r/min、培养温度 26℃条件下,将培养 4d的液体母种以 15%的接种量,接种到装有100mL液体培养基的 250mL三角瓶中,培养 7d。
优化后培养工艺:培养基为玉米粉30g/L、马铃薯 300g/L、KH2PO40.5g/L、丝氨酸 1.0g/L,蒸馏水定容;培养条件为在初始 pH值 6.0、摇床转速130r/min、培养温度 27℃条件下,将培养 3d的液体母种以 15%的接种量,接种到装有 100mL液体培养基的 250mL三角瓶中,培养 6d。在培养工艺优化前后 2种条件下,液体培养桑黄 L6菌种,分别测定菌丝体生物量。
2 结果与分析
2.1 培养基碳源的选择
从图 1可以看出,培养基中利用不同的碳源培养,对 L6菌丝体生物量有较大影响,其中以玉米粉作为碳源时,L6菌丝体生物量最高,达 12.040mg/mL,葡萄糖、麦芽糖做碳源时产量也较高。但从生产成本考虑,玉米粉价格低廉,来源广泛,适合工业化生产,故确定玉米粉为 L6液体培养最佳碳源。
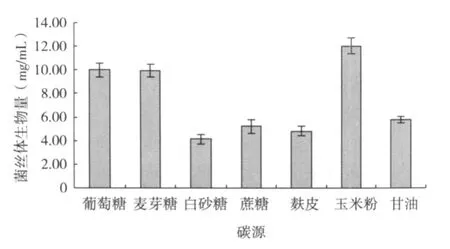
图1 不同碳源对 L6菌丝体生物量的影响
2.2 培养基氮源的选择
培养基中利用不同的氮源培养,桑黄菌丝体生物量有显著的差异(图 2),其中以马铃薯作氮源时其菌丝体生物量最高,为 12.510mg/mL;因此,本试验确定马铃薯为 L6液体培养最佳氮源。另外黄豆粉作氮源生物量也较高,故可选用黄豆粉做氮源来拓宽可用的氮源领域。试验还发现无机氮源不利于L6的生长,估计这与无机盐中的氮不能被菌株有效吸收利用有关。

图2 不同氮源对L6菌丝体生物量的影响
2.3 培养基优化正交试验结果
试验结果见表 4,根据各因素 k的变化率可以看出各因素的较优组合为 D1C2B3A2,综合考虑确定 L6液体培养的最佳培养基配方为:玉米粉 30g/L,马铃薯 300g/L,KH2PO40.5g/L,丝氨酸 1.0g/L。从表 5方差分析结果可以看出,各因素对 L6菌丝体生物量的影响程度由大到小依次为 D、C、B、A因素,其中 D、C因素在 99%的置信度下有极显著影响(P<0.01),B、A因素在 95%的置信度下有显著影响(P<0.05)。
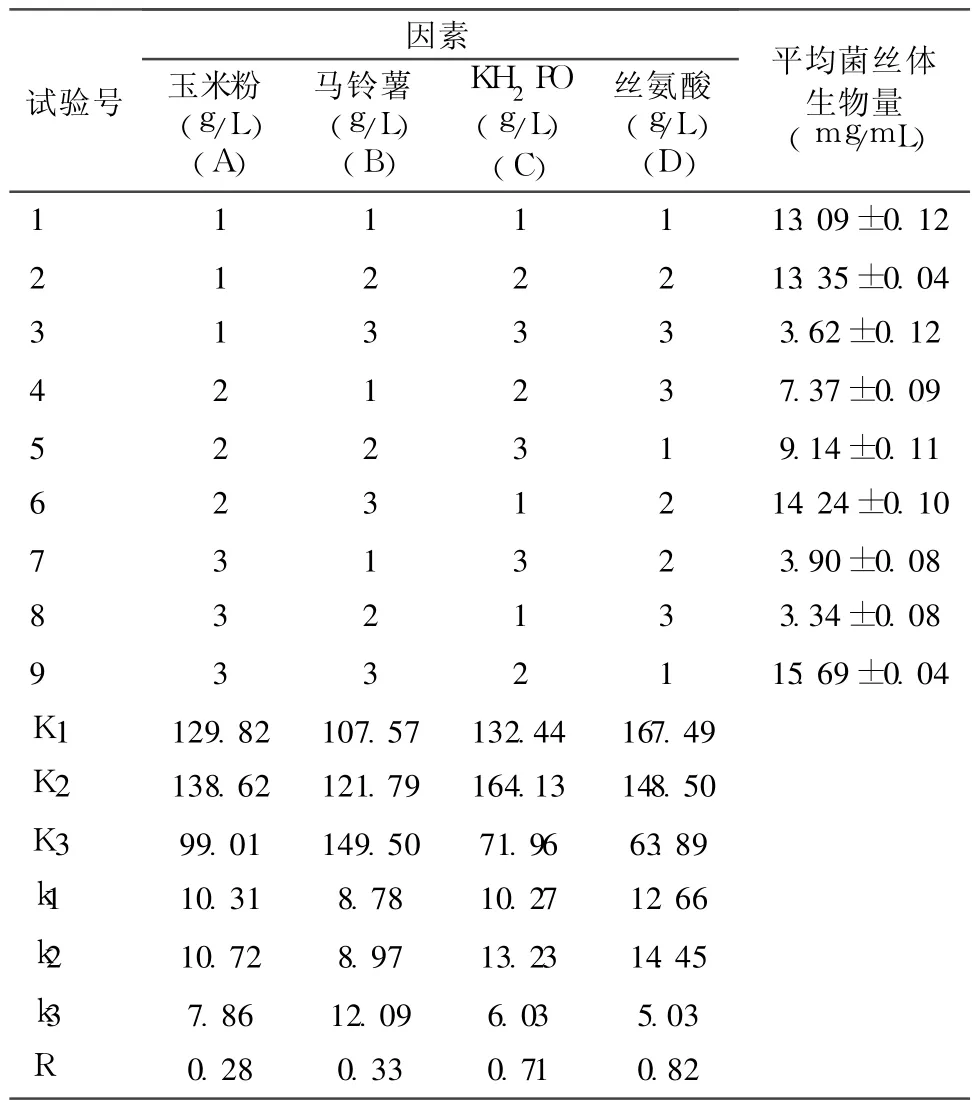
表4 L6液体发酵培养基配比优化正交试验结果
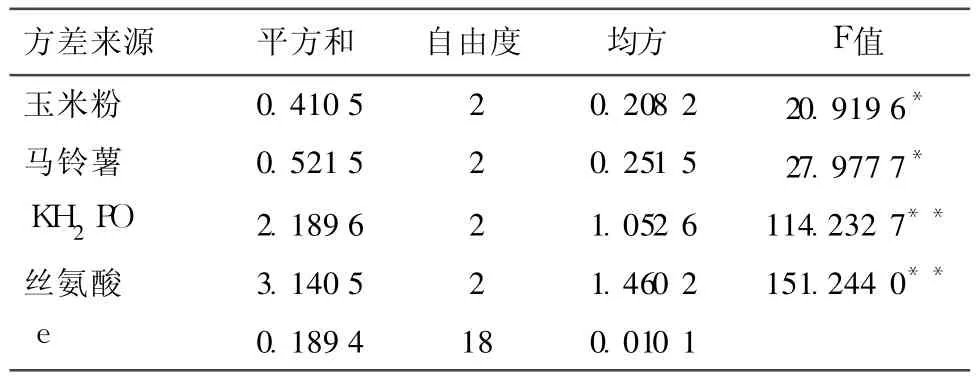
表5 L6液体发酵培养基配比优化正交试验结果方差分析
2.4 非营养性因素的选择与优化
2.4.1 发酵培养温度 从用 5个不同的温度进行液体培养的结果看(图 3),27℃时菌丝体生物量最高,达 9.528mg/mL,温度过高过低均不利于菌株生长,故选择 27℃为最佳发酵培养温度。
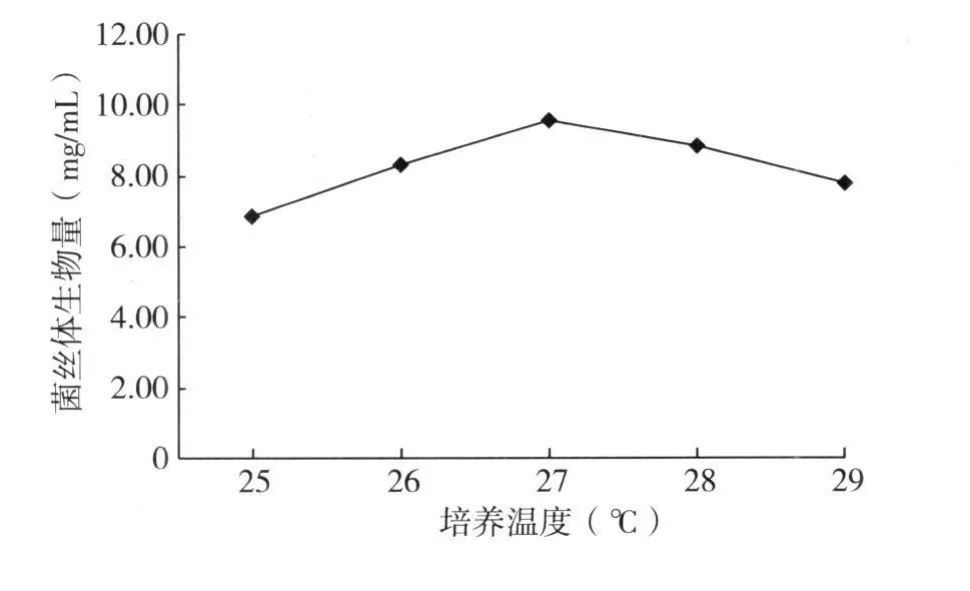
图3 培养温度对 L6菌丝体生物量的影响
2.4.2 发酵培养初始 pH值 由于 pH值影响到菌丝体的通透性、对微量元素的吸收及各种酶的活性;因此,在发酵生产时 pH值通常被作为一项重点检测参数。选择最适初始 pH值的原则是既有利于菌株的生长繁殖,又可以最大限度地获得高的产量。从用不同的初始 pH值进行液体培养的结果看(图4),初始 pH值为 6.0时,L6菌株生长良好,菌丝体生物量最高,当初始 pH值大于 6.5时,菌丝体生物量有明显下降,说明在偏碱性条件下不利于菌株的生长。最终确定液体培养最佳初始 pH值为 6.0。
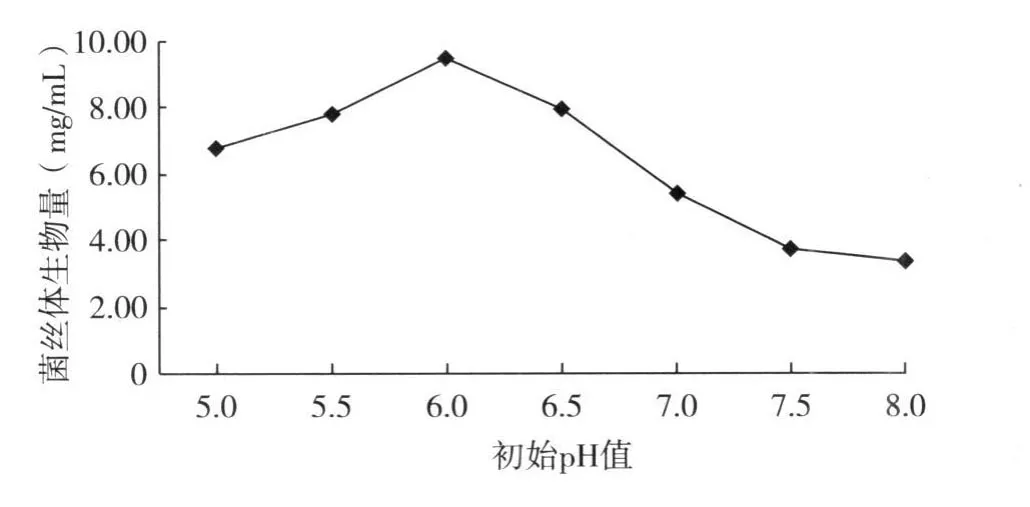
图4 初始pH值对L6菌丝体生物量的影响
2.4.3 发酵培养时间 由图 5可以看出,随着培养时间的增加,L6菌丝体生物量不断增加,第 7天时产量最高,达 9.578mg/mL;其中第 6天产量为9.510mg/mL,略低于第 7天时的产量,此后随着培养时间的延长产量开始逐渐下降,原因可能是培养基中的营养物质消耗殆尽,菌体衰亡而影响了菌株生长。考虑到培养时间的延长会增加生产成本,故确定 6d为最佳培养时间。
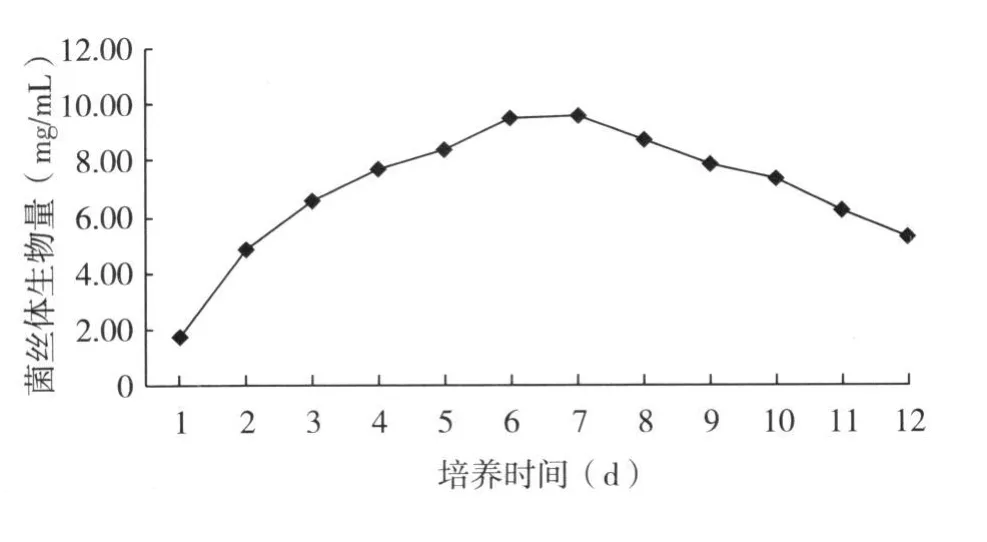
图5 培养时间对L6菌丝体生物量的影响
2.4.4 种龄、接种量、装液量及培养箱的转速对 L6菌丝体生物量的影响 从表 6-7及方差分析结果可以看出,各因素对 L6菌丝体生物量的影响程度由大到小依次为 E、G、F、H因素,其中 E、G因素在95%的置信度下有显著影响(P<0.05),F、H因素无显著影响。根据各因素 k的变化率可以看出最佳因素搭配为 E1G2F2H1,即以菌丝体生物量为指标,L6液体培养的最佳培养条件是:将培养 3d的液体母种以 15%的接种量,接种到装有 100mL液体培养基的 250mL三角瓶中,在 130r/min、27℃条件下培养 6d。
2.5 培养工艺优化前后菌丝体生物量比较
在培养工艺优化前后 2种条件下,液体发酵培养 L6,分别测定 L6的菌丝体生物量,用优化前的工艺条件培养 L6菌丝体生物量为 9.240mg/mL,用优化后的工艺条件培养 L6菌丝体生物量可高达16.687mg/mL,比优化前提高了 80.6%。经 SPSS统计分析软件对结果进行分析可知,P<0.01,两者差异极显著。

表6 L 6液体发酵培养条件优化的正交试验结果
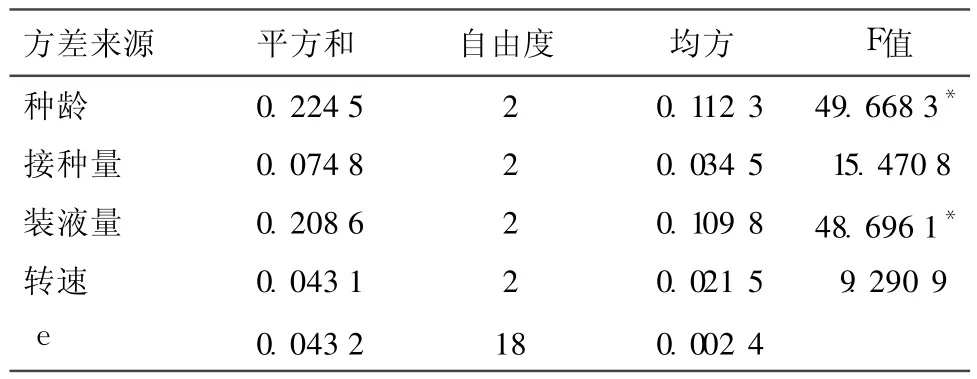
表7 L 6液体发酵培养条件优化的正交试验结果方差分析
3 小结与讨论
从微生物的营养因素要求来看,所有的微生物都需要碳源、氮源、无机盐及生长因子,微生物的生长发育过程也需要大量的微量元素,另外有些产品的生产还需要使用诱导剂、前体和促进剂。在实验室规模上配制含有纯化合物的培养基是相当简单的,虽然它能满足微生物的生长需求,但在大规模生产中往往不适合,而研究桑黄生长的培养条件时,其基本宗旨是给以后工业化生产提供依据;因此,在培养条件的筛选上,力求筛选出既可以最大限度地提高产量,又使用廉价的原材料,从而降低生产成本。
通过单因素筛选及正交试验确定,优化后的最佳液体培养基配方:玉米粉 30 g/L,马铃薯 300 g/L,KH2PO40.5 g/L,丝氨酸 1.0 g/L;最佳培养条件:在初始 pH值 6.0、摇床转速 130 r/min、培养温度27℃条件下,将培养3 d的液体母种以 15%的接种量,接种到装有 100m L液体培养基的 250mL三角瓶中,培养 6 d。优化后桑黄产量比优化前提高了80.6%。从本试验看,在优化的液体培养工艺下,虽然桑黄 L6菌丝体生物量比优化前提高了 80.6%,但菌株L6的产量还不是很高;为了进一步提高其产量,今后还需要通过对其具体的代谢途径,添加合适的诱导物、刺激物等方面作进一步的研究。
[1]孙淑静,江玉姬,朱虎,等.药用真菌桑黄的研究现状[J].药物生物技术,2005,12(2):138-140.
[2]刘波.中国药用真菌[M].太原:山西人民出版社,1974.
[3]宋力,孙培龙,郭彬彬,等.桑黄的研究进展[J].中国食用菌,2005,24(3):7-11.
[4]温克,陈劲,李红,等.桑黄等四种抗癌药物活性比较[J].吉林大学学报(医学版),2002,28(3):247-249.
[5]Kim G Y,Lee JY,Lee JO,et a1.Paritial characterization and immunostimulatory effect of a novel polysaccharide-protein comlex extracted from phellinus linteus[J].Biosci Biotechnol Biochem,2006,70(5):1218-1226.
[6]刘春辉,陈体强,林跃鑫.药用真菌桑黄的研究进展[J].菌物研究,2004,2(2):53-59.
[7]孙培龙,徐双阳,杨开,等.珍稀药用真菌桑黄的国内外研究进展[J].微生物学通报,2006,33(2):119-123.
[8]戴玉成.药用担子菌——鲍氏层孔菌(桑黄)的新认识[J].中草药,2003,34(1):942-951.
