舒芬太尼对培养大鼠乳鼠缺氧心肌细胞损伤保护作用的研究1)
2010-06-29王丽丽赵建力刘保江
王丽丽,赵建力,刘保江
舒芬太尼属于纯μ受体激动药,在作用效应、受体亲和力、脂溶性、药代动力学及血流动力学稳定方面都有较大优势[1],舒芬太尼作为强效麻醉性镇痛药,已经逐步取代芬太尼用于麻醉及镇痛[2]。本课题选用氰化钠造成培养心肌细胞缺氧(细胞内缺氧)模型,排除了血流动力学及其他因素在缺氧损伤的影响,研究舒芬太尼对细胞缺氧损伤的直接作用,从而提示舒芬太尼对机体的非麻醉作用即抗损伤作用。
1 材料与方法
1.1 实验动物 新生的SD大鼠(2~3)月16只~20只(由山西医科大学实验动物中心提供)。
1.2 主要试剂和器材 舒芬太尼(批号080506,湖北宜昌人福药业有限公司)、D-Hank液、四唑盐(MTT)、EM EM(Dulbecco'smodified Eaglemedium,美国Sigma公司)、胰蛋白酶、多聚赖氨酸(华美生物工作公司进口分装)、氰化钠(山西医科大学法医学教研室)、超净室、相差显微镜、JEOL-100CX型透射电镜。
1.3 心肌细胞培养[3,4]将乳鼠麻醉后消毒,断颈处死,开胸取心脏置于培养皿中,用含抗生素的D-Hank液冲洗两遍,去心包膜和大血管,剪成碎泥状,移入50 m L离心管,0.125%的胰蛋白酶37℃水浴中消化15 m in,如此重复5次~7次,使组织块消化完全,将第一次的细胞悬液弃去,收集以后的细胞悬液经120目尼龙网过滤至含胰蛋白酶终止液(小牛血清)的50 m L离心管中,离心机1 000 r/min离心10m in,弃上清液,加入培养液(80%DMEM,10%小牛血清,10%胎牛血清,100 kU/L青霉素,100 k U/L链霉素)混悬,台盼蓝染色计数,调整细胞浓度至1×109/L。移至培养瓶中,置37℃,5%CO2培养箱中培养2 h以纯化心肌细胞(反复贴壁法)然后接种到预先涂有0.01 g/L多聚赖氨酸的24孔培养板中培养,2 d后换掉2/3液,以后按每72 h换液一次,每次换液一半。
1.4 抗缺氧实验[5]取培养6 d~8 d整孔搏动相邻的两列(每列8孔)细胞,将紧邻的两孔随机分成对照组及suf1组(缺氧+0.1 ng/m L舒芬太尼),C组为suf 2组(缺氧+0.2 ng/m L舒芬太尼)。将舒芬太尼(0.1 ng/m L、0.2 ng/m L)分别加入su f 1组、su f 2组;对照组给予等量的DM EM。37℃,5%CO2条件下培养24 h,四唑盐(MTT)微量自动比色A值,然后两组均给予终浓度为1mmol/L的氰化钠造成细胞内缺氧,分别在缺氧12 h、24 h测定各组的A值,两组实验同时进行。
1.5 细胞形态学观察 用倒置显微镜观察心肌细胞胞浆内空泡、颗粒及细胞膜伪足的变化。将每组的各孔细胞用刮勺刮取离心固定,切片染色,透射电镜观察。
1.6 MTT微量自动比色方法[6]于96孔板每孔内加入50 μL M TT液(1.5 g/L),继续培养4 h,以0.08 mmol/L盐酸异丙醇100μL中止反应,酶联免疫吸附测定法(ELISA)测定每孔A值(测定波长595 nm,参考波长655 nm)。无细胞孔做空白(Blank)。
2 结 果
2.1 心肌细胞培养 培养24 h后,大部分细胞已贴壁,贴壁细胞呈不规则圆形,折光性强,胞体饱满,周围有一圈光晕。培养3 d后,大部分细胞已搏动,频率为90/m in~120/m in,并且连成片状呈细胞簇状搏动。此时细胞融合成簇状,肌纤维明显,6 d后交织成网状,搏动有力。
2.2 形态学观察 ①倒置显微镜观察,对照组心肌细胞在处理即时,形态未见明显变化;在37℃5%CO2培养箱中培养12 h,大部分细胞体肿胀,失去折光性,胞质内出现颗粒;缺氧24 h后,心肌细胞体出现明显肿胀,颗粒增多,部分细胞胞膜破裂。su f 1组、su f 2组心肌细胞在处理即时,形态未见明显变化;在37℃5%CO2培养箱中培养12 h后,大部分细胞肿胀,内有颗粒,细胞膜完整;缺氧24 h后,肿胀明显,胞质内颗粒增多,失去折光性。②电镜观察,对照组缺氧培养12 h后,线粒体肿胀明显,嵴破裂,空泡变,内质网扩张部分空泡形成;培养24 h后,内质网扩张断裂成大小不等的片段和小泡,细胞膜损伤严重,可见到线粒体严重损伤形成的髓鞘样结构(myelin figure)。suf 1组、su f 2组缺氧培养12 h后,可见内质网扩张,线粒体肿胀,嵴明显,双层膜可见;培养24 h后,内质网扩张、断裂,线粒体肿胀明显,嵴破裂,膜模糊甚至消失,线粒体肿胀空泡变,胞浆内有大水泡状结构。
2.3 抗缺氧实验(见表1)
表1 各组缺氧前后心肌细胞A值比较(±s)
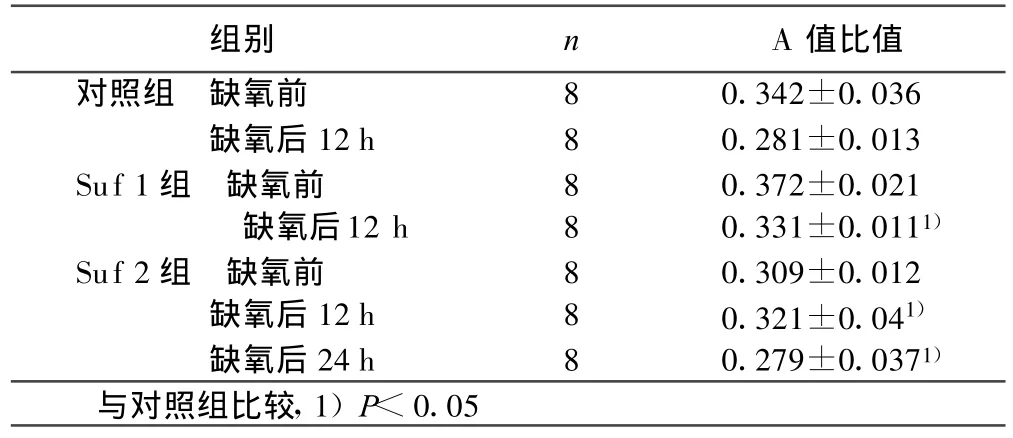
表1 各组缺氧前后心肌细胞A值比较(±s)
组别n A值比值对照组 缺氧前8 0.342±0.036缺氧后12 h 8 0.281±0.013 Su f 1组 缺氧前8 0.372±0.021缺氧后12 h 8 0.331±0.0111)Su f 2组 缺氧前8 0.309±0.012缺氧后12 h 8 0.321±0.041)缺氧后24 h 8 0.279±0.0371)与对照组比较,1)P<0.05
3 讨 论
机体的缺氧表现多样化,并不处于恒定的缺氧状态,循环系统、白细胞等多种因素都参与到此过程。为达到实验的可控性及实验的单因素分析,采用心肌细胞单层贴壁培养法培养心肌细胞,氰化钠引起细胞缺氧损伤来进行实验。
研究表明MTT可被活细胞吸收,并在线粒体内还原成蓝色,用ELISA法测定培养液中甲的A值,可反映活细胞数量及琥珀酸呼吸链的状态。本研究结果表明su f 1组、su f 2组在缺氧的12 h、24 h所测A值均明显高于对照组,舒芬太尼对心肌细胞缺氧损伤有一定的保护作用。
舒芬太尼对反应氧化物代谢的影响及由此可能产生的药理或毒理效应尚未完全明确,舒芬太尼对反应氧化物或自由基的形成和代谢的研究报道不一致[7]。对舒芬太尼保护心肌的机制有很多方面尚不清楚,本课题只是初步性了解了舒芬太尼的心肌保护作用。
[1] Yang L,Mao L,Tang Q,et a l.A novel Ca2+-independent signaling pathw ay to extracellular signal-regulated protein kinase by coactivatiom of NMDA recep tors and metabotropic glu tamate receptor 5 in neurons[J].JNeurosci,2004,24:10846-10857.
[2] Kato A,Ozawa F,Saitoh Y,et a l.Novelm enmbers of the Vesl/H omer fam ily of PDZ proteins that bind metabotropic glu tamate recepto rs[J].JBiolChem,1998,273:23969-23975.
[3] Erie J,Mu rph P,Lloyd AH.Mechanism of hypoxic and ischemic inju ry-usecell cu lture models[J].M ol Chem Neu ropathol,1993,19:95-106.
[4] David J,M ilitich H,Khan A,et a l.U se of heart cell cultu res as a tool for the evalu tion of halothan arrhythm ia[J].Toxicol Appl pharmacol,1983,70:181-187.
[5] 何小华,李承晏,余绍祖.黄芪的抗神经细胞缺氧损伤作用[J].中华神经科杂志,1998,31(4):204-206.
[6] M iyabe T,M iletic G,M iletic V.Loose lingation of the sciatic nerve in rats elicits transient up-rengu lation of H omerlagene ex pression in the spinal dorsal horn[J].Neu rosci Lett,2006,398:296-299.
[7] Yuan JP,K iselyov K,Shin DM,et al.Homer binds TRPC fam ily channels and is required for gating of TRPCIBY IP3 recepto rs[J].Cell,2003,114:777-789.
