促黄体生成激素酶促化学发光免疫分析方法的建立
2010-05-16刘佳宁刘一兵贾娟娟许文革张雪峰韩世泉
刘佳宁,刘一兵,贾娟娟,许文革,张雪峰,韩世泉
(中国原子能科学研究院同位素研究所,北京 102413)
促黄体生成激素(Luteinizing Hormone,L H)是由脑垂体前叶嗜碱性细胞分泌的一种糖蛋白类促性腺激素,含219个氨基酸,相对分子质量约30 000,由非特异的α亚基和特异的β亚基组成,L H与特异性受体的相互作用及信号转导由β亚基决定[1]。促黄体生成激素受体主要存在于卵泡颗粒细胞、黄体细胞和睾丸间质细胞膜上,L H与细胞膜上相应受体结合后通过腺苷酸环化酶系统刺激甾体激素生成,在受精卵着床、性腺发育及功能调节中起重要作用[2]。垂体L H的分泌受下丘脑分泌的促性腺激素释放激素的严格控制,随女性月经周期而呈周期性变化,通过刺激卵巢合成类固醇而促进排卵和黄体生成,并促进黄体分泌雌激素和孕激素;对男性则促进睾丸间质细胞增生,分泌雄激素[3]。检测L H含量对预测排卵期、更年期综合征、多囊卵巢综合征、原发性不孕症、月经失调、子宫内膜异位症、性腺功能低下等生殖系统的生理研究、疾病诊疗、随访等具有重要意义[4]。目前L H的检测主要有放射免疫分析、免疫放射分析、酶联免疫分析、时间分辨荧光免疫分析、胶体金试纸条、化学发光免疫分析等多种标记免疫分析方法。其中,化学发光免疫分析具有无放射性污染、检测范围宽、灵敏度高、发光迅速、操作简便等优点,近年来发展迅猛,是目前推广应用最快的免疫分析方法之一。
本工作拟根据酶促化学发光免疫分析方法原理,建立血清L H的酶促化学发光免疫分析方法。
1 实验材料
1.1 主要仪器
化学发光检测仪及其软件:Wallac公司产品;GAMMA-C12γ计数器:DPC公司;1260Ⅱ型γ计数器:L KB公司产品。
1.2 主要试剂
标记单克隆抗体(L H5301)和包被单克隆抗体(L H5304):Medix公司产品;L H标准品抗原:ICN Biomedical公司产品;辣根过氧化物酶(HRP)、Tween-20:Sigma公司产品;化学发光板:购自深圳金灿华实业有限公司;胎牛血清:北京元亨圣马生物技术研究所产品;发光底物:原子高科股份有限公司医学二部提供。
2 实验方法
2.1 标准品的配制
将L H标准品用中国药品生物制品检定所标准品标定后,用灭活胎牛血清稀释为1.5、5、15、45、100、200 IU/L,每瓶 0.5 mL 分装冻干后-20℃保存备用,使用前每瓶加0.5 mL蒸馏水复溶。
2.2 固相抗体的制备
用0.1 mol/L p H9.5的碳酸缓冲液(CB)将抗L H单抗(L H5304)稀释为5 mg/L,以每孔200μL加入化学发光板中,4℃过夜;弃去包被液,拍干,每孔加250μL封闭液(含0.4%明胶,2%丙三醇,5%蔗糖,p H 7.4),37℃封闭1 h;倒出封闭液,晾干备用。
2.3 酶标抗体的制备
采用改良高碘酸钠氧化法[5]制备L H的酶标记物,辣根过氧化物酶与L H5301均为1 mg。酶标记物于0.02 mol/L p H 7.4的磷酸缓冲液(PB)中透析过夜后加入等体积甘油,-20℃保存备用。
2.4 酶促化学发光免疫分析程序
向包被好的化学发光板中同时加入50μL标准品或待测样本和150μL酶标抗体,37℃温育1 h,弃去反应液,用磷酸缓冲液(含0.05%Tween-20的0.02 mol/L p H 7.4)清洗酶标板,每孔300μL,清洗4次。然后加入新鲜配制的发光底物工作液,每孔200μL,室温静置1 min。在化学发光仪上检测发光计数率,以发光计数率为纵坐标,标准品浓度为横坐标,采用双对数作图法绘制标准曲线并拟合线性回归方程,根据样品的发光计数率,计算出血清样品中L H的浓度。
3 结果与讨论
3.1 方法学建立
3.1.1 包被浓度选择 以0.1 mol/L p H 9.5的CB将包被用的单克隆抗体L H5304分别稀释为1、2、5和10 mg/L,酶标记抗体稀释为1∶1 5 000,标准品为50μL,酶标抗体为150μL,37℃反应1 h,观察不同包被浓度对免疫分析结果的影响,结果示于图1。由图1可见,不同包被浓度下各标准点发光计数率基本相同,考虑到包被板的稳定性,选择5 mg/L作为本分析方法的包被浓度。

图1 L H包被浓度选择◇——0; □——1.5 IU/L; △——5 IU/L; ×——15 IU/L;●——45 IU/L; ○——100 IU/L;+ ——200 IU/L
3.1.2 酶标抗体稀释度选择 确定包被浓度后,将辣根过氧化物酶标记的L H5301抗体分别稀释 5 000、10 000、15 000、20 000 倍 ,观察不同酶标记抗体浓度对免疫分析结果的影响,以发光计数率和标准品浓度的双对数作标准曲线,计算线性拟合相关系数和信噪比,结果列于表1。根据其曲线信噪比和线性相关系数选定酶标记抗体工作浓度为1∶10 000。
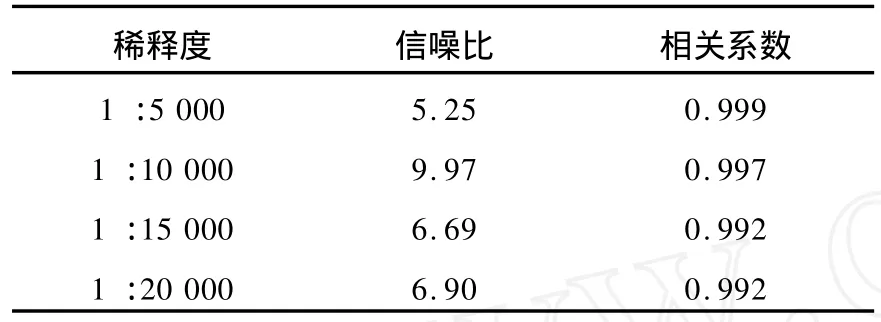
表1 L H酶标抗体稀释度选择
3.1.3 反应体积选择 确定了最佳包被浓度和酶标抗体稀释度后,设定不同的标准品和酶标抗体体积,37℃下反应1 h,检测发光计数率,以发光计数率和标准品浓度的双对数作标准曲线,计算线性拟合相关系数和信噪比,结果列于表2。根据其曲线信噪比和线性相关系数选择反应体积为标准品50μL,酶标抗体150μL。准曲线,结果示于图3。由图3可得曲线线性拟合方程:y=1.059 5 x+4.235 2,相关系数 r=0.999。同时平行测量10个零标准品的发光计数率,计算 ¯x+2s,将此值带入曲线方程,求出对应的浓度为0.08 IU/L,此为方法学的灵敏度。
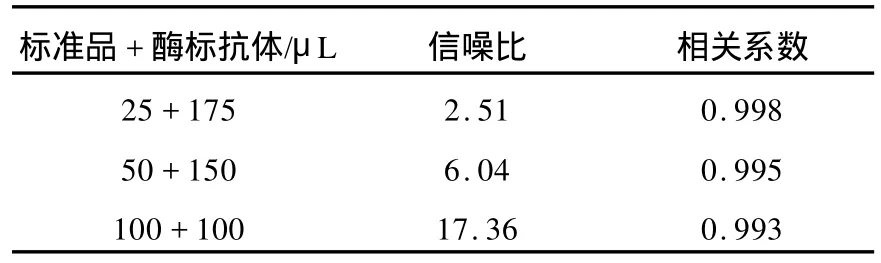
表2 L H反应体积选择
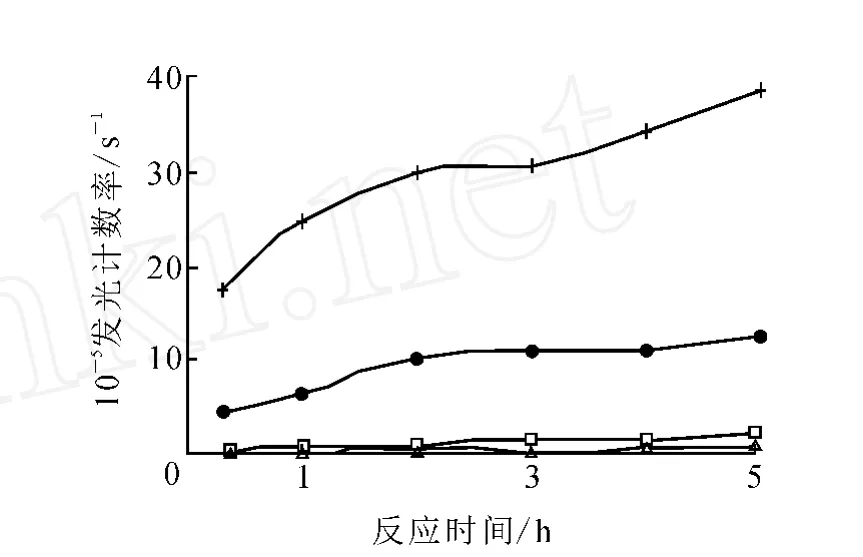
图2 L H反应时间选择◇——0; □——1.5 IU/L; △——5 IU/L;●——45 IU/L;+ ——200 IU/L
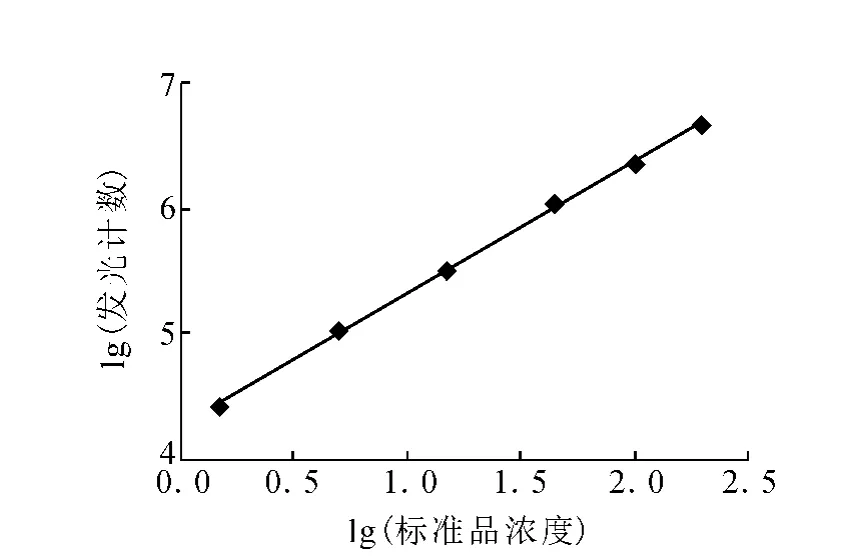
图3 L H酶促化学发光免疫分析方法标准曲线
3.1.4 反应时间选择 确定了包被浓度、酶标抗体稀释度和反应体积后,设定反应时间为20 min,1、2、3、4、5 h,观察发光计数率 ,结果示于图2。由图2可见,随反应时间延长,发光计数率逐渐增加,反应2 h时基本达到平衡,为实现临床快速检测,选择反应时间为1 h。
3.2 方法学鉴定
3.2.1 标准曲线及方法灵敏度 根据上述实验确定的参数,建立L H酶促化学发光免疫分析标
3.2.2 精密度 对L H含量为高、中、低的质控血清分别在一次实验中平行多孔测定和在不同实验中重复测定,计算批内、批间变异系数,结果列于表3。由表3可知,本方法的批内变异系数分别为8.36%、3.56%和4.09%,批间变异系数分别为5.14%、9.57%和10.23%。此结果符合方法学的要求。
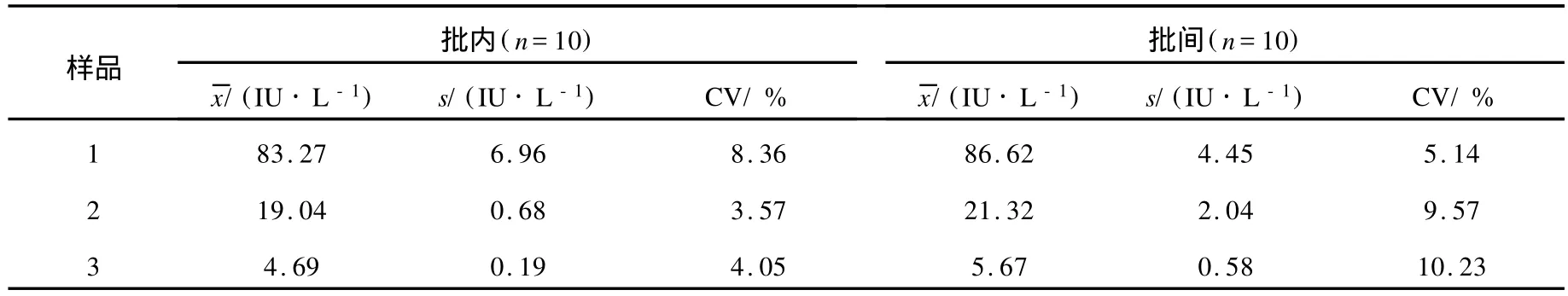
表3 批内、批间变异系数测定结果
3.2.3 健全性 将1份高浓度L H血清样品进行倍比稀释后测定,相关曲线示于图4。由图4可得相关方程为:y=43.18 x-2.601,相关系数r=0.995。稀释度与检测值呈线性相关,该结果符合免疫分析的要求。
3.2.4 回收率 向3份血清样品中加入已知浓度的L H标准品,测定其回收率,结果列于表4。由表 4可知,本方法的回收率为 96.3%~112.1%,平均104.3%,符合免疫分析的要求。
3.2.5 特异性 分别用“零”标准品将高浓度FSH、TSH、HCG抗原稀释为正常值的10倍以上,按照分析程序进行测定,检测其中L H的含量,换算为质量单位,计算交叉反应率,结果列于表5。由表5可知,本分析方法与 FSH、TSH无明显交叉,与 HCG存在交叉反应。
L H与 HCG属于同一个超家族,具有相似的立体结构,二者结合于一个共同受体L H/HCG-R[7]。编码 L Hβ亚基的基因定位于19q13.3,与 hCGβ链基因相邻,hCGβ亚基有85%的序列与L Hβ亚基的前114个氨基酸同源[8],因此L H与 HCG更容易出现交叉反应。
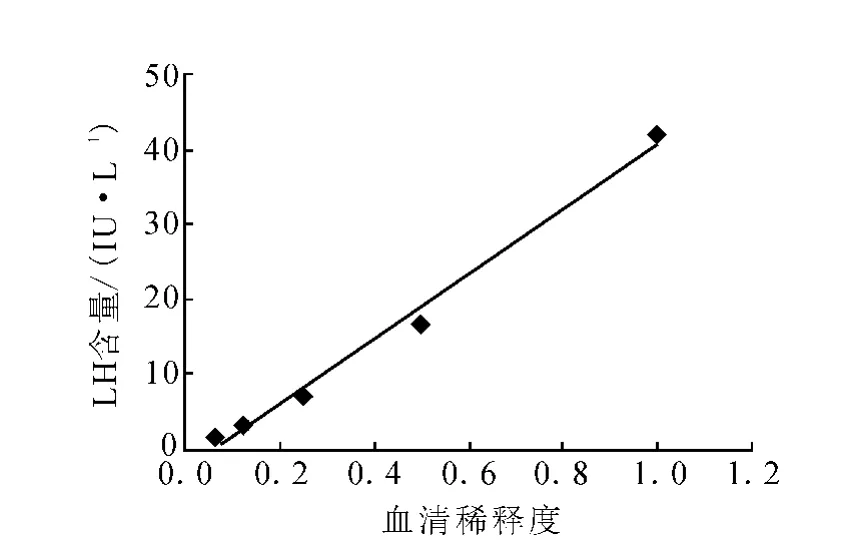
图4 L H酶促化学发光分析方法健全性实验

表4 回收率实验测定结果

表5 交叉反应实验结果
3.2.6 弯钩效应 配制一系列高浓度L H样品,按照分析程序进行测定,结果示于图5。由图5可知,当血清样品L H浓度达7 000 IU/L时,仍未出现弯钩效应,但在900 IU/L处出现拐点。
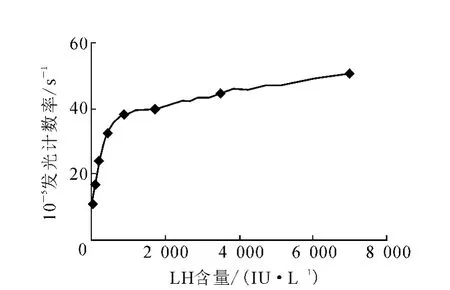
图5 弯钩效应实验
3.3 方法学比较
用本方法与Beckman公司的全自动化学发光系统共同检测56份血清样本的L H含量,结果示于图6。由图6可知,两种方法检测数据显著相关,相关方程为 y=0.967x+0.068 9,相关系数 r=0.975。

图6 与Beckman公司方法测定结果的相关性
3.4 主要组分的稳定性
3.4.1 包被板稳定性 包被一批5 mg/L的L H5304化学发光板,封闭后分为6份,抽真空,分别于37℃温箱放置0~15 d,检测发光计数率,考察其稳定性,结果示于图7。由图7可以看出,包被板在37℃下放置15 d,基本稳定。
3.4.2 酶标记抗体稳定性 将酶标记的L H5301抗体稀释为1∶10 000,分装为6份,置37℃温箱0~15 d,考察其稳定性,结果示于图8。由图8可以看出,酶标记抗体37℃下放置10 d基本稳定,10 d后发光计数率有所下降,但不同时间标准曲线线性及信噪比均符合免疫分析基本要求,37℃下放置15 d后,线性拟合相关系数为0.997,信噪比为8.78。
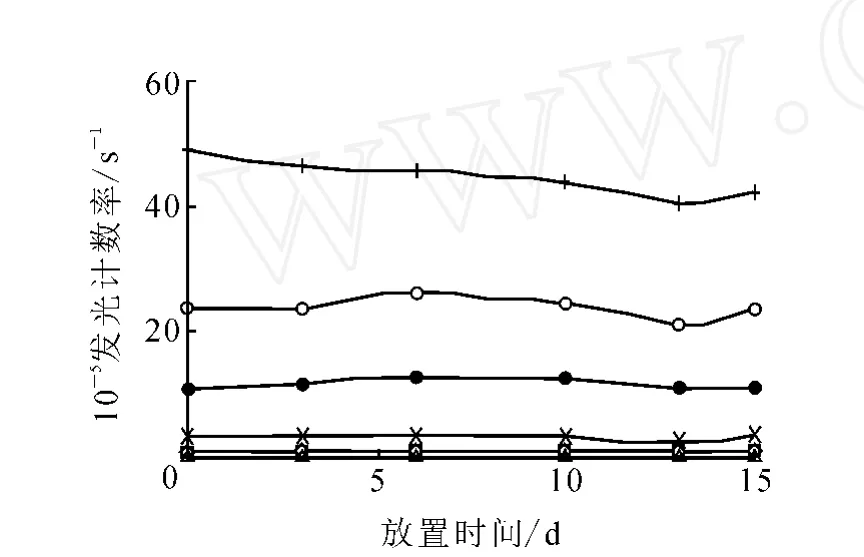
图7 L H包被板稳定性实验◇——0; □——1.5 IU/L; △——5 IU/L; ×——15 IU/L;●——45 IU/L; ○——100 IU/L;+ ——200 IU/L
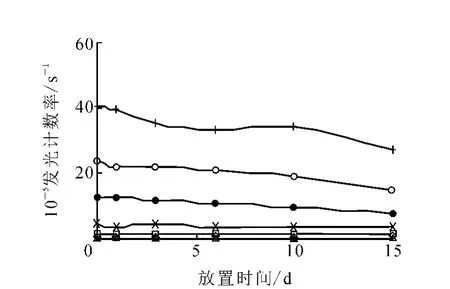
图8 L H酶标记抗体稳定性实验◇——0; □——1.5 IU/L; △——5 IU/L; ×——15 IU/L;●——45 IU/L; ○——100 IU/L;+ ——200 IU/L
3.4.3 标准品稳定性 将标准品冻干粉在37℃下放置0~15 d,分别加0.5 mL蒸馏水溶解,做标准曲线,根据线性拟合方程计算各标准点值,结果示于图9。由图9可知,高浓度标准品3 d后浓度有所下降,其余各标准品37℃下放置15 d基本稳定。
3.4.4 试剂盒整体稳定性 将冻干标准品、1∶10 000酶标记抗体、5 mg/L包被板、发光液A、B分别于37℃下放置0~15 d,观察试剂盒整体稳定性,结果示于图10。由图10可知,37℃下放置15 d时发光计数率有所下降,曲线线性拟合相关系数为0.993,信噪比为9.62。符合免疫分析方法的要求。

图9 L H标准品稳定性实验◇——0; □——1.5 IU/L; △——5 IU/L; ×——15 IU/L;●——45 IU/L; ○——100 IU/L;+ ——200 IU/L
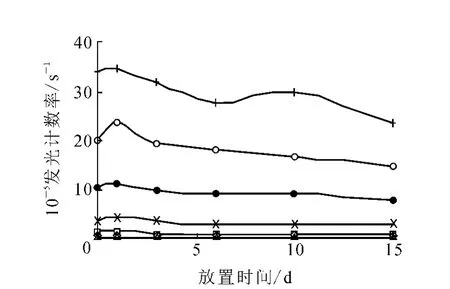
图10 L H酶促化学发光试剂盒整体稳定性实验◇——0; □——1.5 IU/L; △——5 IU/L; ×——15 IU/L;●——45 IU/L; ○——100 IU/L;+ ——200 IU/L
4 小 结
本实验建立的L H酶促化学发光免疫分析方法,灵敏度高、精密度好、检测范围宽,虽然与高浓度 HCG存在一定交叉反应,但对检测结果无明显影响,检测值与国外同类试剂盒比较呈正相关,各组分比较稳定,符合免疫分析基本要求。在今后的研究中,可以通过多次细胞融合,制备出与HCG交叉反应率小的抗L H单克隆抗体,进一步完善本免疫分析方法。
[1] Pierce JG,Faith MR,Giudice LC.Structure and structure-f unction relationships in glycoprotein hormones[J]. Ciba Found Symp,1976,41:225-250.
[2] Puett D,Li Y,Angelova K,et al.Structure-f unction relationship of the luteinizing hormone receptor[J].Ann N Y Acad Sci,2005,1 061:41-54.
[3] Palermo R.Differential actions of FSH and L H during folliculogenesis[J].Reprod Biomed Online,2007,15(3):326-337.
[4] 杨献福,和钰.促黄体生成素及其检测与免疫[J].中国畜牧兽医,2007,34(12):147-149.
[5] 郭春祥,郭锡琼.介绍一种简单、快速的辣根过氧化物酶标记物酶标记抗体的过碘酸钠法[J].免疫学杂志,1983,33:97-100.
[6] 尹东光,贺佑丰,刘一兵,等.标记免疫分析技术的发展点评[J].标记免疫分析与临床,2003,10(1):40-41.
[7] 梁淑芳,陈曼玲.L H/CG受体基因克隆与表达的研究进展[J].生物技术通讯,2002,13(1):92-97.
[8] Gadkari RA,Rov S,Rekha N,et al.Identification of a heterodimer-specific epitope present in human chorionic gonadotrophin(hCG)using a monoclonal antibody that can distinguish between hCGand human L H[J].J Mol Endocrinol,2005,34(3):879-887.
