整合素αvβ3对喉鳞癌细胞增殖和侵袭力影响的离体研究
2010-05-03许小涛陶泽璋
许小涛 陶泽璋
有研究表明,整合素αvβ3在多种恶性肿瘤的细胞增殖、新血管生成及侵袭转移等主要恶性生物学行为中起正性调节作用[1]。整合素αvβ3可广泛地表达于多种不同组织来源的恶性肿瘤细胞和血管内皮细胞的表面,有研究[2,3]提示其在喉鳞癌的发生发展、新血管形成和侵袭转移等过程中起促进作用,从而整合素αvβ3有可能成为喉鳞癌治疗的一个很有前途的靶点。为了探讨整合素αvβ3在喉鳞癌主要恶性生物学行为中的作用,我们研究观察整合素 αvβ3对体外培养HEP-2喉鳞癌细胞增殖和侵袭力的影响,为将整合素αvβ3作为喉鳞癌治疗靶点提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 人HEP-2喉鳞癌细胞株,由武汉大学医学院附属人民医院耳鼻喉科分子肿瘤实验室提供,小鼠成纤维细胞系(NIH3T3),由华中科技大学同济医学院免疫教研室提供。
1.1.2 主要试剂和药物 RPMI 1640培养基、小牛血清(bovine calf serum,BCS)为Hyclone公司产品,PS双抗(青霉素和链霉素)和胰蛋白酶购于武汉凌飞科技产品公司,MTT(噻唑蓝)为Amresco公司产品,二甲基亚枫(dimethyl sulfoxide,DMSO)兔抗鼠PCNA单抗为美国Dako公司产品,兔抗鼠整合素αvβ3单抗为Santa Crux公司产品,即用型SABC试剂盒、DAB显色试剂盒和黏片剂APES均购自武汉博士德公司。
1.1.3 主要仪器 酶联免疫检测仪为Bio-Tek公司产品(华中科技大学同济医学院同济医院骨科提供),CO2培养箱为 Heal Force Development Co.Ltd(Hong Kong)产品,HPIAS-1000型全自动医学彩色图像分析系统由华中科技大学同济医学院病理教研室提供,细胞培养池(Boyden小室)和Matrigel胶(人工基膜,含有IV型胶原和层黏连蛋白等成分)为Becton Dickison公司产品。
1.2 方法
1.2.1 HEP-2喉鳞癌细胞增殖抑制试验 采用MTT比色法。取对数生长期HEP-2细胞,接种于96孔细胞培养板,每孔100μl。培养24 h使细胞完全贴壁。实验组分三组,分别加入含整合素αvβ3抗体10μg/ml、25 μg/ml、50 μg/ml 3 种浓度的细胞培养液,对照组培养液除不含整合素αvβ3抗体外,其余条件完全一致。培养3 d后,每孔加入MTT(5g/L)工作液10 μl培养4 h。取出,镜检可观察到活细胞内有颗粒状蓝紫色结晶,每孔加入100μl DMSO。然后以570 nm为测试波长,20 min内在全自动酶标仪上读取各孔光吸收度(A值)。肿瘤细胞增殖抑制率的计算:增殖抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
1.2.2 HEP-2喉鳞癌细胞中PCNA的表达 采用免疫组化SABC法。取HEP-2细胞,作细胞爬片。实验组分两组,分别加入含整合素αvβ3抗体25μg/ml、50 μg/ml两种浓度细胞培养液200μl,每种浓度做8个复孔,对照组培养液除不含整合素 αvβ3抗体外,其余条件完全一致。多聚甲醛固定20 min,蒸馏水洗涤,室温干燥,-20℃保存,待测。PCNA免疫组化染色按照试剂盒说明进行操作。
1.2.3 趋化液的制备 收集培养的NIH3T3细胞即将长满培养瓶瓶底时的上清液即为趋化液。
1.2.4 Boyden 小室的制备[4]细胞培养池的多孔PET(Polyethylene Perephthalate)膜,将Matrigel基质凝胶稀释至300μg/mL,取100μL均匀涂抹一层于细胞培养池PET上表面。
1.2.5 细胞侵袭模型的建立 取对数生长期生长良好的HEP-2细胞消化后常规培养。将培养液更换为分别含有0 μg/ml、10 μg/ml、25 μg/ml和50 μg/ml整合素αvβ3抗体的细胞培养液。分别取含不同浓度整合素αvβ3抗体培养液的HEP-2喉鳞癌细胞,制成细胞悬液。取细胞悬液250μl,加入铺好基质凝胶的细胞培养池中(Boyden小室的上室),加入上述NIH3T3的条件培养液200μl,每种浓度做10个复孔。使细胞穿透Matrigel胶和PET膜上的微孔,达到PET膜下。
1.2.6 细胞固定、染色和侵袭细胞数的计算 将Boyden小室取出,用甲醇固定30 min,未结合型苏木精染色10 min。在高倍镜下计数PET膜下面侵袭的细胞数,计数中间和四周5个视野,得平均值。
1.3 统计学分析
2 结果
2.1 整合素αvβ3抗体对HEP-2喉鳞癌细胞增殖的抑制作用(表1,图1)
10 μg/ml、25μg/ml和50 μg/ml 3种不同浓度的整合素αvβ3抗体作用HEP-2喉鳞癌细胞后,测得的A值分别为 0.1687 ±0.0403,0.1194 ±0.0512 和0.0823 ±0.0338,与对照组(A 值为0.2135 ±0.0325)比较,差异有显著性意义(P<0.01),测得的肿瘤细胞增殖抑制率分别(23.56 ±3.36)%,(45.21 ±5.32)%和(68.27±4.49)%,与对照组相比亦有显著性差异(P <0.01),提示整合素 αvβ3 抗体可以显著抑制HEP-2喉鳞癌细胞的生长,且增殖抑制率呈明显的量效关系,结果表明整合素αvβ3对HEP-2喉鳞癌细胞的增殖有促进作用。
表1 各组A值及增殖抑制率情况±s)
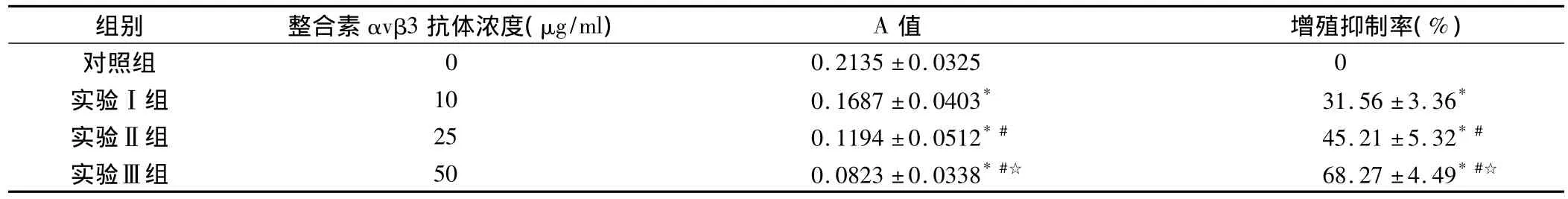
表1 各组A值及增殖抑制率情况±s)
注:*为与对照组比较,P<0.01;#为与实验Ⅰ组比较,P<0.05;☆为与实验Ⅱ组比较,P<0.05
组别 整合素αvβ3抗体浓度(μg/ml) A值 增殖抑制率(%)0.2135 ±0.0325 0实验Ⅰ组 10 0.1687 ±0.0403* 31.56 ±3.36*实验Ⅱ组 25 0.1194 ±0.0512*# 45.21 ±5.32*#实验Ⅲ组 50 0.0823±0.0338*#☆ 68.27±4.49*#☆对照组0
2.2 整合素αvβ3抗体对HEP-2喉鳞癌细胞PCNA表达的影响(图2)
PCNA染色主要在胞核,阳性细胞染色表现为胞核呈棕黄色圆形颗粒状。对照组HEP-2喉鳞癌细胞PCNA阳性染色明显,实验组HEP-2喉鳞癌细胞PCNA阳性染色则明显减弱。对照组PCNA表达的平均光密度值(average light density,ALD)为0.7223 ±0.0318,实验Ⅰ组(25μg/ml)和实验Ⅱ组(50μg/ml)HEP-2喉鳞癌细胞PCNA表达的ALD值分别为0.45092±0.0436和0.2967±0.0625,与对照组(0 μg/ml)比较差异显著(P<0.01),两实验组间比较差异亦有显著性意义(P<0.05),提示整合素αvβ3抗体对HEP-2喉鳞癌细胞的生长有抑制作用,剂量越大,抑制作用越强。

图1 不同浓度整合素αvβ3抗体对HEP-2喉鳞癌细胞A值及增殖抑制率的影响

图2 不同浓度整合素αvβ3抗体对HEP-2喉鳞癌细胞PCNA表达的影响
2.3 整合素αvβ3对HEP-2喉鳞癌细胞侵袭力的影响(表 2,图3)
不同浓度整合素αvβ3抗体处理的HEP-2喉鳞癌细胞,穿透细胞培养池PET膜的细胞计数见表2,结果表明整合素αvβ3抗体对HEP-2喉鳞癌细胞的侵袭能力有明显抑制作用,且呈明显量效关系。本实验结果间接说明整合素αvβ3对喉鳞癌细胞的侵袭能力有促进作用。
表2 不同浓度整合素αvβ3抗体对HEP-2喉鳞癌细胞侵袭力的影响(±s)

表2 不同浓度整合素αvβ3抗体对HEP-2喉鳞癌细胞侵袭力的影响(±s)
注:*为与对照组比较,P<0.01;#为与实验Ⅰ组比较,P<0.05;☆为与实验Ⅱ组比较,P<0.05
41.36 ±5.87实验Ⅰ组 10 32.53 ±3.89*实验Ⅱ组 25 18.82 ±4.02*#实验Ⅲ组 50 13.71 ±2.94*#☆对照组0

图3 不同浓度整合素αvβ3抗体对HEP-2喉鳞癌细胞侵袭力的影响
3 讨论
喉鳞癌是头颈部最常见的恶性肿瘤之一,肿瘤细胞无限制的恶性增殖、大量的新血管生成和向周围侵袭性生长及淋巴结转移是其主要的恶性生物学行为。尽管目前对其外科手术、化疗、放疗和生物治疗等相结合的综合治疗,但总观其远期疗效,仍不理想[5]。侵袭性生长及转移是导致喉鳞癌疗效不佳的主要原因。恶性肿瘤细胞的侵袭转移与细胞增殖和新血管形成在肿瘤的发生发展过程中往往密不可分,且其与新血管生成具有共同的生物学调节机制,都依赖整合素、生长因子、细胞受体和细胞外基质的协同作用[6]。整合素αvβ3是整合素分子家族中重要的一员,可广泛地表达于多种不同组织来源的恶性肿瘤细胞和血管内皮细胞的表面,研究发现整合素αvβ3且其表达水平与喉鳞癌的病理分级和组织学类型密切相关;整合素αvβ3极可能对喉鳞癌的主要恶性生物学行为有促进作用。体外的实验研究发现,整合素αvβ3在喉鳞癌细胞和血管内皮细胞的增殖和侵袭过程中起重要促进作用。更多的体外实验证实,整合素αvβ3对癌细胞和血管内皮细胞的黏附、迁移和增殖能力有明显的促进作用[7,8]。
PCNA是仅在增殖细胞中合成与表达的DNA聚合酶的1种辅助蛋白,只有处于增殖周期增殖状态的细胞才能检测到PCNA的存在。PCNA表达水平的检测是评价细胞增殖状态的1种常用方法。Boyden小室法是一种目前国际上应用较为广泛的体外快速细胞侵袭性模型。肿瘤细胞侵袭或转移过程中的关键步骤是穿过基膜,Boyden小室的原理就是通过在体外构建人工基膜结构,观察上室细胞穿透人工基膜到达下室的侵袭能力来检测肿瘤的侵袭性。
我们发现,10 μg/ml、25 μg/ml和50 μg/ml3种不同浓度的整合素 αvβ3抗体作用HEP-2喉鳞癌细胞72 h后,测得的肿瘤细胞增殖抑制率分别为(23.56±3.36)%、(45.21 ±5.32)% 和(68.27 ±4.49)%,还发现整合素 αvβ3抗体能够降低HEP-2细胞PCNA的表达水平,增殖抑制率和PCNA的表达水平均与整合素αvβ3抗体剂量呈明显的量效关系,提示整合素αvβ3抗体对HEP-2喉鳞癌细胞的增殖有明显抑制作用。在本研究Boyden体外细胞侵袭性模型中,我们发现,整合素αvβ3抗体对HEP-2喉鳞癌细胞穿透细胞培养池多孔PET膜的能力有明显抑制作用,并且它的这种作用呈剂量依赖性。本实验结果间接证实整合素αvβ3对喉鳞癌细胞的恶性增殖和侵袭性生长能力有正性调节作用。
整合素αvβ3促进喉鳞癌细胞恶性增殖和侵袭性生长的具体作用机制很复杂,可能与其介导多种生长因子的激活及其与它们的受体相互作用有密切关系,还可能与其参与细胞因子或肿瘤诱导的新血管形成过程并直接影响到血管形成、生长和成熟有关[2,9]。肿瘤的侵袭转移离不开肿瘤细胞的恶性增殖和新血管生成,故整合素αvβ3通过上调细胞增殖和新血管生成促进喉鳞癌细胞的侵袭性生长。研究发现,细胞外基质和基质金属蛋白酶在肿瘤的侵袭转移过程中起关键作用,而作为细胞膜黏附受体的整合素αvβ3能与基质金属蛋白酶和细胞外基质相互作用,从而促进多种恶性肿瘤细胞的侵袭和转移[10]。这也可能是整合素αvβ3促进喉鳞癌细胞侵袭性生长的重要机制之一。
总之,本部分体外研究证实了整合素αvβ3对喉鳞癌细胞恶性增殖和侵袭性生长有重要的促进作用。侵袭性生长更是导致喉鳞癌易复发和患者预后不佳的主要原因,但喉鳞癌的侵袭性生长离不开肿瘤细胞的恶性增殖和新血管生成,且三者之间存在许多共同的生物学调节机制。结合本实验结果,我们更有理由认为将整合素αvβ3作靶点治疗喉鳞癌有充分的理论和实验依据,有必要作更深入的研究和探索。
[1] Bondza PK,Metz CN,Akoum A.Macrophage migration inhibitory factor up-regulates alpha(v)beta(3)integrin and vascular endothelial growth factor expression in endometrial adenocarcinoma cell line Ishikawa〔J〕.JReprod Immunol,2008,77(2):142.
[2] Beer AJ,Grosu AL,Carlsen J,et al.[18F]galacto-RGD positron emission tomography for imaging ofalphavbeta3 expression on the neovasculature in patients with squamous cell carcinoma of the head and neck〔J〕.Clin Cancer Res,2007,13(22 Pt1):6610.
[3] Zoppi N,Ritelli M,Salvi A,et al.The FN13 peptide inhibits human tumor cells invasion through the modulation of alpha v beta 3 integrins organization and the inactivation of ILK pathway〔J〕.Biochim Biophys Acta,2007,1773(6):747.
[4] Soel SM,Choi OS,Bang MH,et al.Influence of conjugated linoleic acid isomers on themetastasis of colon cancer cells in vitro and in vivo〔J〕.J Nutr Biochem,2007,18(10):650.
[5] Carinci F,Arcelli D,Lo Muzio L,et al.Molecular classification of nodalmetastasis in primary larynx squamous cell carcinoma〔J〕.Transl Res,2007,150(4):233.
[6] Bandyopadhyay A,Wang L,Chin SH,et al.Inhibition of skeletalmetastasis by ectopic ERalpha expression in ERalphanegative human breast cancer cell lines〔J〕.Neoplasia,2007,9(2):113.
[7] Charalabopoulos K,Mittari E,Karakosta A,et al.Integrins adhesion molecules and some of their ligands in laryngeal cancer〔J〕.Exp Oncol,2005,27(2):86.
[8] Lu JG,Sun YN,Wang C,et al.Role of the alphav-integrin subunit in cell proliferation,apoptosis and tumor metastasis of laryngeal and hypopharyngeal squamous cell carcinomas:a clinical and in vitro investigation〔J〕.Eur Arch Otorhinolaryngol,2008,266(18):2546.
[9] Edwards S,Lalor PF,Tuncer C,et al.Vitronectin in human hepatic tumours contributes to the recruitment of lymphocytes in an alphavbeta3-independentmanner〔J〕.Br JCancer,2006,95(11):1545.
[10] Marelli MM,Moretti RM,Procacci P,et al.Insulin-like growth factor-I promotes migration in human androgen-independent prostate cancer cells via the alphavbeta3 integrin and PI3-K/Akt signaling〔J〕.Int J Oncol,2006,28(3):723.
