VEGF在大鼠脾内移植瘤模型中的表达及其与肿瘤血管形成、侵袭和转移的关系
2010-05-03陈学进刘合代
丁 罡 黄 骞 陈学进 刘合代
肿瘤的生长和转移很大程度上依赖肿瘤血管形成[1,2]。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)特异性地作用于血管内皮细胞上的硌氨酸受体,诱导血管内皮细胞分裂,增殖,向肿瘤细胞迁移,最后形成新生血管。大鼠脾内移植肝转移模型是肿瘤细胞转移实验研究理性的动物模型[3]。本实验通过该模型,观察在大鼠脾内移植瘤模型中VEGF表达与肿瘤血管形成、侵袭和转移的关系。
1 材料与方法
1.1 实验材料
Walker256癌肉瘤细胞株,由北京肿瘤研究所提供。Wistar雌性大鼠16只,体重(200±20)g,由上海斯莱克实验动物公司提供[许可证号:scxk(沪)2007-0005]。分笼饲养,室温 24℃ ~26℃,湿度 40% ~60%。
1.2 实验方法
Wistar大鼠Walker256癌肉瘤脾内移植后肝转移模型的建立[3]:抽取Wistar大鼠的Walker256腹水瘤,台盼蓝排除法计活细胞数。用PBS调整瘤细胞浓度为 5 ×107/ml。氯胺酮(30 mg/100g)0.4 ml/只腹腔注射麻醉大鼠。在大鼠的右侧腹部(脾区)消毒后,剪开约1 cm的小口,暴露脾脏并固定,用4号针头在脾的下极包膜下缓慢注入0.2 ml Walker256肉瘤细胞悬液。局部用凝血酶,明胶海绵压迫止血,然后逐层缝合腹肌、皮肤。
动物血清标本采集:在瘤株接种前后第2、14天,分别采取大鼠尾静脉血0.5 ml,2 000 rpn室温离心。取上清液200μl保存于-30℃。
肿瘤生长和转移分析:瘤株接种后第14天处死并解剖大鼠,观察肿瘤重量、肝内转移灶、腹腔转移灶和腹腔积液情况。
微血管密度计数[4]:选用兔抗大鼠FactorⅧ进行免疫组织化学染色。两位具有一定血管研究经验的人员观察,先在100倍光镜下寻找肿瘤中血管密度最高的5个区域,然后在200倍光镜下计算微血管密度(MVD)。5个区域的均值为该肿瘤的微血管密度。肿瘤组织中任何黄染的细胞或细胞群都计算为1个MVD,位于汇管区的血管不计算。
免疫组织化学判断标准[5],染色强度:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。阳性细胞数:无阳性细胞数为0分,阳性细胞数<10%为1分,11% ~50%为2分,51% ~74%为3分,≥75%为4分。两者乘积>3分为免疫反应(+)。按乘积分数:0分为(-),1~3分为(±),4~5分为(+),6~7分为(++),>7分为(+++)。
2 结果
2.1 大鼠脾内移植瘤模型血清VEGF表达与肿瘤血管形成的关系
大鼠脾内移植瘤模型血清VEGF表达与肿瘤组织微血管密度、肝转移显著相关,γ=0.92 P<0.05。肝转移大鼠肿瘤组织中的微血管密度大于肝转移阴性大鼠(86.82 ±11.39 vs 71.56 ±8.95,P <0.05)(图 1)。
2.2 VEGF在转移肿瘤中的表达
免疫组化结果显示,VEGF主要表达于肿瘤细胞胞质,染色阳性。发生肝转移的脾脏肿瘤细胞VEGF胞质染色较深。
2.3 大鼠移植瘤模型血清VEGF与肿瘤生长、转移的关系
大鼠移植瘤模型血清VEGF表达水平的变化见图2。大鼠移植瘤模型中血清VEGF表达与肝转移、腹腔播散和血性腹腔积液有关(表1)。
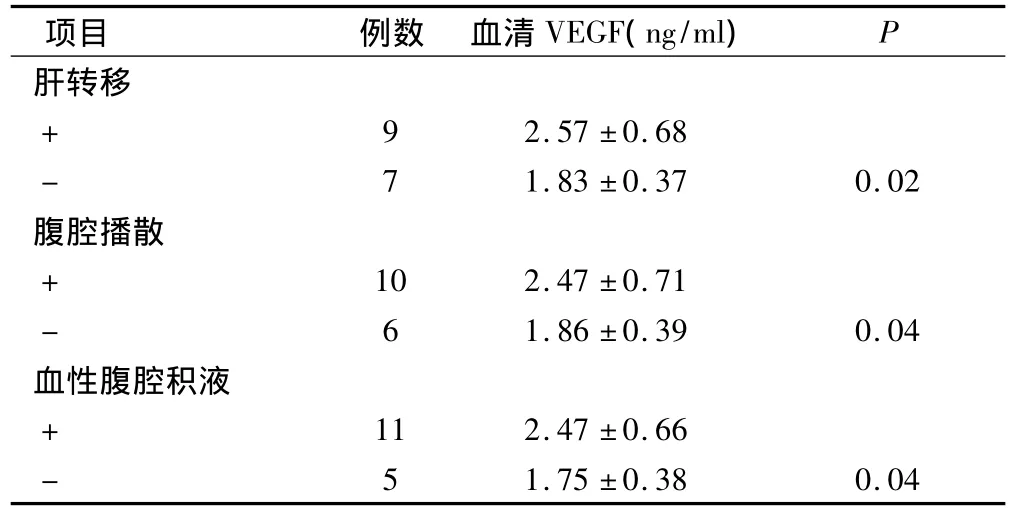
表1 大鼠肿瘤血清VEGF与肿瘤侵袭、转移的关系

图1 大鼠血清VEGF与肿瘤微血管密度、肝转移的关系

图2 大鼠移植瘤模型血清VEGF表达的变化
3 讨论
肿瘤细胞的生长和转移很大程度上依赖肿瘤血管形成。实体肿瘤生长到2~3 mm时,如果缺乏新生血管,肿瘤细胞即进入到休眠状态,如果血管形成,进入肿瘤组织后,肿瘤组织的血供即由弥散变成灌注。两天内,肿瘤细胞由静止状态开始加速生长,同时肿瘤周围环境继续血管化,血管形成,两周内肿瘤组织的体积可达原来19 000倍[6]。肿瘤血管为肿瘤细胞生长提供所需的营养,同时由于新生的肿瘤血管结构和功能异常,例如血管壁不完整,缺乏基膜等,使得肿瘤细胞能穿透管壁,进入血循环,发生远处转移。
近年来,实验中发现了许多肿瘤血管形成正负调节因子。其中血管内皮生长因子(vascular endothelial growth factor,VEGF)特异性地作用于血管内皮细胞上的硌氨酸受体,诱导血管内皮细胞分裂,增殖,向肿瘤细胞迁移,最后形成新生血管,使肿瘤病灶的氧供由弥散变为灌注,为肿瘤细胞的生长提供氧、营养、排泄、分解代谢产物[7]。通过增强血管通透性,使营养物质渗到肿瘤病灶和血浆蛋白(纤维蛋白)渗出血管腔,沉积于周围组织。有助于肿瘤血管形成和为肿瘤生长提供微环境[8]。血管形成为恶性肿瘤细胞进入血道发生远处转移创造条件。VEGF是已知作用最强、特异性最高的血管生长因子之一。
在实验大鼠移植瘤模型中随着大鼠血清VEGF浓度的升高,肿瘤组织中的微血管密度增大。并且肝转移大鼠MVD高于肝转移阴性大鼠。这与Takanamib报道的结果相似[9],表明VEGF在一定程度上调控肿瘤血管形成。有实验表明,肿瘤的血管形成及血管密度与肿瘤的转移密切相关,从而影响肿瘤的预后[10,11]。
本实验发现大鼠接种瘤细胞24小时血清VEGF浓度明显升高,在以后的两周内血清VEGF浓度保持相对稳定的高水平,这是因为大鼠接种1×107个瘤细胞后,生长超过2~3 mm,此时肿瘤细胞生长须肿瘤血管支持[12]。肿瘤细胞即高度表达VEGF,使大鼠血清VEGF浓度明显升高,诱导内皮细胞分裂、增殖、降解基膜、趋化、最终形成肿瘤血管。
实验动物大鼠移植瘤模型出现肝转移、血性腹腔积液、腹腔播散的血清VEGF浓度和免疫组化染色也明显高于非侵袭和转移的大鼠,这表明在肿瘤发展过程中,只有当肿瘤细胞向侵袭、转移方向发展时,释放大量的VEGF,诱导肿瘤血管形成,产生转移。同时,检测血清VEGF水平的变化在一定程度反映肿瘤侵袭、转移的倾向。
本实验结果表明,在大鼠脾内移植瘤肝转移模型中,肿瘤细胞表达VEGF在肿瘤血管形成、肿瘤细胞的侵袭和转移中起重要作用。检测血清VEGF的表达有助于预测肿瘤的侵袭和转移,肿瘤预后判断,为临床针对VEGF靶点的抗肿瘤转移治疗提供理论依据。
[1] Folkman J.Tumor angiogenesis:therapeutic implications〔J〕.New E JMed,1971,1285(21):1182.
[2] Folkman J.What is the evidence that tumors are angiogensis dependent?〔J〕.JNat Can Inst,1990,82(1):5.
[3] 韩 锐.抗癌药物研究与实验技术,pp375〔M〕.北京医科大学中国协和医科大学联合出版社,1997.
[4] Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma〔J〕.JNatl Cancer Inst,1992,84(24):1875.
[5] 许良中,杨文涛.免疫组织化学反应结果的判断标准〔J〕.中国癌症杂志,1996,6:229.
[6] Folkman J,Cole P,Zimmerman S.Tumor behavior in isolated perfused organs:In vitro growth andmetastasis of biopsy material in rabbit thyroid and canine intestinal segment〔J〕.Ann Surg,1966,164:491.
[7] Folkman J.Antiangiogenic therapy.Devita VT,Hellman S,Rosenberg SA,eds.Cancer,Principles & practice of oncology〔M〕.5thed.Philadelphia,JB Lippincott company,1997:3075.
[8] Senger DR,Perruzzi CA,Feder J,et al.A highly conserved vascular permerbility factor secreted by a vairiety of human and rodent tumor cell lines〔J〕.Cancer Res,1986,46:5629.
[9] Takanami I,Tanaka F,Hashizume T,et al.Vascular endothelial growth factor and its receptor correlate with angiogenesis and survival in pulmonary adenocarcinoma〔J〕.Anticancer,1997,17:2811.
[10] Guidi AJ,Fischer L,Harris J,et al.Microvessel density and distribution in ductal carcinoma in site of the breast〔J〕.J Natl Cancer Inst,1994,86:614.
[11] Weidner N,Semple JP,Welch WR,et al.Tumor angiogenesis and metastasis correlation in invasive breast carcinoma〔J〕.N Engl JMed,1991,324:1.
[12] Folkman J,Cole P,zimmerman S.Tumor behavior in isolated perfused organs:In vitro growth and metastasis of biopsy material in rabbit thyroid and canine intestinal segment〔J〕.Ann Surg,1966,164:491.
