药物警戒快讯
2010-04-17
药物警戒快讯
欧洲药品管理局重申甲流疫苗安全有效
2009年11月20日,欧洲药品管理局(EMEA)发布信息,称已对集中审批的甲型H1N1流感疫苗(商品名包括Celvapan、Focetria和Pandemrix)的更多数据进行了综合分析。管理局重申,在目前H1N1流感大流行的背景下,接种这些疫苗利大于弊。
Focetria和Pandemrix的数据表明,单剂接种这些疫苗,在某些年龄组中诱发的免疫应答,足以预防H1N1流感病毒感染。在18~60岁的成年人以及儿童和青少年(Focetria是≥9岁,Pandemrix是≥10岁)中,这两种疫苗都可以单剂接种。Pandemrix在老年人中也可以单剂接种。对于某些人群,如婴幼儿和免疫缺陷患者,接种建议仍然是接种两剂,确保他们的免疫系统在接种疫苗后能产生充分的免疫应答。未来几个月中将会得到更多的数据。Celvapan的数据仍在进行评估。
EMEA还得出结论,认为Focetria和Pandemrix可以与未加佐剂的季节性流感疫苗合用。
EMEA和各国药品管理部门都在密切监测甲流疫苗的安全性。随着疫苗接种在欧盟的大规模展开,迄今已有约500万人接种了疫苗。到目前为止,报告的不良反应主要是些轻微的症状,如发热、恶心、头痛、过敏反应和注射部位反应,均为这3个疫苗预期中的不良反应。以前曾接种过大流行流感疫苗的患者中,报告的格林巴利综合征和胎儿死亡的病例非常少。EMEA仍在收集所有相关信息,并对数据进行评价。但是,根据现有信息,没有证据说明格林巴利综合征和胎儿死亡与这些疫苗有关联。
(EMEA网站)
美国甲流疫苗不良事件监测周报
2009年12月11日,美国疾病控制预防中心(CDC)网站公布了新一期甲流疫苗不良事件监测情况周报。以下为本期周报的摘要。
截至2009年12月4日,近64 000 000剂甲流疫苗被用于在美国境内接种,但确切的接种数量不详。自接种计划开展以来,截至2009年12月4日,美国疫苗不良事件报告系统(VAERS)中收到了4 890份不良事件报告。大部分(94.3%)不良事件被认为是“非严重”的,如注射部位疼痛。在4 890份报告中,277份(5.7%)报告被认为是“严重的”报告。在277份严重报告中,19例死亡。这19例死亡病例正在由CDC、美国食品药品监督管理局等进行评估。初步分析结果未提示这些死亡病例与疫苗存在关联性。这些病例将在补充了相关信息(如尸检报告、医学文书)后被进一步评估。VAERS收到了13例格林巴利综合征的报告,正对这些事件进行评估。在美国,无论是否接种疫苗,每周也会预计有约80~160例格林巴利综合征出现。
VAERS的数据提示,2009年H1N1疫苗的总体报告率要高于季节性流感的报告率,尽管这可能代表两类疫苗安全性确实存在不同,但这些不同也可能是由于加强了VAERS报告和提高公众对2009 H1N1疫苗不良反应的报告意识后造成的。
(美国CDC网站)
瑞典甲流疫苗不良反应监测报告
2009年11月12日,瑞典药品管理局(MPA)发布了甲流疫苗不良反应阶段性监测报告。
截至2009年11月10日,瑞典已发出约210万剂甲流疫苗(商品名Pandemrix)。MPA总共收到来自医疗卫生人员的近600份不良反应报告和来自消费者的近900份报告。不良反应临床表现总体上与临床试验中所见到的情况相符。本期通报中,对过敏反应、神经系统反应和儿童不良反应做了专门论述。要强调的是:单凭一个报告很难得出结论说这个反应是不是疫苗引起的。虽然报告中描述的反应在时间上与接种疫苗关系密切,但也可能是患者所患疾病本身的表现,与接种疫苗无关。自从大规模接种甲流疫苗以来,MPA已多次发布Pandemrix不良反应的监测报告,重点总结未知的和可疑的严重不良反应,但所有报告都按常规进行了审阅和评价。
来自医疗卫生人员的报告
收到了来自医疗卫生人员的约600份报告。这些不良事件大多是预料之中的和已知反应,如注射部位和手臂酸痛、发红、疼痛,流感样症状,如发热、发抖、疲劳、头痛、身体疼痛和不适。某些疫苗接种地点发现这些预料之中的反应很常见。少数报告中,报告了恶心、呕吐、胃痛、腹泻、头晕、皮疹和失眠等症状,这些反应也是疫苗研究中已知的反应。另外还报告了很多过敏反应(如下所述)。
过敏反应
76例患者中,有137例次不良反应表现(截止到11月10日)提示可能是与接种疫苗有关的过敏反应(见表1)。其中几例重度过敏反应的患者原来就对花粉、草、药物、某些食物过敏。在多数严重不良反应病例中,患者需要用抗组胺药、肾上腺素和可的松治疗和留院观察。所有病例的过敏反应都完全消退。
报告了2例过敏性休克。其中1例患者有鸡蛋过敏史;另1例患者对多种食物过敏,包括坚果,但对鸡蛋不过敏。
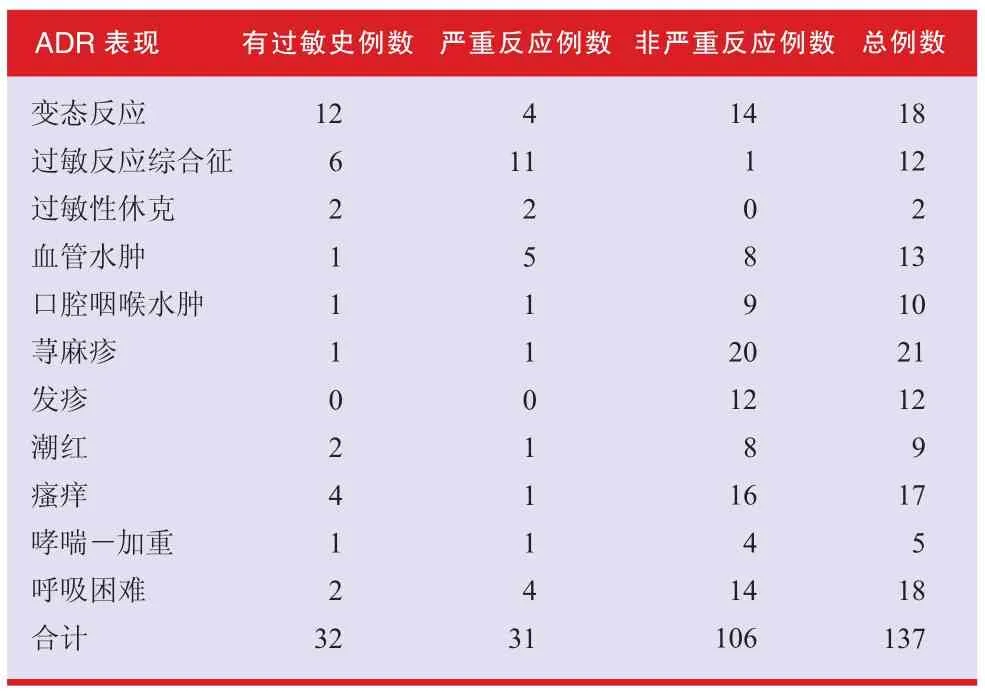
表1 过敏反应
神经系统反应
133例患者中共报告了177例次神经系统不良反应。这些反应中许多可能是过敏反应综合征(anaphylaxis)的表现(如头晕、头痛)。32例报告低血压/晕厥,有时伴有其他神经症状,如头晕、味觉或视觉障碍或失神发作。有44例感觉异常的报告,表现轻微的是接种手臂局部疼痛或麻木,有时扩展到面部,严重的表现为接种疫苗的半侧身体麻木。感觉异常一般在一天内消失,注射部位反应有几例持续了数天时间。
报告了4例面瘫或面瘫样症状,3女1男。其中1例是儿童,怀疑诱因为螺旋体感染(对螺旋体感染[莱姆病]进行治疗后症状改善)。1例是孕妇,症状轻微,几天内得到改善。另外2例,接种疫苗后面瘫伴有流感样症状,这两个人的症状分别在10小时和3天内消退。对这些报告仍在进行调查。
报告了2例脑卒中,其中1例死亡,分别在接种疫苗后3天和4天内。没有证据表明接种疫苗和死亡之间有因果联系。
面瘫是单侧面部肌肉无力/麻痹。面瘫可由面神经受损或脑损伤所致。外周性面瘫,贝尔麻痹(Bell’s palsy)的原因多数情况下不明,但可能由某些感染所致,如螺旋体感染、水痘-带状疱疹病毒或单纯疱疹病毒。在孕妇中也比较常见。多数情况下可在几个月内缓解,无后遗症。在瑞典,每周有50人被诊断为面瘫。到目前为止,估计近1/4人口已接种疫苗,因此报告的病例数在预期的范围内。
在儿童中的不良反应
截至2009年11月5日,约5 000名3岁以下儿童接种了疫苗,近5万名3~6岁的儿童也接种了疫苗。来自医疗卫生人员的500份报告中,31份报告是2000年或以后出生的儿童,只有5份报告涉及3岁以下的儿童。不良反应发生情况与以前看到的在年龄较大儿童中报告的情况没有差别(见表2)。
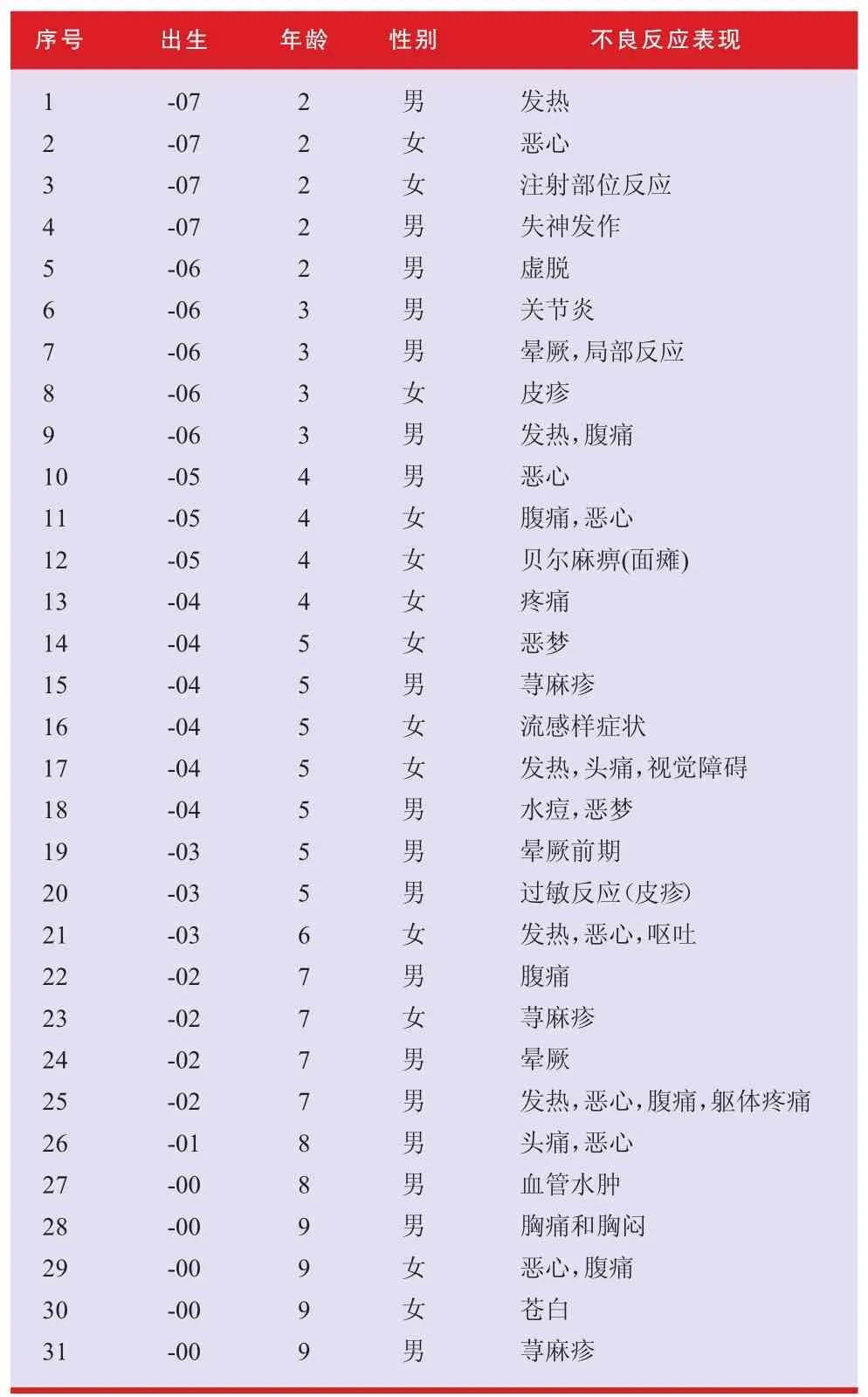
表2 来自医疗卫生人员的儿童不良反应报告
根据收到的过敏反应报告,对鸡蛋过敏、有其他严重过敏反应或近亲中有严重过敏反应的儿童,只有在咨询专家后才能接种疫苗。
死亡病例报告
累计共收到8例死亡报告,这8例报告在时间上都与接种疫苗有关联。接种疫苗距离死亡的时间从12小时到4~5天不等。这8例患者以前都有慢性疾病,如心血管病、肺病、糖尿病、肾衰、肌营养不良疾病和老年性痴呆。所有患者都在长期使用药物治疗。4例有尸检结果,认为接种疫苗和死亡之间没有因果关系。其他病例数据不足,缺少尸检报告,无法判断因果关系。对这些报告的调查仍在继续,但从迄今已获得的信息看,没有证据表明接种疫苗和死亡事件间有因果关系。
在评价死亡报告时,一定要考虑到瑞典平均每天有200 ~250人死亡,目前,全国人口中有很大比例都在接种疫苗,特别是老年人和其他高危人群。每天瑞典死亡的人中,多数是有慢性病合并症的老年人。
来自消费者的报告
自2009年10月12日大规模接种疫苗以来,MPA收到了近900份来自消费者的报告。这些报告中,绝大部分(约占报告数的90%)是非严重的、预料之中的和已知的反应。严重报告中的不良反应与来自医疗卫生人员的报告中的反应相似。这些病例包括1例年轻男性的面瘫,几例重度流感样症状和过敏反应病例。另外,报告了1例死亡病例,时间上与接种疫苗有关联。因信息不全,无法对这例报告做出判断,已经要求提供补充数据。
(英国MHRA网站)
澳大利亚甲流疫苗不良反应监测报告
澳大利亚自2009年9月30日开始实施甲流疫苗(商品名Panvax)全国免疫接种计划。澳大利亚医疗产品局(TGA)一直在密切监测疫苗的各种不良反应。2009年11月20日,TGA发布了甲型H1N1流感疫苗不良反应监测报告。
截至2009年10月29日,澳大利亚已发出375万多剂甲流疫苗(商品名:Panvax),共收到654例接种疫苗后可疑不良反应报告。报告的不良反应绝大多数属于轻度、常见反应,如头痛、胃肠道不适、注射部位疼痛、肿胀或发红。这些反应多数为已知反应,已列入产品说明书中。TGA专家委员会的意见是:Panvax是预防甲流安全有效的疫苗。接种Panvax后报告的常见不良反应如表1所示。
变态反应:
截至2009年10月29日,TGA已收到6例过敏反应综合征(anaphylaxis)的报告。TGA及其药物不良反应咨询委员会已经全面调查了这些病例的详细情况。采用Brighton Collaboration标准判断过敏反应综合征[1],TGA根据专家委员会的建议得出以下结论:报告的病例中只有4例可能与疫苗有关。迄今,所有病例已得到治疗或已自行缓解。
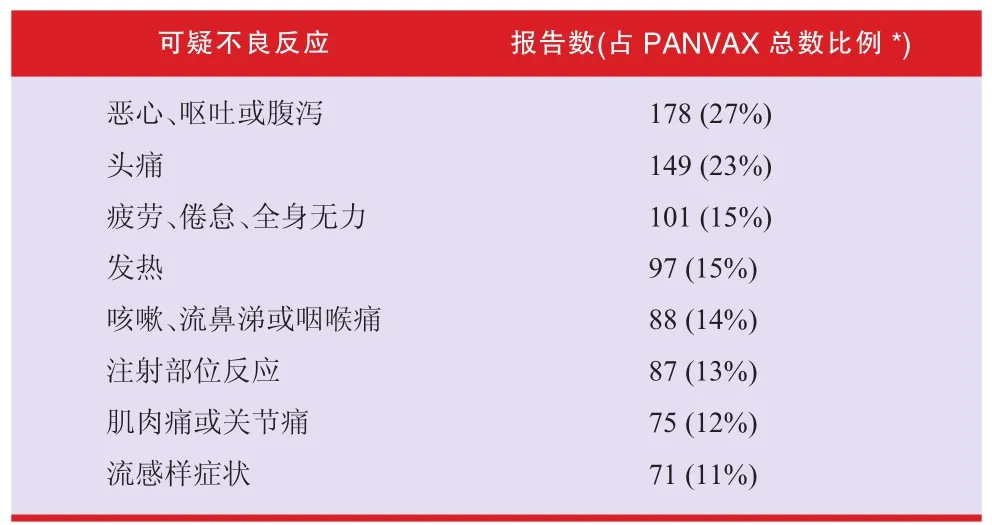
表1 接种Panvax后报告的常见不良反应
虽然不知道接种Panvax患者的精确数量,但根据Panvax的销量数据,目前所观察到的过敏性休克的发生率在预期的发生率范围内。
[1]Rü ggeberg JU,Gold MS,Bayas JM,et al.Anaphylaxis: Case definition and guidelines for data collection,analysis,and presentation of immunization safety data[J].Vaccine 2007,25 (31):5675-5684.
(TGA网站)
英国甲流疫苗不良反应分析报告
本报告总结了2009年10月15日至11月12日英国药品和健康产品管理局(MHRA)收到的甲流疫苗(Celvapan/Baxter公司和Pandemrix/GSK公司)在英国发生的可疑不良反应。这些报告都是医疗卫生人员和公众通过MHRA网站和黄卡主动报告的,其中还包括了两家疫苗生产企业按法规要求上报的病例报告。
摘要
·截至2009年11月12日,MHRA共收到497份甲流疫苗的可疑不良反应报告,不良反应表现1 329例次。
·Pandemrix的可疑不良反应报告占迄今收到的所有甲流疫苗报告的90%(n=449)。这种情况并不意外,因为这两种疫苗的使用存在很大差异。8.3%(n=41)的报告未明确疫苗的商品名。
·最常报告的可疑不良反应是非严重的注射部位反应(如疼痛、肿胀、发红),或类似其他疫苗的轻微不良反应,如恶心、呕吐、头晕、肌肉痛、发热、疲劳、头痛、淋巴结肿大。
·迄今收到的报告中未发现新的安全问题。
·接种Celvapan和Pandemrix仍然利大于弊。
1 不良反应报告总体情况
截止到2009年11月12日,英国共有497份甲流疫苗的可疑不良反应报告,不良反应表现1 329例次,如表1所示。其中,Pandemrix的报告占所有报告的90%(n=449),8.3%(n=41)的报告未说明疫苗品牌。
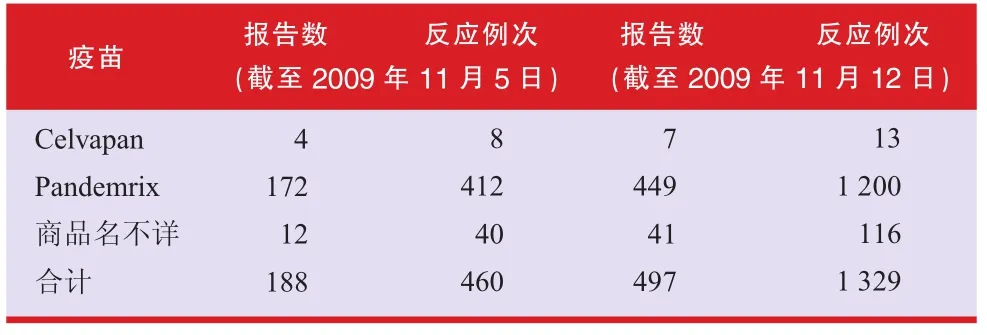
表1 英国收到的Celvapan和Pandemrix的可疑反应的报告数量
2 可疑不良反应报告分析
①Celvapan
截至2009年11月12日,共收到7份报告,不良反应表现13例次。神经系统异常均为非严重、已知的不良反应,包括头晕、感觉异常(针刺和针扎感)。有1例嘴唇肿胀的报告,为已知的、非严重过敏反应。迄今未收到Celvapan在孕妇中及15岁以下儿童中的不良反应报告。
②Pandemrix
Pandemrix的报告占迄今收到的报告总数的 90% (449/497)以上,很可能是因为这种疫苗在英国用量大的原因。最常见的反应是非严重的注射部位反应,包括疼痛、肿胀、麻木、感觉异常(针刺/针扎感)和瘀斑;还有许多其他疫苗都有的常见反应,如头晕、头痛、疲劳、流感样症状、肌肉痛、不适、轻度发热、淋巴结肿大,恶心和呕吐。
死亡病例:英国迄今有1例接种Pandemrix后的死亡报告。现有信息表明,严重的基础疾病更有可能是造成该患者死亡的原因。
神经系统异常:一般是非严重事件(头痛、头晕、倦怠和嗜睡),属于该疫苗已知的不良反应。感觉异常(针刺/针扎感)和感觉迟钝(麻木)的报告一般为一过性,局限于注射部位或接种疫苗的肢体。两例神经痛报告也是这样。1例三叉神经麻痹病例已被进行了全面评价,Pandemrix和神经炎之间可能无关。疫苗接种后不久出现的晕厥(昏厥)在任何疫苗接种时都不少见,这不是疫苗的不良反应,而是对注射的“心理反应”。对1例意识丧失报告正在随访,以确定是不是晕厥。眼睑下垂的1例报告伴有眼睑肿胀,因此很可能是过敏反应,而不是神经系统异常。报告了2例抽搐,均见于儿童。抽搐为Pandemrix说明书中已知、罕见的副作用。
建立建全体制机制是推动全行业创新创业教育改革的重中之重,完善课程体系建设、加强师资队伍建设、保障流畅的市场运营是完善机制正常运行的三大法宝,配合高效成果转化,加强校企合作,设立创新创业孵化基地,多方协同发力,为医学生想创业、能创业提供更好的平台和坚实的保障。
变态反应:迄今Pandemrix已有一定数量的变态反应报告。其中包括2例过敏反应、2例血管性水肿、5例面部肿胀、2例超敏反应、1例咽水肿。变态反应是疫苗已知的不良反应,其发生数量是不可预期是。
孕妇中报告的不良反应:收到了孕妇发生的9例可疑不良反应报告。接种疫苗时的妊娠期从5~7个月不等。不良反应都仅见于母亲,未见对出生的婴儿、妊娠过程及结果有什么影响。所有不良反应都是非严重、已知反应(注射部位反应和流感样症状)。
儿童中报告的不良反应:Pandemrix在16岁以下的儿童中有25份可疑不良反应报告,患者年龄从11个月到16岁。多数是非严重、已知不良反应,也可能是疫苗接种过程所引起的,而不是疫苗本身引起的。这些反应包括注射部位反应、流感样症状和心理反应。1例儿童出现反应性关节炎,另外2例出现惊厥发作。尚未确定这些事件是否与疫苗之间有因果关系。
③不明品牌甲流疫苗
共有41份报告,不良反应表现116例次。大多数可疑反应属于非严重事件,与接种其他疫苗后常见的症状相符(流感样症状、发热、注射部位疼痛、头痛、不适、痛苦、潮红或恶心)。
神经系统异常:迄今报告了1例四肢移动无力,已要求补充信息,初步判断是与接种疫苗后肢体移动困难有关,而不是麻痹的表现。
严重过敏反应或过敏性休克:报告了1例舌肿胀,1例过敏性休克。过敏性休克患者原有严重过敏反应的病史。
孕妇中报告的不良反应:没有收到孕妇的可疑不良反应报告。
3 结论
迄今收到的甲流疫苗最常报告的可疑不良反应是非严重、预料中的反应,如注射部位反应(局部疼痛、肿胀、发红或瘀斑等)和全身症状,包括恶心、呕吐、头晕、肌肉痛、发热、疲劳、头痛、淋巴结肿大。迄今为止英国的数据中未发现严重的安全问题,接种甲流疫苗仍然利大于弊。
(MHRA网站)
(来源:国家药品不良反应监测中心,国家食品药品监督管理局药品评价中心)
加拿大卫生部发布Ethicon公司的召回通告
信息发布日期:2009-11-23
召回发起日期:2009-10-26
召回公司:Ethicon Inc.
召回产品:A)PDS II可吸收缝合线
B)Vicryl可吸收缝合线
召回范围:型号为Z316H、J318H,批号为ACM008、ACM473的产品。
召回级别:II级
召回原因:部分PDS II可吸收缝合线的铝箔外包装上有一个微小的孔洞,这可能导致缝合线的降解,也可能会影响产品的无菌状态。
召回措施:联系制造商
(原文链接:http://www.hc-sc.gc.ca/dhp-mps/compli-conform/recall-retrait/_list/rec-ret_md-im_date_oct-dec_2009-eng. php)
加拿大卫生部发布通用(GE)公司的召回通告
信息发布日期:2009-11-23
召回发起日期:2009-10-30
召回公司:GE Medical Systems SCS
召回产品:Innova 2121IQ双平面心血管成像系统
召回范围:型号为S18821AM,序列号为S/N 553918BU4的产品。
召回级别:II级
召回原因:由于定位器侧平面和其他设备之间的碰撞,使得限位开关出现故障,这可能会破坏X射线和定位开关,从而导致整个检查过程无法完成。
参考文献:
