支气管哮喘大鼠淋巴液 CD4+CD25*+Treg及其Th1/Th2失衡的实验研究
2010-03-30赵志旭冯学斌李营营吴福玲
赵志旭 冯学斌 李营营 吴福玲 杨 成
1滨州医学院儿科学教研室 滨州市 256603;2滨州医学院附属医院儿科;3滨州医学院实验中心
支气管哮喘大鼠淋巴液 CD4+CD25*+Treg及其Th1/Th2失衡的实验研究
赵志旭1冯学斌1李营营2吴福玲2杨 成3
1滨州医学院儿科学教研室 滨州市 256603;2滨州医学院附属医院儿科;3滨州医学院实验中心
目的 观察 CD 4+CD 25+Foxp3+调节性 T细胞、IL-4和 IFN-γ在哮喘大鼠淋巴液与血液中的水平,探讨其与哮喘发病的关系。方法 建立大鼠哮喘模型,收集激发后 0、24、48 h淋巴液、血液中淋巴细胞,采用流式细胞术(FCM)检测淋巴液及血液中CD 4+CD 25+Foxp3+T细胞百分率;采用ELISA方法检测血浆及淋巴液中 IL-4和IFN-γ水平。结果 哮喘组淋巴液和血液的CD 4+CD 25+Foxp3+T细胞百分率水平、血浆 IL-4和 IFN-γ浓度在各时间点均低于对照组(P<0.05);哮喘组淋巴液中CD 4+CD 25+Foxp3+T细胞百分率水平、IL-4和IFN-γ浓度在不同时间点均高于血液水平(P<0.05)。结论 哮喘大鼠淋巴液中存在CD 4+CD 25+Foxp3+调节性 T细胞数量失调,且淋巴液中CD 4+CD 25+Foxp 3+调节性 T细胞水平显著高于其血液水平;哮喘大鼠淋巴液中存在以Th2亢进为特征的Th1/Th2失衡,淋巴液中细胞因子水平对于反映哮喘炎症程度可能更早和更准确。
哮喘;调节性 T细胞;白细胞介素 4;干扰素 γ
支气管哮喘(简称哮喘)是多种细胞和细胞组分共同参与的气道慢性炎症性疾病。业已证实哮喘存在严重的 T淋巴细胞亚群失衡现象和多种细胞因子的异常,诸多研究认为 Th1/Th2细胞亚群的失衡是哮喘发病的核心环节。近年认为 CD4+CD25+Foxp3+调节性 T细胞在哮喘的发病中具有重要作用[1]。目前关于哮喘淋巴液中 CD4+CD25+Foxp3+调节 T细胞、Th1/Th2亚群的变化及其规律尚不清楚。本研究通过建立哮喘大鼠淋巴液引流模型,观察 CD4+CD 25+Foxp3+调节 T细胞、IL-4、IFN-γ在淋巴液和血液中分布状态及其差异,探讨淋巴液中CD4+CD25+Foxp3+调节 T细胞、Th1/Th2失衡的特点及其在哮喘免疫学发病机制中的作用。
1 材料与方法
1.1 实验动物 清洁级 SD大鼠 60只(山东绿叶制药有限公司动物中心提供),雌雄各半,体质量 60~80 g,30日龄。随机分为对照组(30只)和哮喘组(30只)。
1.2 主要试剂和仪器 卵白蛋白(OVA,Grade V、GradeⅡ,Sigma公司);氢氧化铝(Aluminum hydroxide,分析纯,北京化学试剂公司);淋巴细胞分离液(中国科学院天津试剂制造厂);FITC标记的抗 CD4抗体,PE标记的抗 CD25抗体,PE-cy5标记的抗Foxp3(含配套的固定和透膜试剂,eBioscience公司 );IL-4、IFN-γ、IL-10 和 TGF-β ELISA试剂 盒(R&D公司);JSC-OK型单双通用水电分离式超声波雾化器(辽宁省鞍山市电子医疗仪器厂);流式细胞仪(美国贝克曼库尔特公司);酶标仪(美国 Thermo公司)。
1.3 方法
1.3.1 大鼠哮喘模型的建立:参照文献[2]的方法。实验组大鼠分别于实验第 1天、第 8天用新鲜配制的 OVA(GradeV)1 mg+氢氧化铝 200mg+生理盐水 1 ml混悬液在大鼠两侧腹股沟、腹部、前足跖 4个部位做皮下注射(每点 0.2ml),同时腹腔注射 0.2 ml。于第 15天,将大鼠置于 20 cm×20 cm×15 cm大小的密闭容器中,用 1%OVA进行雾化吸入激发,每次雾化 30min,连续 7 d。对照组大鼠以等量生理盐水代替卵白蛋白,同法、同量、同期进行致敏和激发。哮喘组、对照组大鼠分别于激发后 0、24、48 h收集取淋巴液和血液分离淋巴细胞进行检测。
1.3.2 大鼠淋巴液的采集:大鼠仰卧位,10%水合氯醛 3.0 ml/kg腹腔注射麻醉,常规消毒。于剑突耻骨联合连线上 2/3作腹部正中切口,将肠内容物移出腹腔,用温盐水纱布包裹。在右肾动脉水平,肠系膜上动脉处寻找肠系膜淋巴干。用留置针插入淋巴管,收集 0.5m l淋巴液。常规分离淋巴液中淋巴细胞,调整细胞浓度为 1×106/ml。
1.3.3 大鼠血液的采集:打开胸腔,心脏无菌穿刺采血 5m l,置于肝素离心管内,常规分离液分离淋巴细胞,调整细胞浓度为 1×106/ml。
1.3.4 淋巴液、血液中 CD4+CD25+Foxp3+T细胞百分率的流式细胞仪检测:取上述细胞悬液 100μl,加入 CD4-FITC和 CD25-PE,混匀 4°C避光孵育 30 min,用细胞染色缓冲液洗 1次,加入新鲜配置的 1 m l Fix/Perm工作液混匀,4°C避光孵育 45 min,1×Perm缓冲液洗 2次,加入 Foxp3-PEC-y5(同时设同型对照反应管),4°C避光孵育 30 min,1×Perm缓冲液洗 2次,用细胞染色缓冲液重悬细胞上机分析。以 FSC和 SSC设门圈定淋巴细胞,根据三种发射波长建立通道,实验数据采用 WinMDI 2.9软件分析。
1.3.5 淋巴液 、血浆中 IL-4、IFN-γ检测:采用ELISA方法,试剂盒由上海博蕴生物科技有限公司提供,R&D公司生产。操作方法见说明书。
1.3.6 肺组织标本留取及组织形态学观察:充分暴露胸腔,观察肺脏大体病理改变。左肺上叶注入4%多聚甲醛 5 ml,取下置于 4%多聚甲醛中固定 1周。取固定的肺组织常规石蜡包埋、切片,常规 HE染色,普通光学显微镜下观察肺脏组织形态结构。
2 结果
2.1 哮喘组大鼠临床症状及组织病理学观察 哮喘组大鼠在卵白蛋白激发过程中,表现出蜷伏不动,呼吸急促,口唇爪有不同程度紫绀,张口呼吸,大小便失禁,连续激发后毛色失去光泽,烦躁不安。刺激数天后部分大鼠症状逐渐加重。对照组大鼠无上述变化。光镜下哮喘肺组织支气管黏膜增厚,大量炎性细胞浸润,管腔狭窄,肺泡上皮细胞破坏;对照组大鼠支气管壁光滑、完整,支气管、血管周围未见炎性细胞浸润。哮喘组支气管肺泡灌洗液(BALF)中嗜酸性粒细胞百分率、血浆中 OVA特异性 IgE抗体均明显高于对照组(P<0.05),哮喘组血浆中 IL-4浓度较对照组显著升高,而 IFN-γ则显著降低,IL-4/IFN-γ比值增高。上述指标表明哮喘模型复制成功。
2.2 淋巴液和血液 CD4+CD25+Foxp3+T细胞百分率比较 哮喘组大鼠激发后 0、24、48 h各时间点的淋巴液与血液 CD4+CD25+Foxp3+T细胞百分率水平均低于对照组,哮喘组和对照组大鼠的淋巴液CD4+CD25+Foxp3+T细胞百分率平均水平均高于其血液水平,其淋巴液水平分别是血液的 1.49倍、1.62倍 (见表 1)。
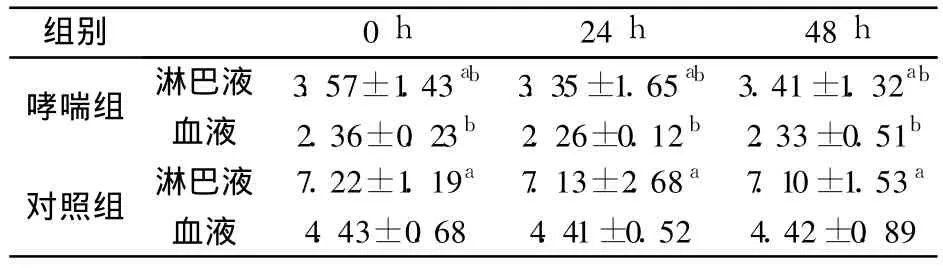
表1 淋巴液和血液中 CD4+CD25+Foxp3+T细胞百分率比较(%)
2.3 淋巴液和血浆 IL-4水平比较 哮喘组大鼠激发后 0、24、48 h各时间点的淋巴液及血浆 IL-4水平均较对照组显著升高,哮喘组、对照组大鼠的淋巴液IL-4平均水平均高于其血浆水平,其淋巴液水平分别是血浆的 1.8倍、2.3倍(见表 2)。
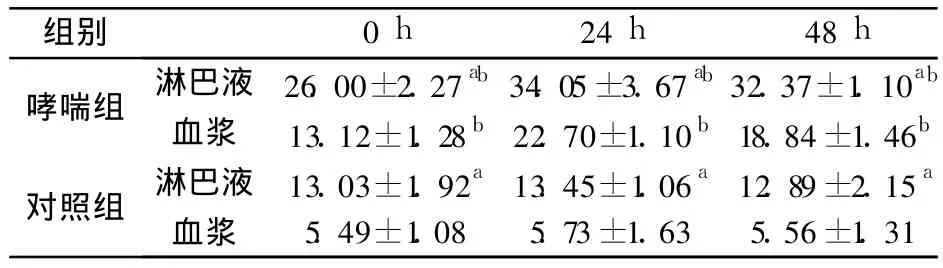
表2 淋巴液、血浆中 IL-4的水平比较(ng/L)
2.4 淋巴液和血浆 IFN-γ水平比较 哮喘组大鼠激发后 0、24、48 h各时间点的淋巴液及血浆 IFN-γ水平均较对照组显著降低,哮喘组、对照组大鼠的淋巴液 IFN-γ平均水平均高于血浆水平,其淋巴液水平分别是血浆的 3.0倍、2.1倍(见表 3)。
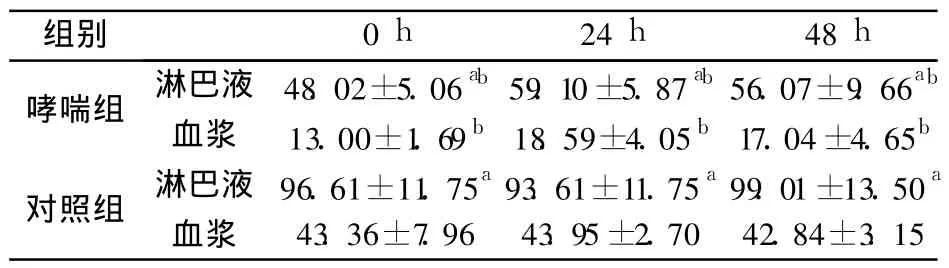
表3 淋巴液、血浆中 IFN-γ的水平比较(ng/L)
3 讨论
目前认为哮喘存在严重 T淋巴细胞亚群失衡现象和多种细胞因子的异常[3],其中 Th1/Th2失衡是哮喘发病的关键环节。诸多研究表明[4~6],哮喘患儿外周血、BALF中均能检测到 Th2类细胞因子的升高。近年发现 CD4+CD25+Foxp3+调节 T细胞在哮喘发病中发挥重要作用。已有研究证实,在体外用抗原刺激后,人类 CD4+CD25+Treg细胞可以抑制 CD4+T细胞增殖和 Th2型细胞因子的产生,提示 CD4+CD25+调节性 T细胞免疫功能可能是抑制Th2细胞对环境抗原的不适当应答。有研究报道哮喘患儿 BALF中 CD4+CD25+Treg比例较正常对照组显著降低[7],并且调节免疫功能下降[8]。而在气道内吸入 CD4+CD25+Treg可以抑制哮喘大鼠 T细胞的活化和气道高反应性[9],表明哮喘患者存在CD4+CD25+Treg细胞数量不足及功能降低。目前,关于哮喘 CD4+CD25+Treg研究仅限于血液及肺组织,而对于哮喘淋巴液中 CD4+CD25+Treg的数量及其功能方面研究尚未见报道。
淋巴系统是机体重要的免疫系统,淋巴液的循环对机体正常活动的维持和内环境稳定具有重要意义。淋巴细胞捕获抗原,产生效应性细胞,清除外来过敏原,并通过淋巴回流机制,进入血液系统,进一步消耗血液内抗原。我们课题组前期的研究已证实哮喘大鼠淋巴液中 IL-4、IFN-γ、IL-12水平均高于BALF和血浆,且出现高峰均早于 BALF和血浆[10];哮喘大鼠淋巴液中存在明显的淋巴细胞早期凋亡障碍和 Fas/FasL表达降低,尤其是哮喘淋巴液中淋巴细胞凋亡障碍和 Fas/FasL降低程度较其血液、BALF更为明显[11]。这些均提示哮喘发病时细胞因子及淋巴细胞凋亡等免疫功能紊乱可能最早源于淋巴系统。本文研究表明哮喘组大鼠各时间点淋巴液与血液 CD4+CD25+Foxp3+T细胞百分率水平均低于对照组。无论哮喘组还是对照组和治疗组,大鼠淋巴液中 CD4+CD25+Foxp3+T细胞百分率水平均高于其血液水平,表明哮喘大鼠淋巴液存在明显的CD4+CD25+Foxp3+调节性 T细胞数量的不足。
IL-4和 IFN-γ是 Th1、Th2产生重要免疫效应的细胞因子,在一定程度上反映 Th1、Th2细胞亚群的功能状态。IL-4是 CD4+和 CD8+T细胞转化为 Th2的关键细胞因子,能促进Th0细胞分化为 Th2细胞。采用敲除 IL-4基因的小鼠,T细胞及其亚群发育虽然正常,但不能诱导 Th2型细胞因子的产生,故 IL-4被认为是 Th2转化的必需因子[12]。而 IFN-γ可促使 Th0细胞向Th1方向分化,并抑制 Th2克隆分化,能够显著提高巨噬细胞的抗原呈递能力[13],并抑制IL-4mRNA的表达,同时还抑制 IL-4介导的 B细胞表达 FcεRⅡ和分泌 sFcεRⅡ,从而抑制了 IL-4诱导的 IgE的合成过程[14],而发挥抗炎作用。本研究表明哮喘大鼠淋巴液中 IL-4水平较对照组显著增高,而哮喘大鼠淋巴液中 IFN-γ水平明显低于对照组,提示哮喘大鼠淋巴液中存在以 IL-4增高为特征的Th2功能亢进和以 IFN-γ水平降低为标志的 Th1功能降低,同时由于 IFN-γ水平降低,导致 Th0向 Th1方向分化受阻,从而加剧了 Th2功能亢进状态。无论哮喘组还是对照组,大鼠淋巴液中 IL-4、IFN-γ水平均高于其血液水平。提示 Th1、Th2类细胞因子的失衡可能是促进哮喘炎症反应的重要因素之一。
本研究从淋巴液水平证实哮喘大鼠淋巴液存在CD4+CD25+Foxp3+调节性 T细胞数量的不足和严重的 Th1/Th2失衡状态,此可能是哮喘重要免疫学发病机制之一。由于淋巴液中 Th1、Th2类细胞因子水平显著高于其血浆水平,故推测淋巴液中细胞因子水平可能更早、更准确地反映机体哮喘炎症程度。因此,深入研究淋巴液中 T细胞亚群数量及其功能的失调,对于从调整 CD4+CD 25+Foxp3+调节性 T细胞功能入手,寻求哮喘防治新途径可能有重要的理论和实践价值。
[1] Stock P,DeKruyff RH,Umetsu DT.Inhibition of the allergic response by regulatory T cells[J].Curr Opin Allergy Clin Immunol,2006,6(1):12-16.
[2] 迟磊,符州,戴继宏,等.过敏性哮喘大鼠模型的建立[J].重庆医学,2003,32(4):429-431.
[3] Birebent B,Lorho R,Lechartier H,et al.Suppressive properties of human CD 4+CD 25+regulatory T cells are dependent on CTLT-4 expressive[J].Eur Immunol,2004,34:3485-3496.
[4] Pala P,Message SD,Johnston SL,et al.Increased aeroallergen-specific interleukin-4-producting T cells in asthmatic adults[J].Clin Exp Allergy,2002,32(12):1739-1744.
[5] Robinson DS,Hamid Q,Ying S,et al.Predominant TH2-like bronchoalveolar T-lymphocyte population in atopic asthma[J].N Engl J Med,1992,326(5):298-304.
[6] Lekie MJ,Ten Brinke A,Khan J,et al.Effects of an interleukin-5 bolckingmonoclonal antibody on eosinophils,airway hyper-responsiveness,and the late asthmatic response[J].Lancet,2000,356(9248):2144-2148.
[7] Hartl D,Koller B,Mehlhorn AT,et al.Quantitative and functional impairment of pulmonary CD 4+CD 25hi regulatory T cells in pediatric asthma[J].J Allergy Clin Immunol,2007,119(5):1258-1266.
[8] Lee JH,Yu HH,Wang LC,et al.The levels of CD4+CD 25+regulatory T cells in paediatric patients with allergic rhinitis and bronchial asthma[J].JClin Exp Immunol,2007,148(1):53-63.
[9] Strickland DH,Stumbles PA,Zosky GR,etal.Reversal of airway hyper responsiveness by induction of airwaymucosal CD 4+CD 25+regulatory T cells[J].JExp Med,2006,203(12):2649-2660.
[10] 李营营,冯学斌,吴福玲,等.支气管哮喘大鼠淋巴液 Th1/Th2类细胞因子分布特点及其与 BALF、血浆水平比较[J].中国免疫学杂志,2009,25(10):952-953.
[11] 刑朝品,冯学斌,宋晓冬,等.支气管哮喘大鼠淋巴液中淋巴细胞线粒体跨膜电位变化及地塞米松对其干预的影响[J].滨州医学院学报,2009,32(4):249-252.
[12] Takabayashi A,Ihara K,Sasaki Y,et al.Childhood atopicasthma:positive association with a polymorphism of IL-4 receptor alpha gene but not with that of IL-4 promotor of Fc epsilon receptorⅠbeta gene[J].Exp Clin Immunogenet,2000,17(2):63-70.
[13] Teixeira LK,Fonseca BP,Barboza BA,et al.The role of interferongamma on immune and allergic responses[J].Mem Inst Oswaldo Cruz,2005,100(s1):137-144.
[14] Deichmann KA,Heinzmann A,Forster J,et al.Linkage and allelic association of atopy and markers flanking the IL-4-receptor gene[J].Clin Exp Allergy,1998,28(2):151-155.
Study on CD 4+CD 25+Treg and the imbalance of Th1/Th2 cytokinesin lymph in bronchial asthmatic rat
ZHAO Zhixu1FENG Xuebin1LIYingying2WU Fuling2YANG Cheng3
1 Department of Pediatrics,Binzhou Medical University,Binzhou 256603;2Department of Pediatrics,Affiliated Hospital of Binzhou Medical University;3 Core Laboratory,Binzhou Medical University
ObjectiveTo observe the expression of CD 4+CD 25+Foxp3+Treg、IL-4 and IFN-γin lymph and blood,investigate the relationship between them.MethodsLymph and blood samples of 0 h,24 h,48 h after the last challenge were collected from the rat model of asthma.The percentage of CD 4+CD 25+Foxp3+Treg were detected by flowcy to meter(FCM),while the levels of IL-4 and IFN-γwere determined by ELISA.ResultsThe percentage of CD4+CD25+Foxp3+Treg in the blood and the levels of IL-4 and IFN-γin the plasma in cases of asthma group were significantly lower than that of the control at different time points(P<0.05);The percentage of CD 4+CD 25+Foxp3+Treg and the level of IL-4and IFN-γin lymph were significantly higher than thatof blood(P<0.05).ConclusionThere is a disbalance both quantity of CD4+CD25+Foxp3+Treg in the lym ph of bronchial asthmatic rat,and the percentage of CD 4+CD 25+Foxp3+Treg in lymph are significantly higher than that of blood.It is suggested that the Th1/Th2 unbalance which was impress of Th2hyperfunction were existed in lymph ofasthmatic rats.It could suppose that cytokines levels in lymph could reflex to the in flammation degree of asthmamuch early and accurately.
asthma,regulatory T cell,interleukin-4,interferon-γ
R562.2
A
1001-9510(2010)01-0001-04
项目:山东省教育厅科技计划项目(No.J07YE 14)
冯学斌,E-mail:fxbbzmc@163.com
2009-10-21)
