脑外伤后小鼠海马区notch信号的表达变化
2010-03-28潘长福阮琼芳沈晓黎娄远蕾匡助才赖贤良邓志锋
潘长福 ,阮琼芳 ,沈晓黎 ,涂 伟 ,娄远蕾 ,匡助才 ,赖贤良 ,汪 泱 ,邓志锋*
(1、南昌大学第二附属医院神经外科;2、南昌大学泌尿外科研究所;3、南昌大学研究生院医学部,江西 南昌 30006)
脑外伤是一种常见的致死、致残性疾病,随着现代交通工具的发展,其发病率呈现逐年上升的趋势。人类海马区神经元与学习记忆紧密相关,但该区神经元对脑外伤极为敏感,伤后神经元大量变性坏死,导致患者学习记忆功能障碍[1]。近年来研究发现,成年哺乳动物海马齿状回亚颗粒区(subgranular zone,SGZ)存在神经干细胞(neural stem cells,NSCs),这些细胞在脑外伤后被激活,增殖分化成功能上成熟的神经元,整合到神经网络中,一定程度上能促进患者神经功能的恢复[1]。但是脑外伤后NSCs增殖分化能力十分有限,远不能达到临床恢复的要求。因此,如何最大程度地提高神经干细胞增殖分化能力是治疗脑外伤的关键。近年来研究证实,notch信号表达在成体海马区神经干细胞中,在其增殖分化调控机制中起着极其重要的作用[2]。然而notch信号是否也调控脑外伤后神经干细胞增殖、分化过程,目前并不清楚。本研究拟通过自由落体法复制闭合性脑外伤小鼠模型,从基因水平上观察脑外伤后海马区notch信号的表达变化,初步探讨该信号与内源性神经干细胞增殖、分化的关系,为以后进一步深入研究notch信号调控成体神经再生机制提供理论基础。
材料与方法
1 实验动物分组及模型制备 Balb/c系雄性小鼠,体重23g左右,购自南昌大学医学院动物实验中心。随机分为假手术(sham)组、脑外伤4h、1d、3d模型组,每组分别3只动物。参考文献,采用改良的自由落体法复制闭合性脑外伤小鼠模型[3]。打击装置由脑立体定向仪、垂直导管、下落砝码、顶端涂有聚乙烯的撞针组成,撞针底端直径3mm(安徽淮北正华生物仪器设备有限公司提供)。异氟烷吸入麻醉小鼠后,将头部固定于脑立体定向仪上,消毒,沿中线切开头皮,暴露头盖骨,分离骨膜,将撞针置于前、后囟门中点偏左1mm。以40g砝码从25cm高处沿垂直导管自由下落,撞击撞针造成脑损伤,缝合头皮,给以充足水和食物喂养。假手术对照组仅切开头皮,暴露颅骨,不实施打击。伤后1h根据NSS评分系统(表1)评分[4],筛选7~8分重度脑外伤小鼠纳入实验研究对象。
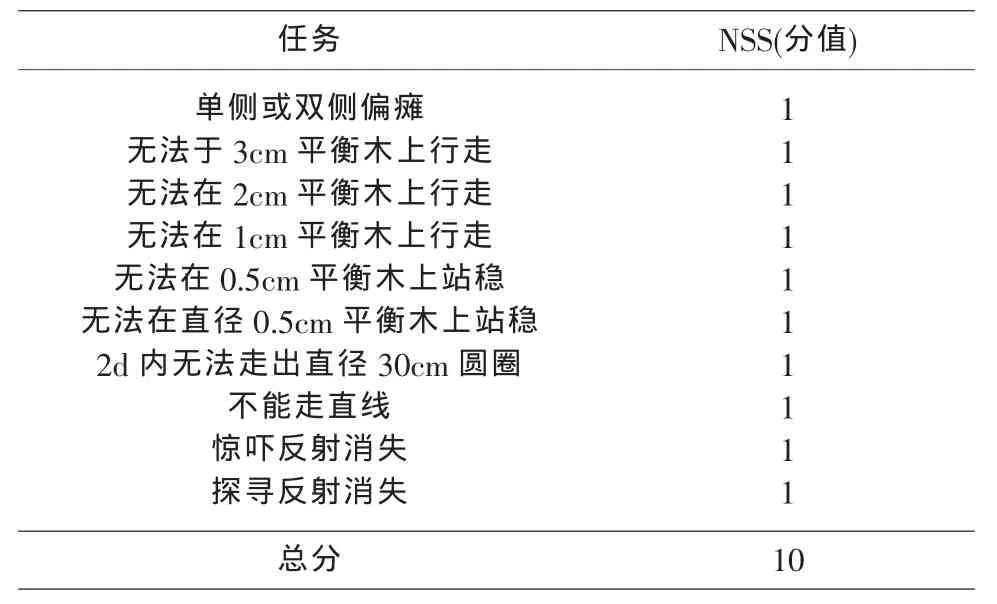
表1 小鼠脑损伤NSS评分系统
2 组织标本制备 脑外伤组分别在伤后4h、1d、3d处死动物,显微镜下迅速分离伤侧海马组织,-80℃保存,以备提取总RNA。
3总RNA抽提 收集组织标本,按Trizol试剂说明书提取总RNA。所提总RNA行紫外分光光度计检测A260/A280在1.8~2.0之间,并计算浓度,-80℃保存备用。
4实时定量RT-PCR (real-time PCR)检测notch1、hes1mRNA 表达 取 1μg总 RNA,使用 Fermentas逆转录试剂盒,随机引物逆转录合成cDNA。按以下体系进行Real-time PCR反应:cDNA模板1μl,2×PCR mix 10μl,2μmol/L 上下游引物各 1μl,0.5μL 10×SYBR GreenI,加无菌水至 20μl,不加模板为阴性对照。将反应管置于ABI 7500 real-time PCR system中进行扩增反应。反应条件如下:95℃,10min;95℃ ,15sec,60℃ 30sec 72℃ 30s for 40cycles;72℃10min。以GAPDH为内参,假手术组海马组织为对照组,用2-ΔΔCt值表示基因的相对表达量。Notch1 上 游 引 物 :5'-CCTTGGGTTCATGGATTAGTTTTG-3', 下 游 引 物 :5'-CTCAGTTGGATTTGGATGATGCT-3'。 Hes1 上 游 引 物 :5'-TACCCCAGCCAGTGTCAACAC-3', 下游引物:5'-TTTCCAGAATGTCTGCCTTCTCTA-3'。
5统计学处理 应用SPSS 17.0统计软件进行统计学分析。所得数据均以±s表示,进行单因素方差分析。P<0.05为有统计学意义。
结 果
脑外伤后伤侧海马notch1和hes1 mRNA的表达变化
Real-time PCR结果显示,脑外伤后notch1基因在伤后4h即开始升高,1d时达到高峰,较对照组升高约6倍,3d时有所回落,但仍维持在高水平,较对照组升高2倍;而hes1基因在伤后4h表达无明显变化,1d时明显升高,较对照组升高3倍,3d时则回落到正常水平,如图1所示。

图1 脑外伤后motch1、hes1 mRNA的表达
讨 论
人类海马区神经元与学习记忆紧密相关,但该区神经元对脑外伤极为敏感,伤后大量神经元变性坏死,导致患者学习记忆功能障碍,可作为评价脑损伤严重程度的重要指标之一[1]。目前研究证实,成体哺乳动物海马齿状回亚颗粒区存在内源性神经干细胞,后者是一类能自我更新,具有分化成神经元、神经胶质细胞和少突胶质细胞能力的细胞群。这些细胞在脑外伤后被激活,增殖分化成功能上成熟的神经元,并整合到海马回路中,促进患者学习记忆功能改善[1]。
Notch信号通路为调控细胞命运的基本通路[5]。在脑的发育过程中,notch信号在神经干细胞增殖、分化过程中起着极为关键的作用[6,7]。激活notch信号,可维持神经干细胞的未分化状态[7,8],促进其自我增殖[9]。最近研究表明,notch信号也在成年哺乳动物海马区和室下区表达,在成体神经再生过程中发挥着类似的调控作用[2]。Notch1为一种跨膜受体,当其与邻近细胞上的配体结合时,notch信号被激活,在γ-分泌酶的作用下,notch1释放出notch胞内区域段(Notch intracellular domain,NICD),后者转移至胞核内,与DNA结合蛋白RBP-J/CSL结合,激活下游转录抑制因子hes1,从而发挥notch1介导的调控作用[10]。
本研究结果发现,脑外伤后海马区notch1 mRNA在伤后早期即开始升高,3d时仍维持在较高水平,hes1mRNA也在伤后早期升高1d,提示脑外伤可激活notch信号。而Sun、Urrea等[11-12]研究表明,脑外伤后海马齿状回内神经干细胞增殖在伤后早期即开始增殖,于2~3d时达到高峰,与伤后notch信号表达呈现时间上相一致的表达趋势。由此可以推测,脑外伤后notch信号表达水平的升高可能与神经干细胞增殖分化相关。因此进一步全面深入研究notch信号调控脑外伤后成体神经干细胞增殖、分化机制,可为将来临床治疗提供新的可能靶点,具有十分重要的意义。
[1]Sun D,McGinn MJ,Zhou Z,et,al.Anatomical integration of newly generated dentate granule neurons following traumatic brain injury in adult rats and its association to cognitive recovery[J].Exp Neurol,2007,204(1):264-272.
[2]Oya S,Yoshikawa G,Takai K,et,al.Attenuation of Notch signaling promotes the differentiation of neural progenitors into neurons in the hippocampal CA1 region after ischemic injury[J]. Neuroscience,2009,158(2):683-692.
[3]Chen Y,Constantini S,Trembovler V,et,al.An experimentalmodel of closed head injury in mice:pathophysiology,histopathology,and cognitive deficits[J].JNeurotrauma,1996,13(10):557-568.
[4]Beni-Adani L,Gozes I,Cohen Y,et,al.A peptide derived from activity-dependent neuroprotective protein(ADNP)ameliorates injury response in closed head injury in mice[J].JPharmacol Exp Ther.2001,296(1):57-63.
[5]Artavanis-Tsakonas S,Rand MD,Lake RJ.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[6]de la Pompa JL,Wakeham A,Correia KM,et,al.Conservation of the Notch signaling pathway in mammalian neurogenesis[J].Development,1997,124(6):1139-1148.
[7]Hitoshi S,Alexson T,Tropepe V,et,al.Notch pathway molecules are essential for themaintenance,but not the generation,ofmammalian neural stem cells[J].Genes Dev,2002,16(7):846-858.
[8]Nyfeler Y,Kirch RD,Mantei N,et,al.Jagged1 signals in the postnatal subventricular zone are required for neural stem cell self-renewal[J].EMBO J,2005,24(19):3504-3515.
[9]Yoon K,Nery S,Rutlin ML,et,al.Fibroblast growth factor receptor signaling promotes radial glial identity and interacts with Notch1 signaling in telencephalic progenitors[J].J Neurosci,2004,24(43):9497-9506.
[10]Ohtsuka T,Ishibashi M,Gradwohl G,et,al.Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation[J].EMBO J,1999,18(8):2196-2207.
[11]Sun D,Colello RJ,Daugherty WP,et,al.Cell proliferation and neuronal differentiation in the dentate gyrus in juvenile and adult rats following traumatic brain injury[J].JNeurotrauma,2005,22(1):95-105.
[12]Urrea C,Castellanos DA,Sagen J,et,al.Widespread cellular proliferation and focal neurogenesis after traumatic brain injury in the rat[J].Restor Neurol Neurosci,2007,25(1):65-76.
