生物增强活性炭工艺中优势菌群生物活性强化
2010-03-24郜玉楠李伟光王广智张多英
郜玉楠,李伟光-3,王广智,张多英,刘 水
(1.哈尔滨工业大学市政环境工程学院,哈尔滨150090,gaoyunan01@163.com;2.哈尔滨工业大学城市水资源开发利用(北方)国家工程研究中心,哈尔滨150090;3.哈尔滨工业大学水资源与水环境国家重点实验室,哈尔滨150090)
生物增强活性炭技术(bio-enhanced activated carbon,BEAC)是现代生物技术研究内容之一,其核心就是从自然界中筛选构建优势菌群,增强生物降解作用,保持生物活性炭工艺的长期稳定性,提高对污染物的去除效率[1].由于自然水体中生物相非常复杂,微生物的种类和数量较多,营养基质较少,从水体中筛选出的菌种活性很低,无法有效地降解污染物,且人工固定化活性炭上生物量较少,因此,进行菌群生物活性强化是有必要的.在饮用水处理中[2-4],优势菌群生物活性的强化就是通过从富营养到贫营养,再从贫营养到富营养而后再到贫营养的变化过程,最终使筛选出的菌株能够在微量有机物的水体中生长,提高菌种活性.微生物菌种生物活性的强化过程实际上是菌种的诱导变异过程,反复经过营养的变化,菌种具备了适应水质波动的贫营养环境,这样菌种被固定到活性炭上后,才能够保持旺盛的生物降解能力[5].
本文研究培养温度、pH值、培养时间和氧含量因素对优势菌群脱氢酶活性的影响,从而确定优势菌群生物活性强化的最优培养条件,并在优化条件下通过贫富营养交替的方式强化优势菌群的生物活性,以PCR-DGGE技术比较了优化条件与未优化条件下强化的优势菌群在活性炭上的生物量固定情况.
1 试验
1.1 优势菌来源
从松花江水中筛选出5株具有降解有机物效果的菌种,经鉴定分别为Pseudomonas balearica,Pseudomonas putida,Acinetobacter calcoaceticus,Acinetobacter lwoffii,Brevibacterium mcbrellneri.
1.2 培养基
Ⅰ:牛肉膏3 g,蛋白胨10 g,葡萄糖10 g,NaCl 5 g,松花江水1 000 mL,112℃灭菌20 min;Ⅱ:蛋白胨10 g,葡萄糖10 g,NaCl 5 g,松花江水1 000 mL,112℃灭菌20 min.
Ⅲ:葡萄糖 10 g,NaCl 5 g,松花江水1 000 mL,112℃灭菌20 min.
Ⅳ:NaCl 5 g,松花江水1 000 mL,112℃灭菌20 min.
Ⅴ:NaCl 5 g,松花江水砂滤出水1 000 mL,112℃灭菌20 min.
1.3 试验方法
优势菌群最优培养条件确定:通过I号培养基,研究不同培养条件下,即培养温度(13~38℃)、pH值(3~10)、培养时间(12~72 h)、溶解氧质量浓度(4~9 mg/L),优势菌群脱氢酶活性的变化规律.
优势菌群生物活性强化试验:在已确定的最佳生长条件下,利用不同浓度梯度营养成分的强化培养基(I、Ⅱ、III、Ⅳ、V),对优势菌群进行反复强化,强化培养采用半连续驯化培养法,其过程为:将待用菌株的斜面用10 mL无菌水洗脱,然后各取2 mL菌液分别接种于装有已灭菌的100 mL培养基I中,再置于摇床上.吸取菌株培养基I的培养液10 mL,分别加入盛有100 mL培养基Ⅱ的玻璃瓶中,置于摇床上培养.依次按上述量和培养方法,将菌株的培养液分别加入培养基III、Ⅳ、V中,最后加入已经灭菌的水中[6].
试验重复进行3次,图表中所得结果为3次实验平均值.溶解氧参数变化控制采用加氧泵进行曝气,试验装置如图1所示.

图1 优势菌群生物活性强化的溶解氧控制试验装置
1.4 检测方法
生物活性检测方法采用脱氢酶活性法,选用无色的氯化三苯基四氮唑(TTC)受氢后变成红色的三苯甲基(TF),然后利用比色法做定量分析[7-8].取培养后的混合菌液10 mL,置于离心管中,4 000 r/min离心10 min,弃去上清液,底部菌体用无菌水洗脱倒入比色管,进行脱氢酶测定.
2 结果与讨论
2.1 温度对优势菌群脱氢酶活性的影响
研究不同温度条件下优势菌群脱氢酶活性的变化,培养条件为pH值7.0,培养时间为24 h,DO值范围为6~8 mg/L,结果如图2所示.温度是影响微生物活性的主要因素,不同菌种相应的最佳生长温度也不同,在适宜的温度下,活化分子数增多,反应速度加快,从而使微生物的降解速度加快.中温菌所产生的酶一般要求较高反应温度,在低温条件下酶活性降低,而来自耐冷菌细胞中的酶必须适应低温环境,它们的分子结构能够在低温下保持较高的稳定性和催化活性[9].试验观察优势菌群在培养温度为18~23℃范围脱氢酶活性较高,培养温度低于13℃和高于33℃时,优势菌群脱氢酶活性较低,最佳温度为18℃.
2.2 pH对优势菌群培养中脱氢酶活性的影响
微生物生长适宜pH值范围较宽,不同微生物生长的最适pH值也有一定差别,并且各微生物生长的最适pH值与其分泌某种代谢产物的pH值通常是不同的,因此,确定优势菌群最适pH值范围可以提高优势菌群的生物活性并在扩大培养中得到较高的菌量[10].试验研究pH值在3~10范围内优势菌群脱氢酶活性的变化规律,培养条件为温度23℃,培养时间为24 h,DO值范围为6~8 mg/L,结果如图3所示.pH值范围在5~9时优势菌群脱氢酶活性较高,最适pH值为6,说明优势菌群在偏酸性条件下有较高的活性.
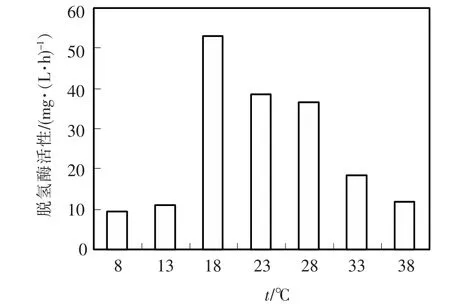
图2 温度对优势菌群培养中脱氢酶活性的影响

图3 pH对优势菌群培养中脱氢酶活性的影响
2.3 培养时间对优势菌群培养中脱氢酶活性的影响
图4为优势菌群随培养时间变化的脱氢酶活性测定结果,培养条件为温度23℃,pH值为7.0,DO值范围为6~8 mg/L.0~24 h优势菌群生长处于迟缓期,生物活性较低.当微生物细胞适应环境后,24~36 h处于对数生长期,生物活性迅速升高.42~54 h内,微生物细胞进入稳定期,生物活性变化不明显,当培养60 h以后,由于环境中营养物质的不足,微生物进入生长的衰亡期,生物活性明显降低,因此,最佳培养时间可确定为36 h.
2.4 溶解氧对优势菌群培养中脱氢酶活性的影响
由于试验所选5株优势菌均为好氧性微生物,氧作为在呼吸作用中的最终电子受体和供不饱和脂肪酸等的合成,其对优势菌的生物活性有很大的影响[10].图5为优势菌群培养过程中氧质量浓度对脱氢酶活性的影响,培养条件为温度23℃,pH值为7.0,培养时间为24 h.可以看出,当培养液中溶解氧含量小于7 mg/L时,优势菌群的脱氢酶活性随溶解氧质量浓度增加而升高;当溶解氧含量大于7 mg/L时,优势菌群脱氢酶活性升高趋势减缓,脱氢酶活性维持在40~45 mg/(L·h),因此,可确定优势菌群最适生长溶解氧为7 mg/L.

图4 培养时间对优势菌群培养中脱氢酶活性的影响

图5 DO对优势菌群培养中脱氢酶活性的影响
2.5 优势菌群生物活性强化过程分析
图6为两种条件下优势菌群生物活性强化过程,其中优化条件为温度18℃,pH值为6,单一培养基培养时间为36 h,溶解氧质量浓度为6~7 mg/L.未优化条件为温度23℃,pH值为6,单一培养基培养时间为24 h,溶解氧质量浓度为6~7 mg/L.可以看出,两种条件强化过程在初始阶段优势菌群的生物活性均较低,从富营养化向贫营养化转变的过程中,在较优条件下生长的优势菌群生物活性首先有一定的增加,但是增加幅度不明显,这说明菌种在驯化过程中出现一个适应过程,在这个适应过程中,虽然改变了培养基的类型,但是增强菌不能在短时间内适应这个变化,因而生物活性的增强受到了抑制.当驯化进行到贫营养的状态时,即进入Ⅴ号培养基,增强菌的生物活性有所降低,这是由于培养基Ⅴ不含有微生物所需的营养物质,微生物的脱氢酶活动受到较大抑制.在第二阶段由贫营养化向富营养化变化,从Ⅴ至Ⅲ的变化过程中,微生物活性迅速增加,这一阶段微生物适应了营养水平的变化,微生物活性呈现出线性增加的状态,在随后的Ⅲ至Ⅰ的过程中,虽然营养物质水平增加了,但是生物活性增长幅度较小,因而可以认为驯化达到了终点,即使营养水平再变化也不会对微生物活性有较大改变.与优化条件相比,未优化条件下的优势菌群生长活性变化较慢,适应性较差.

图6 优势菌群生物活性强化过程中脱氢酶活性的变化规律
2.6 优势菌固定活性炭上PCR-DGGE分析
试验采用PCR-DGGE技术[11-12]比较两种条件下强化生物活性后的优势菌群在活性炭上固定化的情况,测定得到的指纹图谱见图7.指纹图谱中不同的阴影部分代表不同的菌种,而阴影带的数目代表生物菌种的数目,每一条阴影都代表不同的生物菌种,而阴影的深浅可以定性地代表其所指征的菌种的数量.可以看出,泳道A图代表优化条件下生物活性强化的优菌群固定化结果,泳道B代表未优化条件下生势物活性强化的优势菌群固定化结果.泳道A图与B图均有明显的5个条带,说明活性炭表面明显呈现5株菌种,但优势菌的数量有所不同,泳道A图5株优势菌的条带阴影明显比B图5株优势菌的条带阴影浅,说明生物活性较强的优势菌群固定在活性炭上的数量较多,有研究表明[13]微生物活性较高,其可分泌胞外多聚物的能力较强,这种粘性的胞外多聚物在细菌与载体间起到了生物粘合剂的作用,使细菌较为容易实现在载体表面的附着和固定.

图7 PCR-DGGE分析结果
3 结论
1)优势菌群在pH=6、温度18℃、培养时间36 h、溶解氧7 mg/L条件下进行生物活性强化可以得到较高的脱氢酶活性.
2)根据PCR-DGGE分析结果,在优化条件下强化所得到高活性优势菌群在活性炭上固定的数量明显高于未在优化条件下生长的优势菌群.
[1] 杨基先,马放,赵庆良,等.固定化生物活性炭除微量有机物的应用研究[J].东北师范大学学报(自然科学版),2002,32(1):91-95.
[2] XIANDA Z,ROBERT F H,THOMAS C V.Longterm evaluation of adsorption capacity in a biological activated carbon fluidized bed reactor system[J].Wat Res,1999,33(13):2983-2991.
[3] BOON N,TOP E M,VERSTRAETE W,et al.Bioaugmentation as a tool to protect the structure and function of an activated sludge microbial community against a 3-chloroaniline shock load[J].Appl Environ Microbiol,2003,6(9):1511-1520.
[4] SILVA E,FIALHO A M,SA-CORREIA I,et al.Combined bioaugmentation and biostimulation to clean up soil contaminated with high concentrations of atrazine[J].Environ Sci Technol,2004,38(2):632-637.
[5] NARASIMMALU R,OSAMU M,NORIFUMI I,et al.Variation in microbial biomass and community structure in sediments of eutrophicbays as determined by phospholipid ester linked fatty acids[J].Applied and Environment Microbial,1992,58(2):562-571.
[6] 安东.活性炭组合工艺除污染特性及机理[D].哈尔滨:哈尔滨工业大学,2005:103-104.
[7] KOLMERT A,HENRYSSON T.Optimization of sulphide production in an anaerobic continuous biofilm process with sulphate reducing bacteria[J].Biotechnology Letters,1997,17(10):971-975.
[8] 周春生,尹军.TTC-脱氢酶活性检测方法的研究[J].环境科学学报,1996,16(4):400-405.
[9] 刘雨,赵庆良,郑兴灿.生物膜法污水处理技术[M].北京:中国建筑工业出版社,2003:22-23.
[10] 任南琪,马放.污染控制微生物学[M].哈尔滨:哈尔滨工业大学出版社,2002:129-132.
[11] ZHOU J,BRUNS M A,TIEDJE J M.DNA recovery from soils of diverse composition[J].Applied and Environmental Microbiology,1996,62(2):316-322.
[12] 马悦欣,HOLMSTROM C,WEBB J,等.变性梯度凝胶电泳(DGGE)在微生物生态学中的应用[J].生态学报,2003.23(8):1562-1568.
[13] LAZAROVA V,MANEM J.Biofilm characterization and activity analysis in water and wastewater treatment[J].Wat Res,1995,29(10):2227-2244.
