小麦麸皮中束缚型酚酸的化学法释放工艺
2010-03-23曹学丽
郝 杰,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
小麦麸皮中束缚型酚酸的化学法释放工艺
郝 杰,曹学丽*
(北京工商大学化学与环境工程学院,北京市植物资源研究开发重点实验室,北京 100048)
研究小麦麸皮中主要抗氧化活性物质束缚型酚酸的化学法释放工艺。利用超声辅助碱解技术进行酚酸成分的释放,通过单因素试验确定因素与水平,应用Box-Behnken设计三因素三水平的试验,依据回归分析确定最优的提取工艺条件。结果表明,化学法释放小麦麸皮酚酸的优化提取工艺条件为粉碎粒径0.5mm、温度60℃、时间1h、碱液浓度0.1mol/L、料液比2.5:100(g/mL),提取的总酚释放量为3.687mg/g。处理后的麦麸中游离型酚酸的含量与传统醇提法相比,提高了7.23倍。
谷物麸皮;酚酸;响应面分析;工艺优化
小麦麸皮是面粉工业的主要副产物,我国每年出产的小麦麦麸在2000万吨以上,目前经济利用价值极低[1]。酚酸是酚类物质中的一类,约占植物源食品中酚类化合物的1/3,多为苯甲酸和肉桂酸的羟化衍生物[2],许多研究结果证明其具有良好的保健功能[3-6]。谷物麸皮中的酚酸绝大多数(90%以上)与纤维素木糖以酯键或醚键的形式相连,称为束缚型酚酸[7],在胃及小肠部分不能被吸收,主要作用于下消化道,经结肠微生物发酵作用释放出生物活性物质,可以达到预防癌症、心血管疾病、Ⅱ型糖尿病等多种慢性疾病的功效[8]。因此,谷物麸皮的利用价值逐渐受到重视。采用适当方法将麸皮中活性物质从交联的低聚糖中释放出来,提高游离型酚酸的含量,从而增加在没有结肠微生物发酵作用的上消化道的生物利用度,对开发功能性食品、提高膳食质量有非常重要的意义[9-10]。
由于降解低聚糖中的酯键和醚键可以通过酸碱作用或者酶反应来实现,现阶段对于释放谷物麸皮中束缚型酚酸的研究主要分为化学法和生物方法两种。Oufnac等[11]研究在传统浸提法下,不同溶剂条件对小麦麸皮中酚类化合物提取率的影响,结果表明采用甲醇提取时最高,可达到467.5μg/g。付忠梅等[12]利用正交设计优化了从麦麸中提取阿魏酸的工艺,可达2.58mg/g。张璟等[13]通过采用黑曲霉产木聚糖酶和阿魏酸酯酶的双酶混合物酶解小麦麸皮,酶解6h可得阿魏酸4.4mg/g。同时,物理的破碎手段也可增加麦麸中氨基酸、维生素等功能性组分的释放量[14],可作为辅助的释放手段进行研究。
本实验选取产自山东济宁市的麸皮样品,通过超声辅助碱解工艺将其中的束缚型酚酸进行释放,并对影响酚酸释放量的几个重要因素进行单因素试验及响应面分析,对其工艺条件进行优化。
1 材料与方法
1.1 材料与试剂
小麦样品(济麦22号) 购自山东济宁市。一水没食子酸(分析纯) 国药集团化学试剂有限公司;Folin-酚试剂 美国Sigma公司;无水乙醚、甲醇(均为分析纯)。
1.2 仪器与设备
SpectraMax 190连续波长酶标仪 美国Molecular Devices分子仪器有限公司;KQ-400DB超声波清洗器昆山超声仪器有限公司;RE-2000型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 小麦麸皮酚酸的提取
称取一定量粉碎后的麦麸样品,用NaOH溶液作为提取溶剂,设定提取温度、提取时间、碱液浓度、粉碎粒径、料液比进行碱解提取,提取结束后4000r/min离心10min后得到碱解液,用2mol/L HCl溶液调节至pH2,用10mL乙醚萃取3次,有机相混合后减压蒸干,用1mL甲醇复溶,用于测定酚酸含量。
1.3.2 总酚酸含量的测定[15]
本实验总酚酸测定采用Folin-Ciocalteu法进行测定。
标准曲线的绘制:精确称取100mg没食子酸定容至100mL,分别取0、0.2、0.4、0.6、0.8、1.0、1.2mL上述溶液于容量瓶中,定容至10mL,此时各质量浓度分别为0、20、40、60、80、100、120μg/mL,分别取100μL上述标准液于试管中,各加入300μL水,150μL的福林试剂,450μL质量分数20% Na2CO3溶液,充分振荡后于室温下避光静置30min。取200μL置于96孔板中于760nm波长处测其吸光度,以吸光度对质量浓度进行回归,得到回归方程。
样品测定:分别取100μL样品试管中,加入300μL水、150μL的福林试剂、450μL 20% Na2CO3溶液,充分振荡后于室温避光静置30min。取200μL置于96孔板中于760nm波长处测其吸光度,根据标准曲线计算总酚含量。
1.3.3 酚酸提取的单因素及响应面优化设计试验
按照不同的提取方法、粉碎粒径、温度、时间、碱液浓度、料液比进行处理、得到酚酸的甲醇溶液之后,进行总酚含量的测定。每个处理做3组平行试验,确定单因素的优化条件。
结合单因素试验结果,采用Desgin Expert 7软件,应用Box-Behnken设计进行三因素三水平试验(表1),并利用响应面法对释放条件进行优化。

表1 响应面试验因素和水平Table 1 Factors and their coded levels in the Box-Behnken design
在单因素试验基础上,以温度、料液比和碱液浓度为自变量,以总酚释放量为响应值进行响应面分析试验。
1.3.4 超声辅助碱解释放工艺与传统醇提法的对比
取两份等质量麦麸0.5g,一份不采用超声辅助碱解释放,室温条件下,用20mL 80%甲醇溶液磁力搅拌辅助提取3次,时间分别为1.5、1、0.5h。滤液合并,浓缩至10mL,酸化至pH2,用10mL乙醚提取3次,减压蒸干,1mL甲醇复溶,测定总酚含量。
另一份采用优化后的超声辅助碱解释放工艺,处理后用同样方式提取测定。
2 结果与分析
2.1 总酚测定工作曲线的绘制
以没食子酸质量浓度为自变量,吸光度为因变量,得到总酚质量浓度和吸光度的线性回归曲线,其方程为:y=0.0525x+0.0384,R2=0.9942。
2.2 单因素试验结果分析
2.2.1 提取方法的比较

图1 提取方式对总酚释放量的影响Fig.1 Effect of extraction ways on total phenolic release
对静置浸提、磁力搅拌辅助、超声辅助进行比较,设定粉碎粒径0.5mm、料液比1:100(g/mL)、碱液浓度0.1mol/L、提取温度25℃、提取时间2h。由图1可见,在采用超声辅助的情况下,总酚释放量明显高于其他两种方法,超声辅助能够更好的使提取液浓度均一,同时使物料在溶液中更分散。故确定采用超声辅助提取为
优化的提取方法。
2.2.2 粉碎粒径对总酚释放量的影响
设定料液比1:100(g/mL)、碱液浓度0.1mol/L、提取温度60℃、提取时间1h;分别选择粉碎粒径为5、0.5、0.05mm进行单因素试验。由图2可以看出在0.5mm粒径下,释放量高于其他两种,这可能是由于过小的粒径导致物料在液体中板结,不能与提取液充分接触,特别是考虑到后期放大生产,不宜采用过细的粒径,故选取0.5mm为优化的粉碎粒径。
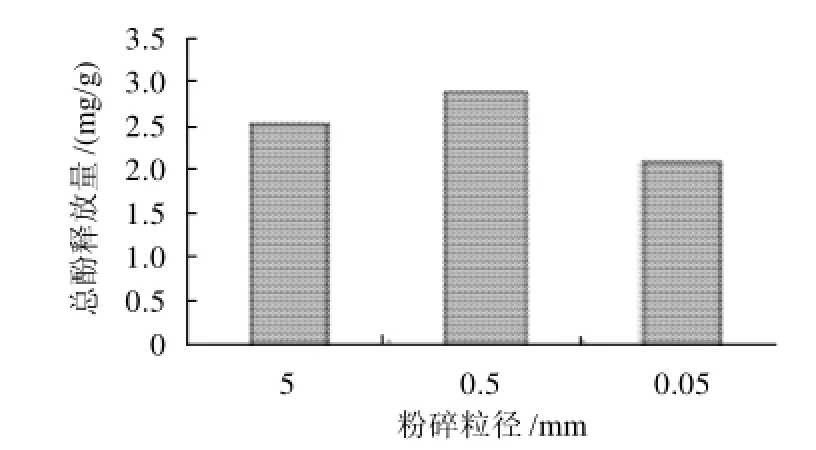
图2 粉碎粒径对总酚释放量的影响Fig.2 Effect of material particle size on total phenolic release
2.2.3 碱液浓度对总酚释放量的影响
设定粉碎粒径0.5mm、料液比1:100(g/mL)、提取温度60℃、提取时间1h;分别采用0.00、0.05、0.10、0.15、0.20mol/L NaOH溶液进行碱解释放。由图3可知,随着碱液浓度上升,释放量逐渐增大,在0.1mol/L之后释放量上升不明显,考虑到试验的经济性,选取0.1mol/L为优化的碱液浓度条件。
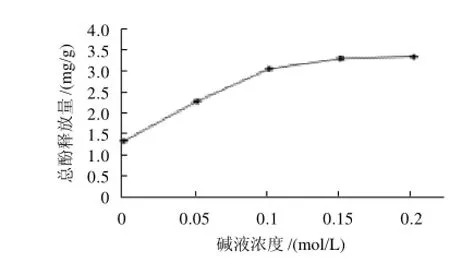
图3 碱液浓度对总酚释放量的影响Fig.3 Effect of material particle size on total phenolic release
2.2.4 提取时间对总酚释放量的影响
设定粉碎粒径0.5mm、碱液浓度0.1mol/L、料液比1:100(g/mL)、提取温度60℃;分别选择5、10、15、20、30、40、50min和1、2、3、4、6h提取时间进行试验。由图4可知,在5~60min阶段内,随着提取时间延长,总酚释放量呈上升趋势,同时也发现从提取时间1h开始上升趋势变缓,总酚释放量提高不明显,而且随着时间延长,提取成本会上升,故选择提取时间1h为优化的提取时间。

图4 提取时间对总酚释放量的影响Fig.4 Effect of length of extraction time on total phenolic release
2.2.5 提取温度对总酚释放量的影响
设定粉碎粒径0.5mm、碱液浓度0.1mol/L、料液比1:100(g/mL)、提取时间1h;选择20、40、60、80℃进行试验。由图5可知,20~60℃区间内,曲线呈上升趋势,释放量随温度增高而增大,但在60℃的释放量达到极大值,60~80℃区间内又开始下降。所以,选择60℃为优化的提取温度。

图5 提取温度对总酚释放量的影响Fig.5 Effect of extraction temperature on total phenolic release
2.2.6 不同料液比对总酚释放量的影响
设定粉碎粒径0.5mm、碱液浓度0.1mol/L、提取温度60℃、提取时间1h;选择料液比1:100、2:100、3:100、4:100、5:100进行试验。由图6可知,在料液比为2:100时,总酚释放量达到最大值,在2:100之后随着料液比增大而释放量减少,这可能是因为在同样量的碱液溶剂下,过多的物料会使得碱液与物料接触不充分、不均匀,导致在提取过程中,不能够充分降解交联的阿魏酰低聚糖。故选取2:100为优化的料液比。
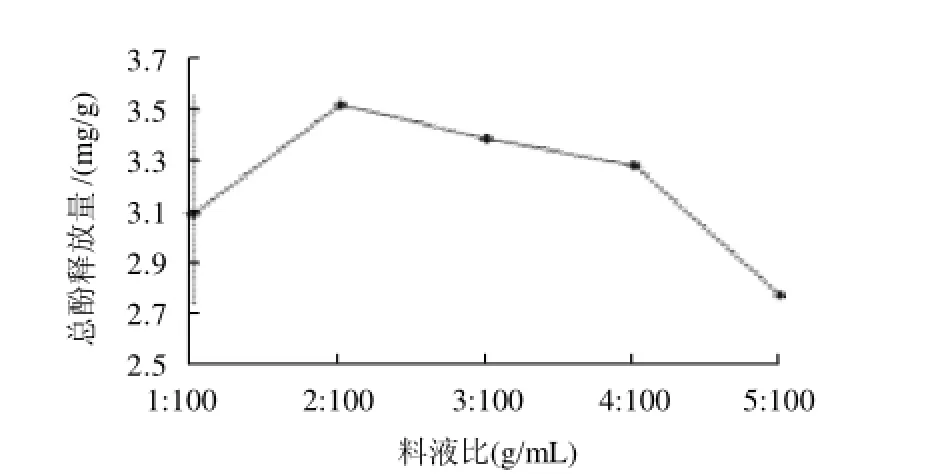
图6 不同料液比对总酚释放量的影响Fig.6 Effect of solid/liquid ratio on total phenolic release
2.3 响应面法对超声辅助释放小麦麸皮酚酸成分条件的优化
响应面分析试验所得结果如表2所示。利用统计软件对所得数据进行分析,表3为回归分析结果,进行回归拟合,解得回归方程为:Y=0.16X1+0.25X2+0.36X3-0.003X1X2+0.0225X1X3-0.083X2X3-0.65X12-0.33X22-0.27X32+3.63。决定系数R2=0.9803。从表3可以看出,线性项与二次项的P值小于0.05,该方程回归显著,总模型P值小于0.01,该方程回归显著,失拟项P值大于0.05,不显著。说明该试验方法是可靠的,能够很好的描述试验结果。

表2 响应面试验分析及结果Table 2 Response surface Box-Behnken design matrix and experimental results

表3 方差分析结果Table 3 Analysis of variances for the developed regression model
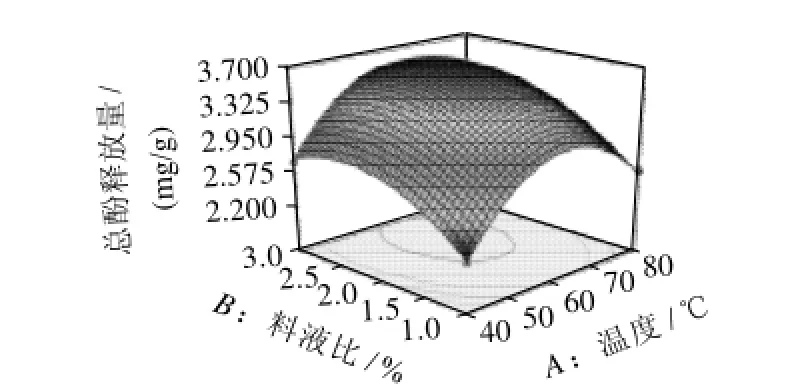
图7 提取温度与料液比对总酚释放量影响的响应面和等高线图Fig.7 Response surface and contour plots for the effects of extraction temperature and solid/liquid ratio on total phenolic release

图8 提取温度与碱液浓度对总酚释放量影响的响应面和等高线图Fig.8 Response surface and contour plots for the effects of extraction temperature and alkali concentration on total phenolic release
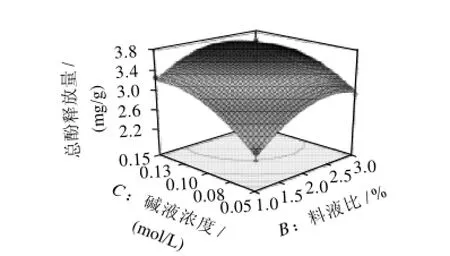
图9 料液比与碱液浓度对总酚释放量影响的响应面和等高线图Fig.9 Response surface and contour plots for the effects of solid/liquid ratio and alkali concentration on total phenolic release
通过方差分析,可以看出A(温度)、B(碱液浓度)和C(料液比)三个因素对总酚释放量影响极显著,因素影响顺序为碱液浓度>料液比>温度。
图7~9为因素交互作用的响应面和等高线图,由图可知,回归方程存在极大值,由Design expert软件分析可得最大响应值为3.783mg/g,最优提取条件为粉碎粒径0.5mm、温度62.38℃、时间1h、碱液浓度0.13mol/L、料液比2.30%。为验证响应面的可行性,采用所得到的优化后的提取条件对小麦麸皮酚酸释放进行验证实验,所采用的实际操作条件为粉碎粒径0.5mm、温度60℃、时间1h、碱液浓度0.1mol/L、料液比2.5:100(g/mL)。结果表明,所释放的总酚含量为3.687mg/g。
2.4 超声辅助碱解释放工艺与传统醇提法的对比
两份样品经各自处理之后,测得各自总酚含量为:
传统醇提法448μg/g,超声辅助碱解释放法3687μg/g。可以看出,在经过超声辅助碱解释放之后,麦麸中游离的总酚含量提高了7.23倍,达到了将大量束缚型酚酸从交联的低聚糖中释放出来的目的,这对提高小麦麸皮中丰富的酚酸类物质在人体整个肠道系统,特别是胃、小肠等上消化道中的生物利用度是非常有意义的。
3 结 论
采用Box-Behnken设计和响应面法分析法研究小麦麸皮中酚酸成分的释放工艺,结合单因素试验结果,确定最佳条件为采用超声辅助提取、粉碎粒径0.5mm、温度60℃、时间1h、碱液浓度0.1mol/L、料液比2.5:100 (g/mL)。释放量的极大值可达3.687mg/g。对酚酸释放量影响最大的因素为碱液浓度,其次为料液比和温度。
[1]王旭峰, 何计国, 陶纯洁, 等. 小麦麸皮的功能成分及加工利用现状[J]. 粮食与食品工业, 2006, 13(1): 19-22.
[2]张东明. 酚酸化学[M]. 北京: 化学工业出版社, 2009.
[3]SHAHIDI F, NACZK M. Phenolics in food and nutraceuticals[M]. 2nd ed. New York: CRC Press, 2003.
[4]ADOM K K, LIU Ruihai. Antioxidant activity of grains[J]. Journal of Agriculture and Food Chemistry, 2002, 50(21): 6182-6187.
[5]ZHOU Kequan, SU Lan, YU Liangli(Lucy). Phytochemicals and antioxidant properties in wheat bran[J]. Journal of Agiculture and Food Chemistry, 2004, 52(20): 6108-6144.
[6]ONYENEHO S N, HETTIARACHCHY N S. Antioxidant activity of durum wheat bran[J]. Journal of Agriculture and Food Chemistry, 1992, 40: 1496-1500.
[7]LIU Ruihai. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219.
[8]CARNACHAN S M, HARRIS P J. Ferulic acid is bound to the primary cell walls of all gymunosperm families[J]. Biochemical Systematics and Ecology, 2000, 28(9): 865-879.
[9]ANSON N M, van den BERG R, HAVENAAR R, et al. Bioavailability of ferulic acid is determined by its bioacceseibility[J]. Journal of Cereal Science, 2009, 49(2): 296-300.
[10]ANSON N M, SELINHEIMO E, HAVENAAR R, et al. Bioprocessing of wheat bran improves in vitro bioaccessibility and colonic metabolism of phenolic compounds[J]. Journal of Agriculture and Food Chemistry, 2009, 57: 6148-6155.
[11]OUFNAC D S, XU Zhimin, SUN Ting, et al. Extraction of antioxidant from wheat bran using conventional solvent and microwave-assisted method[J]. Cereal Chemistry, 2007, 82(2): 125-129.
[12]付忠梅, 王洪江, 李志江. 碱法提取麸皮阿魏酸工艺的优化研究[J].农产品加工: 学刊, 2007(6): 44-46.
[13]张璟, 欧仕益, 张宁, 等. 酶解麦麸制备阿魏酸和低聚糖的研究[J].食品科学, 2003, 24(11): 63-68.
[14]盛勇, 刘彩兵, 涂铭旌. 麦麸超微粉的功能组分变化探究[J]. 食品科学, 2004, 25(6): 78-81.
[15]杨磊, 隋小宇, 祖元刚, 等. Folin-Ciocalteu法测定迷迭香中总酚酸含量[J]. 中成药, 2009(2): 272-275.
Optimization of Chemical Release of Bound Phenolic Acids from Wheat Bran
HAO Jie,CAO Xue-li*
(Beijing Key Laboratory of Plant Resources Research and Development, College of Chemical and Environmental Engineering, Beijing Technology and Business University, Beijing 100048, China)
Ultrasonic-assisted alkaline hydrolysis was used to release bound phenolic acids, the major antioxidant components in wheat bran. Some process conditions for the release of these antioxidant substances were optimized through single factor investigations and subsequent response surface analysis based on a three-factor, three-level Box-Behnken design. The optimal conditions for releasing bound phenolic acids from wheat bran were found as follows: material particle size, 0.5 mm; temperature, 60 ℃, NaOH concentration, 0.1 mol/L; solid/liquid ratio (g/mL), 2.5:100; and length of extraction time, 1 h. The total phenolic release under these optimal conditions was 3.687 mg/g, 7.23-fold higher than that obtained by the conventional methanol extraction method.
cereal bran;phenolic acids;response surface methodology;process optimization
TS210.9
A
1002-6630(2010)18-0129-05
2010-06-30
郝杰(1984—),男,硕士研究生,研究方向为生物分离工程。E-mail:crab_susu@yahoo.com.cn
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离技术。E-mail:caoxl@th.btbu.edu.cn
