定点突变提高里氏木霉木聚糖酶 (XYN II) 的稳定性
2010-02-10韩承业余世袁欧阳嘉李鑫周娟许艳
韩承业,余世袁,欧阳嘉,李鑫,周娟,许艳
南京林业大学 林木遗传与生物技术省部共建教育部重点实验室,南京 210037
定点突变提高里氏木霉木聚糖酶 (XYN II) 的稳定性
韩承业,余世袁,欧阳嘉,李鑫,周娟,许艳
南京林业大学 林木遗传与生物技术省部共建教育部重点实验室,南京 210037
通过定点突变的方法,在来源于里氏木霉Trichderma reesei的木聚糖酶XYN II的N-末端两个β折叠片层间添加二硫键,以提高木聚糖酶的稳定性。原酶XYN-OU和突变酶XYN-HA12 (T2C、T28C和S156F) 分别在毕赤酵母中分泌表达,突变酶与原酶纯化后进行酶学性质比较。结果表明:突变酶最适反应温度由50℃提高到60℃;在70℃的半衰期由1 min提高到14 min;最适反应pH为5.0,与原酶保持一致,但是在50℃、30 min条件下的pH稳定范围由4.0~9.0扩展到3.0~10.0。对木聚糖酶分子改良的结果反映出在β片层间添加二硫键可以有效改善酶在较高温度下三维结构的刚性,提高热稳定性。
定点突变,木聚糖酶,热稳定性,里氏木霉
近年来,随着木聚糖酶晶体结构的解析和人类对蛋白质分子功效的认识不断深入,对酶进行分子改良已成为可能。采用基因工程手段提高木聚糖酶稳定性的研究得到不断地发展。Stephens等[3]采用易错PCR的定向进化手段挑选热稳定性更好的菌株,得到的耐热菌株在70℃的半衰期由原始菌株的89 min提高到 215 min;Sriprang等[4]采用精氨酸取代Aspergillus niger BBC14405表面的丝氨酸/苏氨酸,提高了酶的热稳定性。许多研究结果表明G/11家族木聚糖酶的 N-末端区域和二硫键的添加对于 G/11家族木聚糖酶的稳定性起着很重要的作用。杨浩盟等[5]通过 N-末端氨基酸的点突变 (N13D和 S40E)替换将橄榄绿链霉菌 Streptomyces olivaceoviridis木聚糖酶热稳性提高了24.76%;Georis等[6]通过提高 N-末端芳香族氨基酸间的相互作用来增强Streptomyces的热稳性;Sun等[7]用耐热性木聚糖酶TfxA的N-末端区域替换黑曲霉Aspergillus niger木聚糖酶A的N-末端相应区域,使其最适反应温度提高 10℃;Wakarchuk等[8]在芽胞杆菌 Bacillus circulans木聚糖酶的 N-和 C-区域构建了一个二硫键使该木聚糖酶热稳性提高大于 10℃;Jeong等[9]在脂肪嗜热芽胞杆菌 Bacillus stearothermophilus No. 236木聚糖酶内部构建一个二硫键,使木聚糖酶XynA 的热稳性提高 5℃。Fenel等[10]在里氏木霉Trichoderma reesei XYN II的N-末端构建一个二硫键,并延长C-末端使酶的最适温度提高10℃,本研究受其启发在酶的N-末端构建二硫键,并通过156位点的突变大幅度地提高了酶活力。
来源于里氏木霉的木聚糖酶 XYN II是属于G/11家族木聚糖酶,适合应用于生物漂白过程。重组木聚糖酶XYN II对麦草浆CEH的辅助漂白,在保证纸浆白度略有提高的前提下,可以降低氯化段有效氯使用量50%以上[11]。但热稳定性较差是它在应用中的不足。本研究针对上述问题,通过定点突变的方法在木聚糖酶的N-末端构建了一个二硫键,以期提高XYN II的热稳定性。
1 材料与方法
1.1 菌种、质粒
木聚糖酶基因xyn II由本实验室从Trichoderma reesei中获得并构建在重组毕赤酵母表达载体pPIC9K-xyn II上[12];菌株大肠杆菌Escherichia coli DH5α、载体 pPIC9K (Amp+,Kan+) 均由本实验室保存;毕赤酵母菌株 GS115 (His−) 购自 Invitrogen公司。
1.2 培养基
大肠杆菌培养基 LB,毕赤酵母培养基 YPD、MM、MD、BMGY和BMMY (配方参见Invitrogen公司的毕赤酵母表达手册)。
1.3 工具酶和生化试剂
多重定点突变试剂盒 (QuikChange®multi site-directed mutagenesis kit) 为 Stratagene公司产品;限制性内切酶Sal I、DNA分子量标准和质粒提取试剂盒为 TaKaRa公司产品;蛋白质分子量标准为MBI公司产品;酵母粉和蛋白胨为英国OXOID公司产品;YNB购自上海晶美生物公司;可溶性木聚糖4-O-Me-D-glucurono- D-xylan (From birchwood)和Bradford 试剂为Sigma公司产品;其他化学试剂均为国产分析纯。
1.4 定点突变
采用Stratagene公司的多重定点突变试剂盒,以重组质粒pPIC9K-xyn II为模板,突变引物 (表1) 设计用Stratagene公司的在线引物设计软件。反应体系含2.5 μL 10× QuikChange®Multi reaction buffer、0.75 μL QuikSolution、1 μL dNTP mix、1 μL 10× QuikChange®Multi enzymes blend,各引物 (T2C、T28C、S156F) 的量均为10 pmol。PCR条件:95℃预变性1 min;95℃变性1 min,55℃退火1 min,65℃延伸 20 min。PCR产物经 Dpn I消化,转化XL10-Gold感受态细胞,涂布在含氨苄青霉素LB平板上。具体操作步骤参见Stratagene公司多重定点突变试剂盒的说明手册。挑取阳性克隆子培养并提取质粒,送金思特 (南京) 有限公司进行测序。
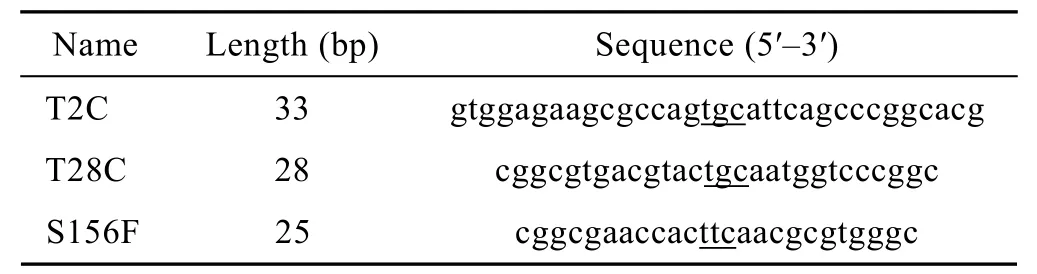
表1 突变引物Table 1 Mutated primers
1.5 重组木聚糖酶工程菌的构建与表达
1.5.1 毕赤酵母的转化与筛选
将突变质粒pPIC9K-ha12用Sal I单酶切使之线性化,电击转化毕赤酵母 GS115,转化液涂布于不含组氨酸的MD平板,30℃条件下培养至转化子出现。挑取转化子,点种到含 0、0.5、1.0、2.0、3.0和4.0 g/L G418的YPD培养基平板上,30℃培养2 d,在高浓度G418平板上生长的为高拷贝阳性转化子用于后续发酵表达。电转化及筛选方法参见Invitrogen公司操作手册。
1.5.2 重组毕赤酵母工程菌株的诱导表达
将阳性转化子接种于含25 mL BMGY培养基的250 mL的摇瓶中,30℃、260 r/min摇床培养到OD600至2.0~6.0。离心收集菌体,用一定体积的BMMY重悬菌体,使其OD600大约在1.0,30℃、260 r/min继续培养,每24 h补加适量甲醇至体积分数1%。每12 h取样,离心5 min,收集上清液,即为粗酶液。
1.6 重组木聚糖酶的纯化
收集酵母发酵上清液,以分子量为10 kDa的超滤管 (Sartorius stedim biotech gmbH),滤去小分子量蛋白和盐,经过分子筛Superdex 75 prep grade纯化,上样量为2 mL,使用去离子水,流速0.5 mL/min洗脱,分布收集洗脱峰中的样品,经过酶活测定,确定目的样品所在的收集管,得到电泳纯的目标蛋白。纯化倍数计算公式:纯化酶比酶活÷粗酶比酶活;酶活回收率计算公式:(纯化酶比酶活×纯化酶蛋白浓度×纯化酶体积) ÷ (粗酶比酶活×粗酶蛋白浓度×粗酶体积) ×100%。利用Bradford法[13]测定蛋白含量;SDS-PAGE方法见参考文献[14]。
1.7 蛋白的去糖基化处理
样品采用Endo Hf(New England BioLabs) 进行去糖基化处理。反应条件如下:将20 μg糖蛋白于1倍糖蛋白变性缓冲液中100℃煮沸10 min使其变性;加入1/10体积10倍G5缓冲液;加入1~5 μL Endo Hf,37℃条件下温育1 h,然后进行电泳鉴定。
1.8 木聚糖酶酶活测定
酶活定义以桦木木聚糖 (Sigma公司) 为底物每分钟产生1 μmol木糖所需的酶量为一个酶活力单位 (1 IU)。采用DNS定糖法测定木聚糖酶的活性[15]。
2 结果与分析
2.1 突变位点的确定
来源于里氏木霉的木聚糖酶XYN II是属于G/11家族木聚糖酶,这个家族的空间结构类似于右手半握形状:由2个β-折叠片层和1个α-螺旋组成[16],折叠片层大部分是由反平行 β-折叠所组成的。两个β-折叠片层的疏水面堆积在一起形成三明治形状,称为“手指”形状。有报道称在木聚糖酶的N-末端添加二硫键可以提高酶的热稳定性[10],而且分析木聚糖酶XYN II结构发现其分子结构中不含二硫键。同时考虑到N-末端远离催化活性位点,添加二硫键不会影响其催化活性。木聚糖酶XYN II的第2位和第28位的苏氨酸分别位于2个平行的β-折叠片上,将其突变为半胱氨酸,从而形成了一个分子内的二硫键,加固了木聚糖酶的结构,使其在极端的环境中,能够较好地维持结构稳定性,保证了其性质上的稳定。文献[7]中所报道的重组木聚糖酶 (即本实验中的木聚糖酶) 其最大酶活为 1.45 IU/mL,这与文献[17]中报道的9.58 IU/mL的酶活有较大的差距。将2个酶的基因序列进行比对发现只有156位点存在差异。因此将156位点的丝氨酸突变为苯丙氨酸,提高酶的疏水性,增强酶和底物的相互作用,以期提高酶活。所用木聚糖酶结构及各突变位点如图 1所示。
2.2 定点突变
以pPIC9K-xyn II为模板,通过PCR扩增,Dpn I酶消化,使生成的带3个突变的单链环,转化进 E. coli,形成双链重组表达质粒。构建出pPIC9K-ha12。通过测序分析,确定突变位点与目标设计的突变位点一致。
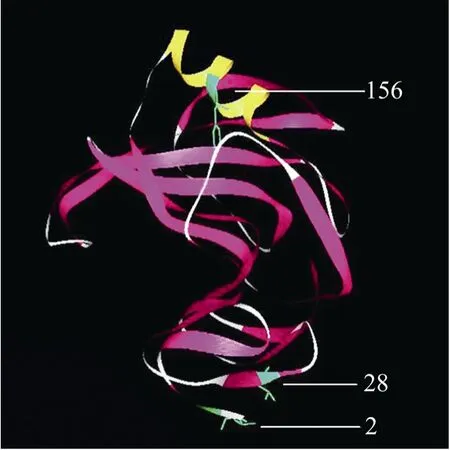
图1 木聚糖酶XYN II结构及各突变位点Fig. 1 Structure of xylanase XYN II and the mutated site.
2.3 重组木聚糖酶菌株的筛选、表达和重组木聚糖酶的纯化
2.3.1 重组木聚糖酶菌株的筛选、表达
将突变质粒pPIC9K-ha12用Sal I单酶切使之线性化后电击转化毕赤酵母GS115,在MD筛选培养基上筛选得到100个阳性转化子,进一步点种于含有不同浓度梯度 G418的 YPD平板上,获得了35个阳性转化子。采用BMMY培养基分别诱导表达这些阳性转化子,测定酶活,获得高表达菌株P. pastoris OU and P. pastoris HA12 (见表2)。

表2 重组木聚糖酶XYN IITable 2 Combination of XYN II mutations
以1%甲醇为碳源诱导表达重组毕赤酵母,诱导48 h后停止,离心得到粗酶液。粗酶液的酶活力分别为 XYN-OU:(3.202±0.08) IU/mL,XYN-HA12:(28.591±0.97) IU/mL;酶蛋白量分别为XYN-OU:(0.066±0.002) mg/mL,XYN-HA12:(0.154±0.006) mg/mL;比酶活分别为 XYN-OU:48.52 IU/mg,XYN-HA12:185.66 IU/mg。
2.3.2 重组木聚糖酶的纯化
收集酵母发酵上清液 (图2A),以分子量为10 kDa的超滤管,滤去小分子量蛋白和盐,然后经过分子筛Superdex 75 prep grade纯化,重组木聚糖原酶XYN-OU和重组突变酶XYN-HA12的主要纯化结果见表3。其中原酶XYN-OU的纯化倍数为4.2,酶活回收率为31.31%;突变酶XYN-HA12的纯化倍数和酶活回收率分别为4.6和23.94%。对纯化酶SDS-PAGE鉴定结果显示,经过FPLC (Fast protein liquid chromatography) 分离后,原酶XYN-OU达到电泳纯;纯化后的突变酶HA12在电泳图谱中显示2条带,对样品进行去糖基化处理后进行电泳鉴定(图 2B),发现图谱中只显示一条带。毕赤酵母在表达外源蛋白时会出现不同程度的糖基化修饰,说明另外一条带是糖基化的木聚糖酶。里氏木霉产木聚糖酶的分子量为20.3 kDa[14],而重组木聚糖酶的分子量为 21 kDa。从表 3的数据可以看出,突变酶XYN-HA12的比酶活比XYN-OU的高很多。
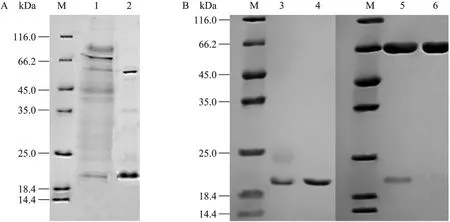
图2 酶液的SDS-PAGE图谱Fig. 2 SDS-PAGE analysis of xylanase. (A) The crude xylanase. M: protein marker; 1: XYN-OU; 2: XYN-HA12. (B) The purified xylanase. M: protein marker; 3: XYN-HA12; 4: XYN-OU; 5: deglycosylation enzyme XYN-HA12; 6: deglycosylase.

表3 野生酶和突变酶的比较Table 3 Comparison of xylanase from the wild type and the mutant enzymes
2.4 突变酶与原酶酶学性质的比较
2.4.1 最适反应温度和热稳定性
温度对木聚糖酶酶活的影响如图3A所示,突变酶XYN-HA12在55℃~65℃时酶活较高,最适反应温度为60℃,比原酶XYN-OU的最适反应温度升高了10℃。突变酶在65℃时相对酶活达95.56%,比原酶的27.65%提高很多;在70℃条件下突变酶的相对酶活为 68.07%,相比原酶的14.68%,酶活也有较大程度提高。突变酶XYN-HA12所加的二硫键加固了XYN II N-末端的2个β折叠片,当温度发生改变时,酶构象的变化速率将降低,或者说酶构象对温度的变化不敏感,因此,突变酶的耐热性有很大的提高。
实验结果显示,在70℃条件下,半衰期由原酶XYN-OU的1 min延长到突变后酶XYN-HA12的14 min (数据未显示)。热稳定性实验如图3B所示,在60℃条件下,保温10 min后,原酶XYN-OU的酶活全部丧失,而突变酶XYN-HA12的酶活在保温10 min后并没有变化;在70℃条件下,原酶保温2 min后酶活全部丧失,而突变酶保温2 min后其相对酶活达81.64%,并且在保温10 min后,相对酶活还可以保持在66.82%,这充分说明突变后XYN II的热稳性有很大的提高。
2.4.2 最适反应pH和pH稳定性
用100 mmol/L磷酸氢二钠-柠檬酸缓冲液配置不同pH的1.0%木聚糖底物测定酶活,结果如图4A所示。pH 5.0~6.0之间突变酶和原酶的相对酶活处在同一个水平,证明该酶在此范围内对pH不敏感,从图4A中可以看出2个酶的最适pH基本相同,pH 5.0~6.0时具有较高酶活。
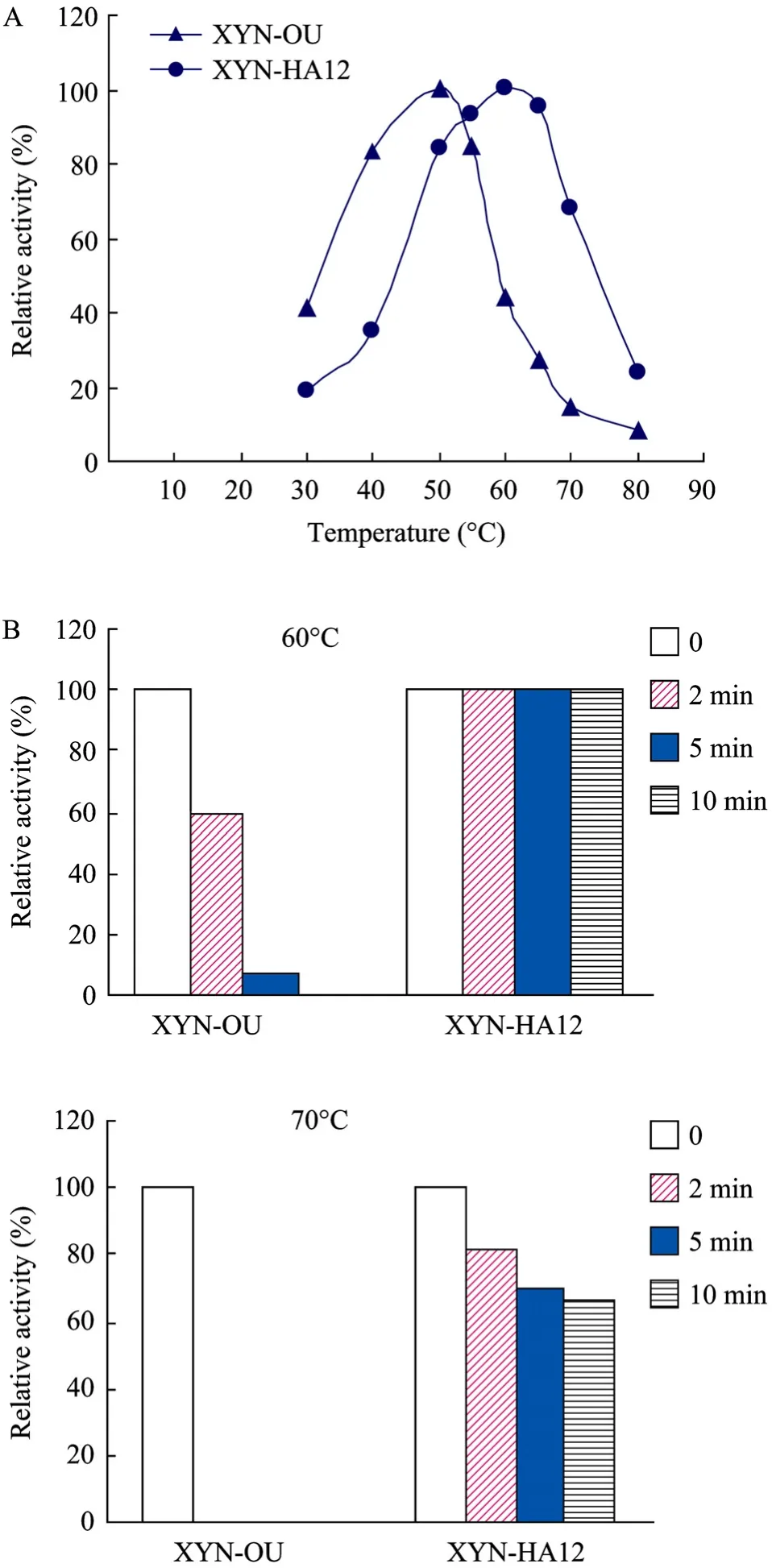
图3 原酶与突变酶的最适反应温度和热稳性比较Fig. 3 Comparison of the optimum temperature and thermostability between the native and mutated xylanase. (A) Comparison of the optimum temperature. (B) Comparison of the thermostability.
将纯化木聚糖酶置于不同pH缓冲液 (pH为3.0、4.0、5.0、6.0、7.0和8.0时采用柠檬酸-磷酸氢二钠缓冲液;pH为9.0和10.0时采用甘氨酸-氢氧化钠缓冲液) 中,在50℃下放置30 min后测定酶活(pH 5.0,50℃),考察突变酶与原酶在50℃下的pH稳定性。实验结果如图4B所示,原酶在pH 4.0~9.0之间相对酶活都保持在 50%以上,而突变酶在3.0~10.0之间的相对酶活都保持在50%以上,很明显比原酶的pH稳定性范围扩大了。值得注意的是,pH 9.0时的相对酶活都较pH 8.0时的大,可能与所用缓冲液不同有关。
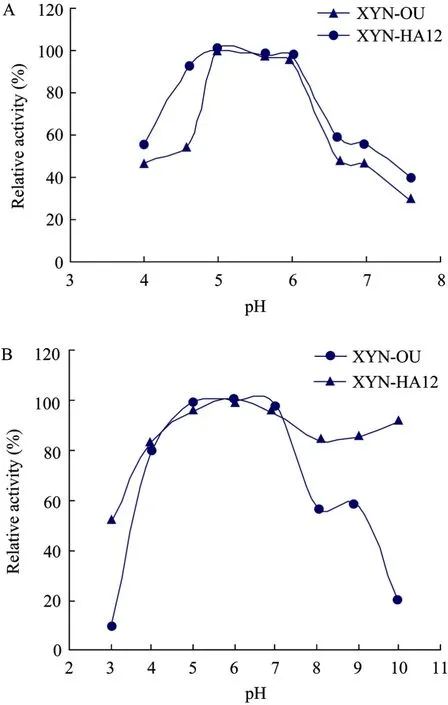
图4 原酶与突变酶的最适pH和pH稳定性比较Fig. 4 Comparison of the optimum pH value and pH stability between the native and the mutated xylanase. (A) Comparison of the optimum pH. (B) Comparison of the pH stability.
3 讨论
本研究中的突变酶相对于原酶来说,比酶活由原来的48.52 IU/mg提高到185.66 IU/mg,酶活的提高与156位点的突变有很大关系,由丝氨酸突变为苯丙氨酸,提高了酶的疏水性,增强了酶和底物的相互作用。最适反应温度由 50℃提高到 60℃,在70℃的半衰期由1 min提高到14 min,在50℃无底物条件下的pH稳定范围由4.0~9.0扩展到3.0~10.0,而最适pH没有变化,保持在pH 5.0。二硫键的构建,可能使得酶蛋白的结构更加稳定,在极端的环境中能够减缓酶结构变化的速率[18]。使木聚糖酶XYN II适宜应用于生物漂白过程。
[1] Beg QK, Kapoor M, Mahajan L, et al. Microbial xylanases and their industrial application: a review. Appl Microbiol Biotechnol, 2001, 56: 326−338.
[2] Chen JC, Wang BM, Qu YB. Bleaching of wheat straw pulps with fungal An-76. Trans China Pulp Paper, 1999, 11: 15−18.陈嘉川, 王保民, 曲音波. An-76真菌木聚糖酶漂白NaOH-AQ 麦草浆的研究. 中国造纸学报, 1999, 11: 15−18.
[3] Stephens DE, Rumbold K, Permaul K, et al. Directed evolution of the thermostable xylanase from Thermomyces lanuginosus. J Biotechnol, 2007, 127: 348−354.
[4] Sriprang R, Asano K, Gobsuk J, et al. Improvement of thermostability of fungal xylanase by using site-directed mutagenesis. J Biotechnol, 2006, 126: 454−462.
[5] Yang HM, Meng K, Luo HY, et al. Improvement of the thermostability of xylanase by N-terminal replacement. Chin J Biotech, 2006, 22(1): 26−32.杨浩盟, 孟昆, 罗会颖, 等. 通过 N末端替换提高木聚糖酶的热稳定性. 生物工程学报, 2006, 22(1): 26−32.
[6] Georis J, Esteves FDL, Lamotte-Brasseur J, et al. An additional aromatic interaction improves the thermostability and thermophilicity of a mesophilic family 11 xylanase: structural basis and molecular study. Protein Sci, 2000, 9: 466−475.
[7] Sun JY, Liu MQ, Xu YL, et al. Improvement of the thermostability and catalytic activity of a mesophilic family 11 xylanase by N-terminus replacement. Protein Express Purif, 2005, 42: 122−130.
[8] Wakarchuk WW, Sung WL, Campbell RL, et al. Thermostabilization of the Bacillus circulans xylanase by the introduction of disulfide bond. Protein Eng, 1994, 7: 1379−1386.
[9] Jeong MY, Kim S, Yun CW, et al. Engineering a de novo internal disulfide bridge to improve the thermal stability of xylanase from Bacillus stearothermophilus No.236. J Biotechnol, 2007, 127: 300−309.
[10] Fenel F, Leisola M, Jänis J, et al. A de novo designed N-terminal disulphide bridge stabilizes the Trichoderma reesei endo-1,4-β-xylanase II. J Biotechnol, 2004, 108: 137−143.
[11] Wang S. Xylanase Pretreatment on wheat straw pulp bleaching [D]. Nanjing: Nanjing Forestry University, 2009.王珅. 麦草浆木聚糖酶辅助漂白的研究[D]. 南京: 南京林业大学, 2009.
[12] Ouyang J, Wang XM, Zhang Q, et al. Secretory expression of Trichoderma reesei XYN II gene in Pichia pastoris. Chem Ind Forest Prod, 2007, 27(5): 83−88.欧阳嘉, 王向明, 张清, 等. 里氏木霉木聚糖酶 XYNII基因在毕赤酵母中的分泌表达. 林产化学与工业, 2007, 27(5): 83−88.
[13] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 31: 426−428.
[14] Jiang XH. Purification, characterization and mechanism of Trichoderma reesei xylanase [D]. Nanjing: Nanjing Forestry University, 2006.江小华. 里氏木霉木聚糖酶的分离纯化, 酶学性质及降解机理的研究[D]. 南京: 南京林业大学, 2006.
[15] Ghose TK. Measurement of cellulose activities. Pure Appl Chem, 1987, 59(2): 257−268.
[16] Törrönen A, Rouvmen J. Structural and functional properties of low molecular weight endo-1, 4-β-xylanase. J Biotechnol, 1997, 57: 137−149.
[17] Grange DCL, Pretorius IS, Zyl WHV. Expression of a Trichoderma reesei β-xylanase gene (XYN2) in Saccharomyces cerevisae. Appl Environ Microbiol, 1996, 62(3): 1036−1044.
[18] Jänis J, Rouvinen J, Leisola M, et al. Thermostability of endo-1, 4-β-xylanase II from Trichoderma reesei studied by electrospray ionization Fourier-transform ion cyclotron resonance MS, hydrogen/deuterium- exchange reactions and dynamic light scattering. J Biochem, 2001, 356: 453−460.
Enhancing stability of Trichoderma reesei xylanase (XYN II) by site-directed mutagenesis
Chengye Han, Shiyuan Yu, Jia Ouyang, Xin Li, Juan Zhou, and Yan Xu
Key Laboratory of Forest Genetics & Biotechnology, Ministry of Education, Nanjing Forestry University, Nanjing 210037, China
We engineered a disulphide bridge between two adjacent double-layered β-sheet at the N-terminal region of Trichoderma reesei endo-1,4-β-xylanase II(XYN II) by site-directed mutagenesis. The native xylanase XYN-OU and the mutated xylanase XYN-HA12 (T2C, T28C and S156F) were separately expressed in Pichia pastoris. Both xylanases were purified and characterized. The optimum temperature of XYN-HA12 was increased from 50°C to 60°C, relative to XYN-OU. At 70°C, the halftime of inactivation for XYN-OU and XYN-HA12 were 1 min and 14 min, respectively. The optimum pH of XYN-HA12 was 5.0, similar to XYN-OU. However, XYN-HA12 could retain over 50% activity from pH 3.0 to 10.0 at 50°C for 30 min. As for XYN-OU, it could retain over 50% activity from the pH value 4.0 to 9.0 at 50°C in 30 min. The result of the mutated xylanase indicated that constructed disulphide bridge could improve its thermostability at relatively higher temperature.
site directed mutagenesis, xylanase, thermostability, Trichoderma reesei
木聚糖酶 (EC3.2.1.8) 是一类以内切方式降解木聚糖分子中β-1,4木聚糖苷键的酶,可广泛应用于食品、饲料、酿造、医药和造纸等行业[1]。在制浆造纸的纸浆漂白工艺中添加木聚糖酶预处理,不仅能够增加纸张白度,改善纸张性能,还能降低漂白用化学物质用量,有效减轻造纸业对环境造成的巨大污染[2]。生物漂白是在 60℃左右、碱性条件下进行纸浆处理,要求用于生物漂白的木聚糖酶在50℃~60℃,pH 9.0~10.0碱性条件下具有较高活性。但是目前木聚糖酶漂白预处理技术的产业化应用仍然存在一些问题,由于酶在高温和碱性环境下不够稳定,其工业化应用受到限制。因此,提高木聚糖酶稳定性的研究十分必要。
November 25, 2009; Accepted: March 15, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (Nos. 2007AA02Z213, 2006AA020204), National Basic Research Program of China (973 Program) (No. 2007CB707800).
Shiyuan Yu. Tel: +86-25-85427255; Fax: +86-25-85424121; E-mail: syu@njfu.edu.cn
国家高技术研究发展计划 (863计划) (Nos. 2007AA02Z213, 2006AA020204),国家重点基础研究发展计划 (973计划) (No. 2007CB707800) 资助。
