川芎嗪对顺铂耳毒性保护作用的实验研究**1
2010-01-25孙宪昌张文娟康颂建
孙宪昌 张文娟 康颂建
(1.泰山医学院生理学教研室,山东 泰安 271000; 2.泰山医学院附属泰山医院,山东 泰安 271000)
顺铂(CDDP)是一种临床上常用的广谱化疗药物,因为较严重的耳毒性,在一定程度上限制了其临床应用。研究表明顺铂主要通过损伤耳蜗毛细胞、螺旋神经节及血管纹而引起听功能损害;其损伤机制与细胞内自由基增多、能量代谢障碍及凋亡密切相关[1-2]。川芎嗪是中药川芎的有效成分,具有活血化瘀,改善微循环,增加耳蜗血流的作用,还有清除自由基减轻生物膜脂质过氧化作用,而且最近发现它还有对抗细胞凋亡的作用。临床上已用于突发性耳聋等疾病的治疗[3-4]。本研究拟观察川芎嗪是否对顺铂耳毒性具有保护作用,并初步探讨其作用机制。
1 材料与方法
1.1实验动物 成熟健康、耳廓反射灵敏、无中耳疾患的豚鼠30只,体重250~400 g,雌雄不拘;由山东省米歇尔生物制品公司提供。
1.2主要试剂与仪器 顺铂冻干粉(齐鲁制药厂,批号20060408);盐酸川芎嗪注射液(北京市永康药业有限公司,批号 04040501);TUNEL测定试剂盒(北京中杉金桥生物技术有限公司)。实验器材:YJC-A型诱发电位仪(泰安市高新医疗器械厂);解剖显微镜。
1.3动物分组及用药 豚鼠随机分为三组,每组10只。对照组:生理盐水3 ml/(kg·d)腹腔注射6天;顺铂组:顺铂3 mg/(kg·d) 腹腔注射6天;顺铂加川芎嗪组(中药组):先腹腔注射川芎嗪140 mg/(kg·d)3天,从第4天起腹腔注射川芎嗪140 mg/(kg·d)30 min后对侧腹腔注射顺铂3 mg/(kg·d)6天。
1.4听觉脑干诱发电位(ABR)检测 所有动物在给药前和处死前各测一次ABR,测试在隔音屏蔽室内进行。将豚鼠固定后安插针式电极,记录电极置于颅顶,参考电极和接地电极分别置于同侧和对侧乳突部,采用YJC-A型诱发电位仪进行检测。采用短声刺激,频率10次/s,生源距耳1 cm,放大器通频带为80~3 kHz,增益4000倍,叠加200次,以波群中III波消失或IV波刚出现时的短声刺激强度的dB值为反应阈值。记录各组动物ABR阈值及波I潜伏期变化情况。以IV波刚出现时的短声刺激强度的dB值为反应阈值。
1.5耳蜗基底膜铺片及琥珀酸脱氢酶(SDH)染色 每组动物于末次听力检测结束后,取半数动物耳蜗采用硝基蓝四氮盐法进行SDH染色[5]:动物麻醉后迅速断头取出双侧听泡,打开听泡,用细针在蜗尖钻孔,开放圆窗和卵圆窗,用吸管吸取硝基四氮唑蓝(NBT)配制的SDH作用液,从蜗尖小孔处缓慢灌注2~3次,再将耳蜗浸入作用液中于37℃温箱内孵育1~2 h,取出标本后用双蒸水灌洗2~3次,再用10%的甲醛溶液自蜗顶灌流3次,将标本浸入10%中性甲醛溶液中固定24 h。标本固定好后在解剖显微镜下剥去蜗壳,剥离基底膜并放置于滴有甘油的载波片中,中性树胶封片。光镜下观察毛细胞形态及SDH变化。
1.6耳蜗石蜡切片制备 每组动物中半数在最后一次测试完ABR后,立即断头处死,快速取出听泡,暴露耳蜗,用针尖在蜗尖钻孔,打开卵圆窗及圆窗,吸管吸取4%多聚甲醛从蜗尖小孔灌入耳蜗,每个标本灌流4~5次,然后将标本浸入固定液中过夜。固定好的听泡浸入10%EDTA溶液中,室温下脱钙2周,以骨质软化为 准,脱钙液每日更换1次。常规梯度酒精脱水,二甲苯透明,低熔点石蜡包埋,平行与蜗轴方向进行连续切片,片厚5 μm左右。
1.7凋亡细胞的原位检测 采用TUNEL法。选取HE染色较好的能显示螺旋神经节及Corti氏器的石蜡切片进行TUNEL原位标记。将石蜡切片常规脱蜡入水,进行凋亡细胞的原位检测,操作步骤严格按照试剂盒说明书进行。切片于400倍光镜下观测,细胞核中有棕黄色颗粒者为凋亡阳性细胞。

2 结 果
2.1ABR检测 各组动物用药前后ABR阈值及Ⅰ波潜伏期见表1,2。对照组用药前后ABR阈值及Ⅰ波潜伏期差异无统计学意义(P>0.05);顺铂组用药后Ⅰ波潜伏期、ABR阈值较用药前明显升高,自身前后对照,差别有统计学意义(P<0.05),说明顺铂造成了明显的耳蜗毒性,动物模型制作成功;顺铂加川芎嗪组用药后Ⅰ波潜伏期、ABR阈值与顺铂组相比较差别具有统计学意义(P<0.05)。

表1 三组动物ABR阈值变化情况
注:与对照组比较,★P<0.01;与顺铂组比较,*P<0.01;与对照组比较,△P<0.05。
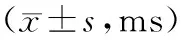
表2 三组动物ABRN1波潜伏期变化情况
注:与对照组比较,★P<0.01;与顺铂组比较,*P<0.05。
2.2耳蜗基底膜铺片及琥珀酸脱氢酶(SDH)染色 光镜下观察耳蜗底回基底膜铺片情况:正常豚鼠耳蜗基底膜铺片毛细胞SDH染色呈深紫蓝色,显色分布均匀,毛细胞排列整齐,各回均有排列整齐的3排外毛细胞和1排内毛细胞,毛细胞自然损失率极少,显示SDH活性正常(图1);顺铂组豚鼠耳蜗毛细胞SDH可见明显的染色变淡或消失,毛细胞的SDH活性受到抑制,尤以外毛细胞明显而内毛细胞变化较轻,外毛细胞明显受损(图2);中药组毛细胞损伤及SDH变化明显轻于顺铂组(图3)。

图1 对照组耳蜗基底膜SDH染色铺片(×400)(IHC为外毛细胞,OHC为内毛细胞)

图2 顺铂组耳蜗毛细胞琥珀酸脱氢酶染色铺片(×400)

图3中药组耳蜗毛细胞琥珀酸脱氢酶染色铺片(×400)
2.3毛细胞TUNEL检测
光镜下观察,对照组中,很少发现阳性细胞,仅偶尔见底回螺旋神经节和Corti氏器有个别阳性细胞出现(图4);顺铂组各回均出现被染成棕黄色的阳性细胞,以底回Corti氏器中最多,第二回其次,三四回较少(图5);毛细胞排列紊乱,有缺失;中药组底回Corti氏器中毛细胞排列规则,无缺失;也有TUNEL阳性毛细胞出现,但数量与顺铂组比较明显较少(图6)。
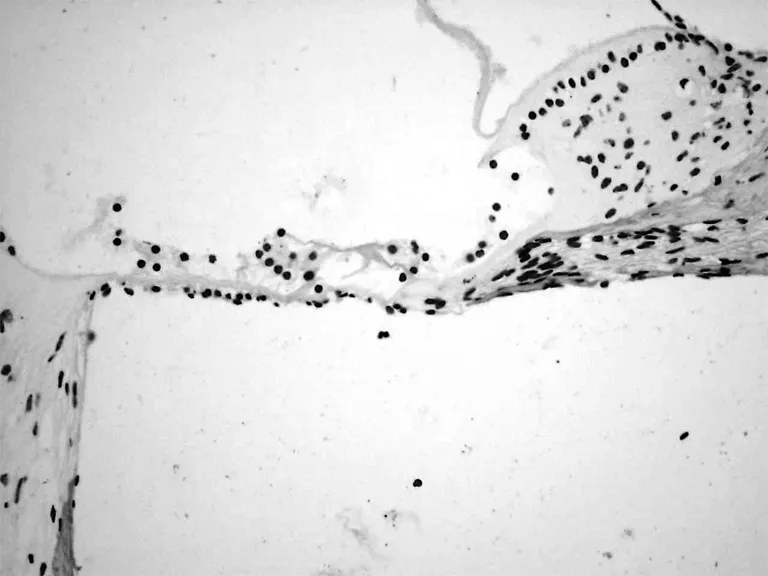
图4 对照组耳蜗底回Corti器TUNEL染色(×400)

图5 顺铂组耳蜗底回Corti器TUNEL染色(×400)(箭头所指即TUNEL阳性细胞)

图6 中药组耳蜗底回Corti器TUNEL染色(×400)
3 讨 论
顺铂是临床上常用的广谱抗肿瘤药物之一,普遍用于头颈部及泌尿生殖系统恶性肿瘤的治疗;因其具有严重的耳毒性、肾毒性等副作用,致使其临床应用受到一定的限制。因此减轻顺铂的副作用特别是其耳、肾毒性一直是国内外学者研究的热点。目前临床上对使用顺铂的肿瘤患者通过水化及同时给予药物利尿等措施已可以大大减轻顺铂的肾毒性,故对顺铂耳毒性的防治研究已成为一亟需解决的课题,具有重要的临床意义。
顺铂耳毒性主要表现为耳鸣和耳聋,二者可同时或单独出现。耳鸣的发生率约为2%~36%,耳聋的发生率约为7%~91%。耳聋通常为双侧,以高频听力损害最为明显,随着用药剂量的增加,听力损失会逐渐向低频区发展并可波及语言频率,症状轻者停药后可恢复,重者听力永久丧失[6]。本实验结果显示顺铂组用药后ABR反应阈值及I波潜伏期明显延长,高频区听力受损,证实顺铂耳毒性模型制备成功;耳蜗铺片显示应用顺铂后毛细胞受到损伤,且越靠近底回毛细胞受损越严重,表现为毛细胞紊乱、倒伏、缺失,其中外毛细胞较内毛细胞损伤较早且严重,与文献报道一致,说明毛细胞是顺铂耳毒性的主要靶细胞之一[7]。实验中顺铂加川芎嗪组ABR阈值虽有升高但明显轻于顺铂组,耳蜗铺片显示毛细胞损伤也明显轻于顺铂组,说明川芎嗪能有效的保护耳蜗毛细胞形态及功能,减轻顺铂所致的听觉损害。
目前,关于顺铂耳毒性的机制有很多学说,其中自由基增多导致的氧化应激损伤学说及细胞凋亡学说已被大多数人认同[7]。本实验通过TUNEL检测显示顺铂组豚鼠耳蜗内凋亡的毛细胞数量明显增多,证实凋亡参与了顺铂的耳毒性过程。毛细胞SDH染色结果显示顺铂组SDH明显减弱,SDH是细胞线粒体的标志酶,提示顺铂可以导致毛细胞能量代谢障碍,从而进一步引起毛细胞损伤[8]。由于顺铂耳毒性的确切机制目前仍不明确,因此临床上还没有一种方法能有效的对抗顺铂耳毒性。近年来,我国传统医药有了较快发展,研究发现活血化瘀类药物具有丰富的药理作用。川芎嗪是常用的活血化瘀类中药之一,研究表明其具有活血化瘀、清除自由基、抗氧化等多种药理学作用,并且已经用于听觉疾病的治疗[9]。本实验结果显示应用川芎嗪后SDH染色变化较小,毛细胞凋亡数量明显少于顺铂组,进一步说明川芎嗪能够保护顺铂所致的耳蜗损伤。其具体机制可能与以下几个方面有关:①川芎嗪能改善顺铂中毒耳蜗血管纹的微循环状况,减轻CDDP对血管纹的损伤;使听神经正常活动所需的内耳内环境能保持相对恒定。②川芎嗪还能有效清除自由基,减轻自由基对耳蜗内生物膜的脂质过氧化损伤,使耳蜗内毛细胞膜以及细胞内线粒体膜和溶酶体膜免遭破坏,保护了SDH活性,使毛细胞代谢功能和形态基本正常。③川芎嗪可以通过对抗毛细胞的凋亡保护耳蜗毛细胞的形态及功能。
[1] Pirvola U, Xing-Qun L, Virkkala J, et al. Rescue of hearing auditory hair cells and neurons by CEP-1347/KT7515 an inhibitor of c-jun N-ternimal kinase activation[J].Neurosci, 2000,20(1):43-50.
[2] Simon T,Hero B,Dupuis W,et al.The incidence of hearing impairment after successful treatment of neuroblastoma[J]. Klin padiatr, 2002,21(4):149-52.
[3] 刘公汉,吴展元,杨强,等. 中药川芎嗪治疗72例突发性聋的临床分析[J]. 中国中西医结合耳鼻咽喉科杂志,1997,5(1):17-18.
[4] 符文双,倪月秋,汤浩.川芎嗪注射液对正常豚鼠耳蜗影响的实验观察[J]. 中华临床医药杂志,2002,3(6):20-21.
[5] 丁大连,姜泗长.豚鼠内耳解剖实验技术手册[M].南京:南京铁道医学院出版社,1989:4611.
[6] Marco-Algarra J.Cis-diamminedichloro platinum ototoxicity:an experimental study[J].Acta Otolarungol,1985,99:343.
[7] 丁大连,亓卫东,张梅,等.顺铂及其耳毒性[J].中华耳科学杂志,2008,6(2):125-133.
[8] 张雪梅,史献君,孙宪昌,等. 黄芪注射液对庆大霉素耳中毒豚鼠耳蜗内琥珀酸脱氢酶的影响[J].中成药,2008,30(9): 2-3.
[9] 张兆辉,余绍祖,王镇涛,等.四甲基吡嗪对活性氧自由基的清除作用[J].中国药理学报,1994,15(3):229-231.
