气相色谱-质谱法同时测定食醋中多种多元醇*
2010-01-13郑彦婕黎永乐张协光李碧芳
郑彦婕,黎永乐,张协光,李碧芳
(深圳市计量质量检测研究院,广东深圳,518000)
多元醇又称糖醇,是醛糖或酮糖的羰基被还原成羟基的衍生物。一部分多元醇广泛存在于植物以及微生物体内,存在的形式有游离状态、化合状态,例如甘露醇、山梨醇、木糖醇等。发酵制品中多元醇的来源比较复杂,有部分学者认为酒中的阿拉伯糖醇、木糖醇、甘露醇是在微生物发酵的过程中形成,也学者提出甘露醇主要是果糖经微生物还原而成。发酵制品中多元醇的种类及含量是反映原材料、微生物环境与成品质量的重要指标。不同原料采用不同的微生物发酵会得到不同的多元醇[1]。食醋中多元醇如赤藓糖醇、阿拉伯糖醇、甘露醇等,是食醋甜味来源之一,对醋的风味产生了极大的影响。Antonelli等[2]分析了100多个醋样品发现,通过分析多元醇的含量可将苹果醋与酒醋进行区分,其中苹果醋中山梨醇含量高,而酒醋中各种多元醇含量都较低,由此提出了通过多元醇含量的测定对醋进行分类的方法。
多元醇的测定方法有气相色谱法(GC)和高效液相色谱法(HPLC)[3-4],但是用 HPLC 测定多元醇时,供选择的检测器非常有限,示差折光检测器(RI)灵敏度低,并且不能进行梯度淋洗,达不到良好的分离效果。采用气相色谱法则需要对样品中的多元醇进行衍生[5-7],衍生化的方法主有硅烷化、乙酰化法等。
由于食醋中各种有机酸、氨基酸、糖类含量较高,给食醋中多元醇的准确测定带来较大的干扰,本文通过研究食醋中多元醇的前处理与分析方法,并采用该方法对不同的食醋进行分析,拟找出不同食醋中多元醇含量的差异。
1 实验部分
1.1 仪器及试剂
TraceGC-DSQ(Thermo公司,美国);RotoFix 32A型离心机(Laboroto公司,德国);4003型旋转蒸发仪(Laboroto公司,德国);DHG-9203A型电热恒温鼓风干燥箱(上海一恒科技有限公司)。
赤藓糖醇标准品:纯度≥99%,Acros公司。阿拉伯糖醇标准品:纯度≥99.0%,Fluka公司。木糖醇标准品:纯度≥99.0%,Fluka公司。肌醇标准品:纯度≥98%,Acros公司。甘露醇标准品:纯度≥99.5%,Fluka公司。山梨醇标准品:纯度≥99.5%,Fluka公司。其他试剂为分析纯。
1.2 样品的制备
1.2.1 样品的提取
称取1.000 g样品,置10 mL比色管中,加8 mL乙腈,用水定容到10 mL。摇匀振荡,转移到15 mL离心管中,4 000 r/min离心5 min,取上清液1~5 mL旋转蒸发至近干,105℃烘干。
1.2.2 样品的衍生
取1 mL吡啶,0.1 g盐酸羟胺,加入蒸馏瓶中,塞上瓶塞,90℃肟化0.5 h。取1 mL乙酸酐加入肟化后产物中,135℃下反应1.5 h。取出蒸馏瓶,放至室温,加5 mL水,10 mL三氯甲烷,涡漩混合30 s,使两相分离。取有机相,加少量无水Na2SO4振摇,放置15 min以上,将有机相过滤后上机。
1.2.3 空白样的制备
量取乙腈-水(体积比8∶2)5 mL于蒸馏瓶中,旋干,于105℃烘干,其余按1.2.2操作,作为定性考察。
1.2.4 标准工作曲线绘制
采用去离子水配制赤藻糖醇、阿拉伯糖醇、木糖醇、肌醇、甘露醇、山梨醇浓度为1 000 mg/L混合标准溶液,使用时用去离子水逐级稀释至不同浓度的标准溶液。
取浓度分别为 0.1、1.0、5.0、50.0、100.0、200.0 mg/L的标准溶液1 mL,于蒸馏瓶中,旋干,于105℃烘干,其余按1.2.2操作。
1.3 样品的测定
1.3.1 色谱条件
色谱柱:DB-35 ms柱,30m ×0.25 mm ×0.25μm;进样口温度:250℃;传输线温度:240℃;程序温度:70℃保持1 min,以10℃/min速度升至190℃,接着以5℃/min的速度升至210℃,最后以3℃/min的速度升至220℃并保持5 min,再以15℃/min的速度升至250℃并保持2 min;载气:氦气,恒流,1.0 mL/min;不分流进样,进样体积1 μL。
1.3.2 质谱参数
电离模式:电子轰击源(EI),能量为70eV;离子源温度为 280℃;分析器(电子倍增器)电压为1427V;溶剂延迟为8 min;扫描方式:采用快速全扫描与选择离子扫描相结合的方式;全扫描范围为m/z 50 ~300;选择特征离子为 m/z 115,145,187。
1.3.3 测定
由于多元醇衍生化反应产物的大部分质谱碎片相似,试验采用快速全扫描(TIC)辅助定性,以m/z 115为定量离子,外标法定量。以标准溶液的响应峰面积为纵坐标,浓度为横坐标,绘制标准曲线或计算回归方程。依据测定的待测样品的峰面积,在标准曲线上查出(或通过回归方程计算)样品中各多元醇的含量。
2 结果与讨论
2.1 样品处理条件的选择及优化
多元醇极性大、沸点高,必须通过衍生化才能用气相色谱进行分析。乙酰化都是通过一些极性相对较弱的基团把目标物的羟基“封装”起来以降低目标物分子间氢键,以达到降低目标物沸点的目的,反应方程式如下:
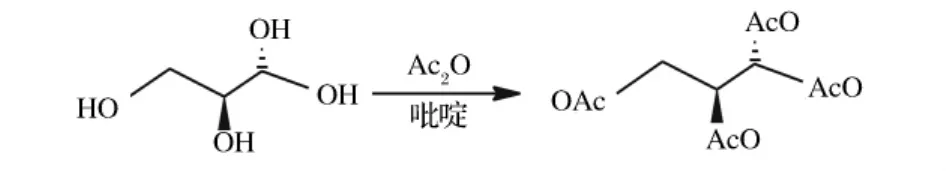
食醋中糖的含量较高,在高温下葡萄糖发生缩醛、分子内或分子间的羟醛缩合反应,对肌醇、甘露醇、山梨醇的测定产生干扰。另外由于陈醋中各种有机酸、糖类、氨基酸含量较高,如果直接对样品进行乙酰化,基体干扰大。因此,在样品前处理过程中采用乙腈提取样品,降低提取液中糖类、有机酸、氨基酸的含量,并通过盐酸羟胺先将萄糖中的醛基肟化,降低由糖类发生缩聚反应产生的背景干扰。标准样品、样品选择离子流图见图1,经过过肟化后葡萄糖产生的峰保留时间在17.2 min左右,对6种多元醇的测定均未产生影响。

图1 样品与标准样品中6种糖醇选择离子流色谱图
2.2 方法的检出限、回收率和线性范围
在优化的实验条件下,对不同浓度的标准样品进行分析,方法的工作曲线、线性范围、检出限见表1。

表1 方法的线性方程,相关系数与检出限
对5份不同的样品进行测定后,按样品中多元醇含量接近1∶1加入标准溶液进行回收率实验,样品测定值、加标量、回收率见表2。以实验步骤1.2.1中取上清液1 mL计,由表1、表2可见,方法的线性范围在1.0~1 000 mg/L之间,方法检出限为0.20 mg/L,回收率在 93% ~105%,相对标准偏差在10.8%以下,满足分析方法的要求。

表2 方法的回收率和精密度
2.3 实际样品的测定
本研究中对3种获得地理标志保护的产品进行分析(镇江陈醋、镇江香醋、山西老陈醋),每种样品各选取了3不同生产产家,同时对比了白醋与普通陈醋中6种糖醇的含量,其结果见表3。

表3 不同醋的多元醇含量
由表3可以看出,山西老陈醋中赤藓糖醇的含量比较高,镇江香(陈)醋中肌醇、甘露醇的含量较高,而白醋中多元醇的含量极低,这主要和生产食醋的原料、生产工艺有关。赤藓糖醇属于四元糖醇,其来源主要有3个方面:(1)由原料直接带入;(2)发酵的微生物降解产生;(3)微生物发酵过程中有其他糖醇降解产生。山西老陈醋的具有原料多样性的特点,原料包括高粱、麸皮、大麦、豌豆等,其中大曲与原粮的配料比高达55% ~62.5%,且微生物的物种丰富[8],这可能与赤藓糖醇的产生有极大的关系;肌醇、甘露醇均属于六元醇,肌醇主要来源于原料与微生物,而甘露醇可能是果糖经微生物还原的产物。镇江香醋与镇江陈醋的工艺基本相同,两者的区别只在陈酿时间的不同,其主要原料均是糯米,主要的微生物有乳酸菌和醋酸菌[9],这与山梨醇的含量有可能相关;白醋的原料比较单一,主要为糯米或大米,测试结果表明其6种多元醇的含量极低;2个普通的陈醋中多元醇的含量也明显低于2种地理标志保护产品。
3 展望
由于我国食醋所用的发酵剂主要为前一批次发酵成熟的醋醅或采用天然接种的方式,发酵微生物的主要来源是接种于醋醅中的微生物菌群,会受到生产环境的影响,这与欧美国家深层液态发酵食醋工艺中普遍采用的单一醋酸菌有很大区别,因此对于各种多元醇的产生还需要对各种食醋的微生物种群以及生产工艺做进一步的了解。实验中采集的样品数较少尚不具有代表性,但从实验结果看,多元醇在不同食醋中的含量可能因工艺的不同导致含量各不相同,食醋中多元醇的分析将有助于对食醋品种、产地进行鉴定。在以后的实验中还将采集具有代表性的样品,进一步分析不同产地食醋中多元醇含量的区别。
[1] Santa-Maria G,Olano A,Tejedor M.Quantitative Determination of Polyalcohols in Wine and Vinegar by Gas Chromatography[J].Chromatographia,1985,20(3):197 -200.
[2] Antonelli A,Zeppa G,Gerbi V,et al.Polyalcohols in vinegar as an origin discriminator[J].Food Chemistry,1997,60(3):403 -407.
[3] Lilia Z,Sulivan D,Ellefson W.Determination of“net carbohydrates”using high-performance anion exchange[J].Chromatography,2005,88(3):714 -719.
[4] Hu L,Lu H,Liu Q.Overexpression of mtld gene in transgenic Populus tomentosa improves the salt tolerance through accumulation of mannitol[J].Tree Physiology,2005,25(10):1 273-1 281.
[5] Chen C,Mcginnis G D.The use of 1-methylimidazole as a solvent and catalyst for the preparation of aldononitrile acetates of aldoses[J].Carbohydrate Research,1981,90:127-130.
[6] 李铁林.吴昌贤.张燕霞.糖和糖醇的气相色谱分析研究[J].分析化学,1981,10(5):272-276.
[7] Kim J S,Laskowich E R,Arumuchan R G.Determination of saccharide content in pneumococcal polysaccharides and conjugate vaccines by GC-MS[J].Anal Biochem,2005,347(2):262-274.
[8] 王元太.关于山西食醋工艺的调研与分析[J].中国酿造,1999(3):7-11.
[9] 许伟,张晓君,许泓瑜,等.镇江香醋醋酸发酵过程中细菌群落组成分析[J].微生物学通报,2007,34(4):646-649.
