查尔酮参与的不对称Michael加成反应研究进展
2010-01-08江银枝
江银枝,周 俊
(浙江理工大学化学系,浙江杭州310018)
查尔酮参与的不对称Michael加成反应研究进展
江银枝*,周 俊
(浙江理工大学化学系,浙江杭州310018)
综述了近十年来,金鸡纳碱、硫脲、手性离子液体、季铵盐、脯氨酸和葡萄糖类衍生物等有机小分子在催化查尔酮的不对称Michael加成反应中的应用.有机小分子催化的机理大部分都是通过氢键、离子键等与底物相互作用而使其有较好的对映选择性.
有机小分子;查尔酮;不对称Michael加成
查尔酮是黄酮类化合物的一种,具有抗炎症、杀菌、除草等功效,因此对查尔酮的研究成为医药、食品等领域的一个重要课题.大多数药物都具有手性,且构型的不同可能表现出不同的药理活性,故对手性的控制意义显得尤为突出.近年来,不对称催化已经成为合成手性分子的一个重要手段.发展得较早的是手性配体与稀土或过渡金属联合催化,但是由于金属离子的引入使得后处理时残余的金属不容易除去,不利于在制药领域的工业化生产.
有机小分子催化因其不含金属、非常稳定、价廉易得、无毒性、易于回收等,在近几十年来越来越受到人们的关注,并取得了迅猛的发展.有机小分子通过与亲核或亲电试剂形成氢键、离子键或共价键,起到催化剂和手性试剂的作用[1].Michael加成是有机合成中构建C-C键的重要反应之一,因此一直是有机合成化学家感兴趣的研究课题[2].本文作者就近十年来查尔酮参与的不对称Michael加成反应中使用的有机小分子催化剂进行了综述.
1 有机小分子催化剂研究进展
1.1 金鸡纳碱
1981年,Wynberg等首次将天然的金鸡纳碱应用于Michael加成[3](Scheme 1).自从Corey等[4]成功地将金鸡纳碱用于不对称双羟基化反应以来,其在不对称合成中的应用越来越受到重视.
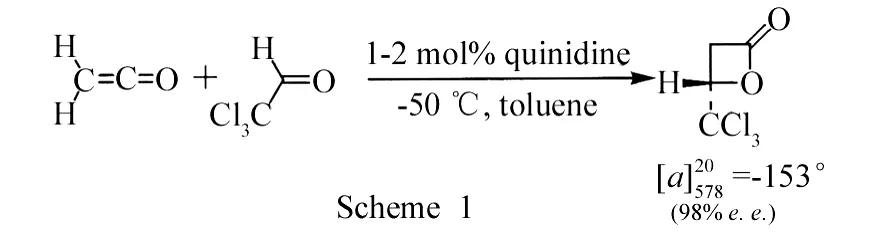
2006年,Li等[5]分别以金鸡纳碱化合物1、2、3催化查尔酮与硫代酸的Michael加成反应,产率>91%,但e e值几乎为零.2007年,Gu等[6]利用金鸡纳碱化合物4催化α-氰基乙酸乙酯与查尔酮的Michael加成反应,产率为78%,e e值为72%.2008年,Deng等[7]分别将金鸡纳碱化合物5、6、7应用于丙二氰与查尔酮的不对称Michael加成中,发现化合物5在DCM和TFA中催化的产率为93%,e e值为95%,发现化合物5可以作为双功能催化剂.2009年Xie等[8]也报道了类似的反应.
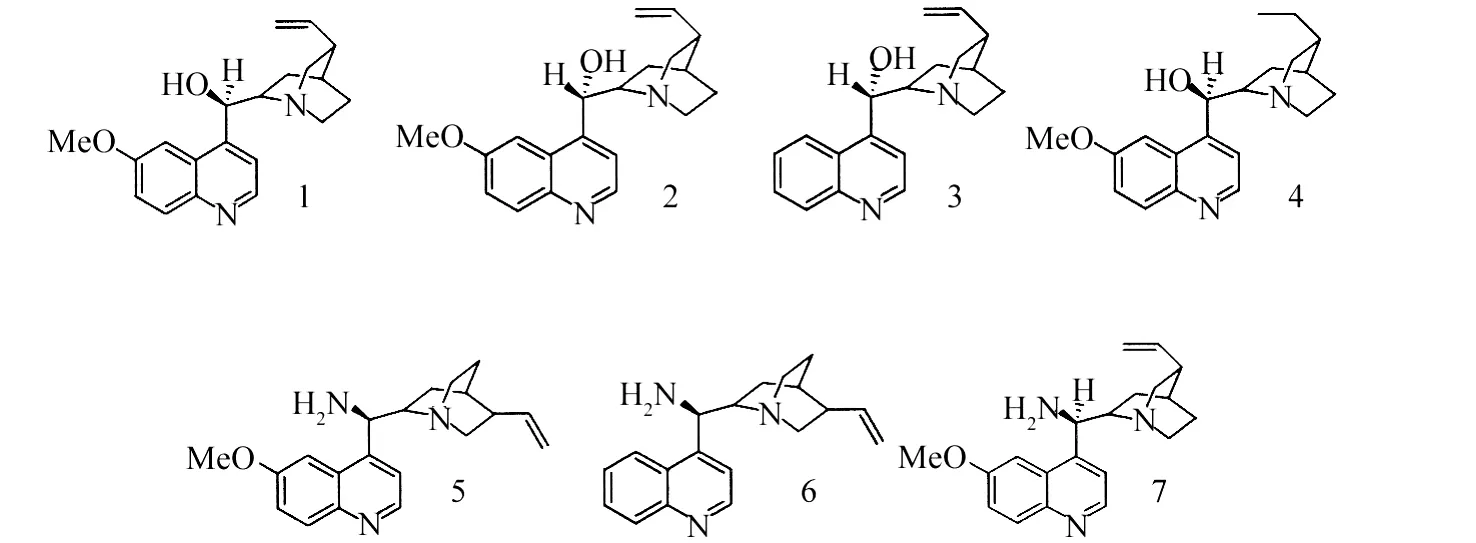
Wang等[9]分别以金鸡纳碱化合物2、7催化2(5H)-呋喃酮与查尔酮的不对称Michael加成反应,e e值分别为60%和68%.Wang等[10]首次以苯并三唑为亲核试剂对查尔酮进行不对称Michael加成,考察了查尔酮上不同取代基对产率和e e值的影响.
此外,Scettri等[11]首次在无溶剂条件下利用化合物1、2、3、7、8、9催化苯胺与查尔酮的不对称Michael加成,但e e值普遍不高.

1.2 手性硫脲
2005年,Tibor等[12-13]分别以化合物 10、11催化硝基甲烷与查尔酮的不对称 Michael加成反应(Scheme 2),发现化合物10a、10b、11a手性诱导效果较好,e e值为89%~98%.
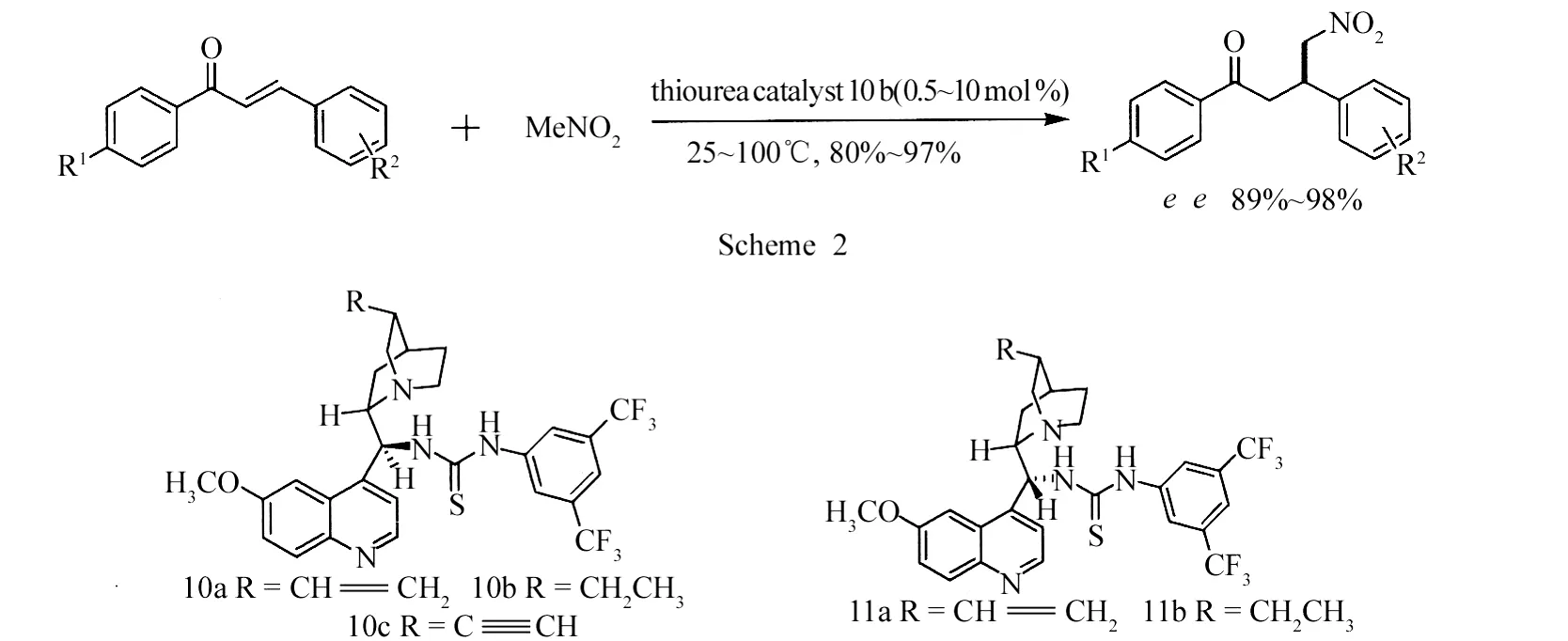
2006年,Wang等[14]研究了10a、12、13催化硫代酸与查尔酮的不对称加成,e e值为33%~65%.2007年,Gu等[6]使用了三种硫脲化合物10b、14、15催化α-氰基乙酸乙酯与查尔酮的不对称Michael加成反应.
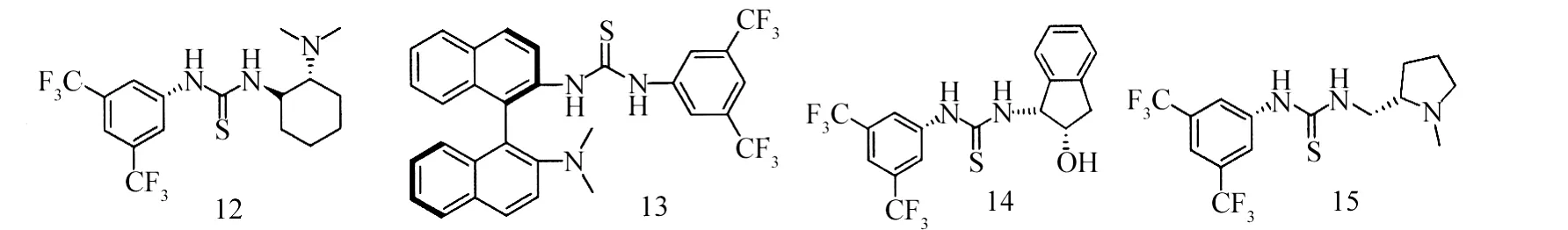
Biddle等[15]利用硫脲化合物10a、12、16催化查尔酮合成了手性黄酮(Scheme 3).e e高达92%.
最近,匈牙利学者Pham等[16]使用10a、10b催化氰甲基亚磷酸二乙酯与查尔酮的不对称共轭加成时,发现在含氧原子的溶剂中,由于氧的存在阻碍了过渡态中氢键的形成,从而导致使用此类溶剂时产物的e e值很低.2010年,Wang等[9]考察了化合物17a、17b、17c、17d催化2(5H)-呋喃酮对查尔酮的不对称 Michael加成反应,发现17b由于三氟甲基的引入使得胺基的酸性和形成氢键的能力加强,其产物e e值为77%,但产率低;同时发现LiOAc和γ-丁烯羟酸内酯的加入,使得产率达到92%,且e e值不变.

1.3 手性离子液体
2005年,Wang等[17]利用手性离子液体18、19、20、21、22、23催化丙二酸二乙酯与查尔酮的不对称Michael加成反应(Scheme 4).发现21的催化活性较22高,产率≥90%,e e为10%~25%.
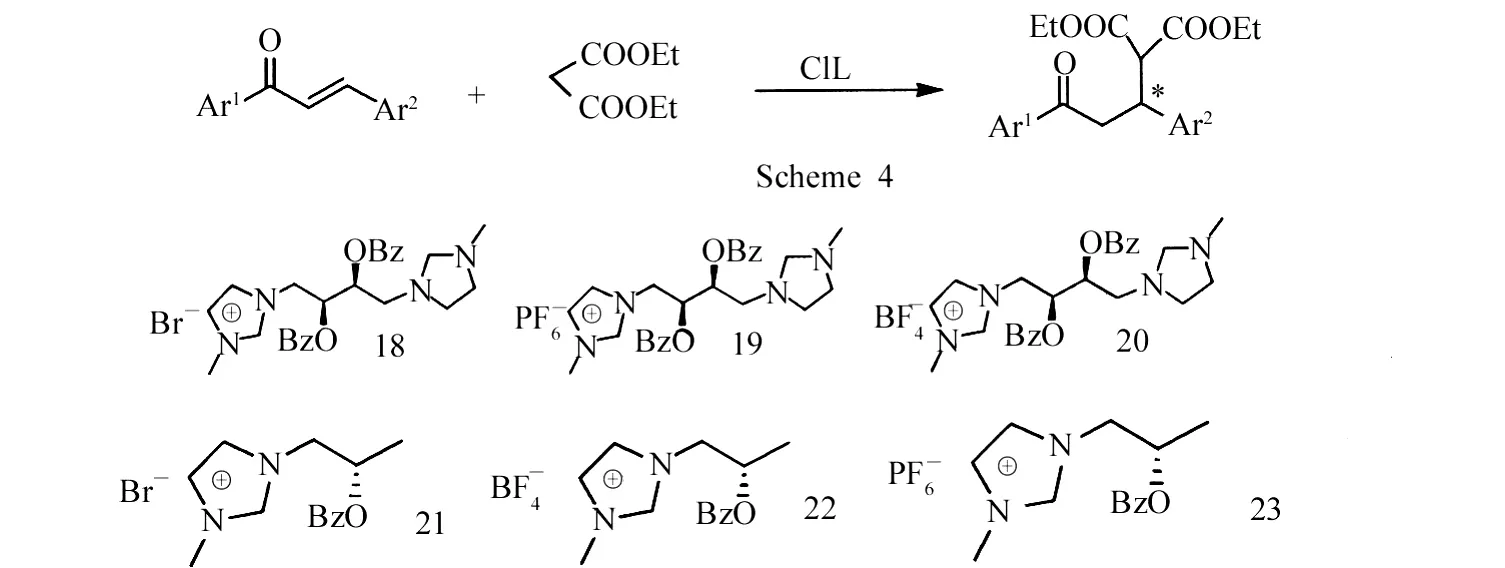
Wang等[18]使用离子液体24催化查尔酮与环己酮的不对称Michael加成反应,发现通过改变溶剂,产物构型可发生翻转.
1.4 季铵盐
2000年,Corey等[19]使用25有效地催化了苯乙酮和查尔酮的不对称加成反应(Scheme 5).

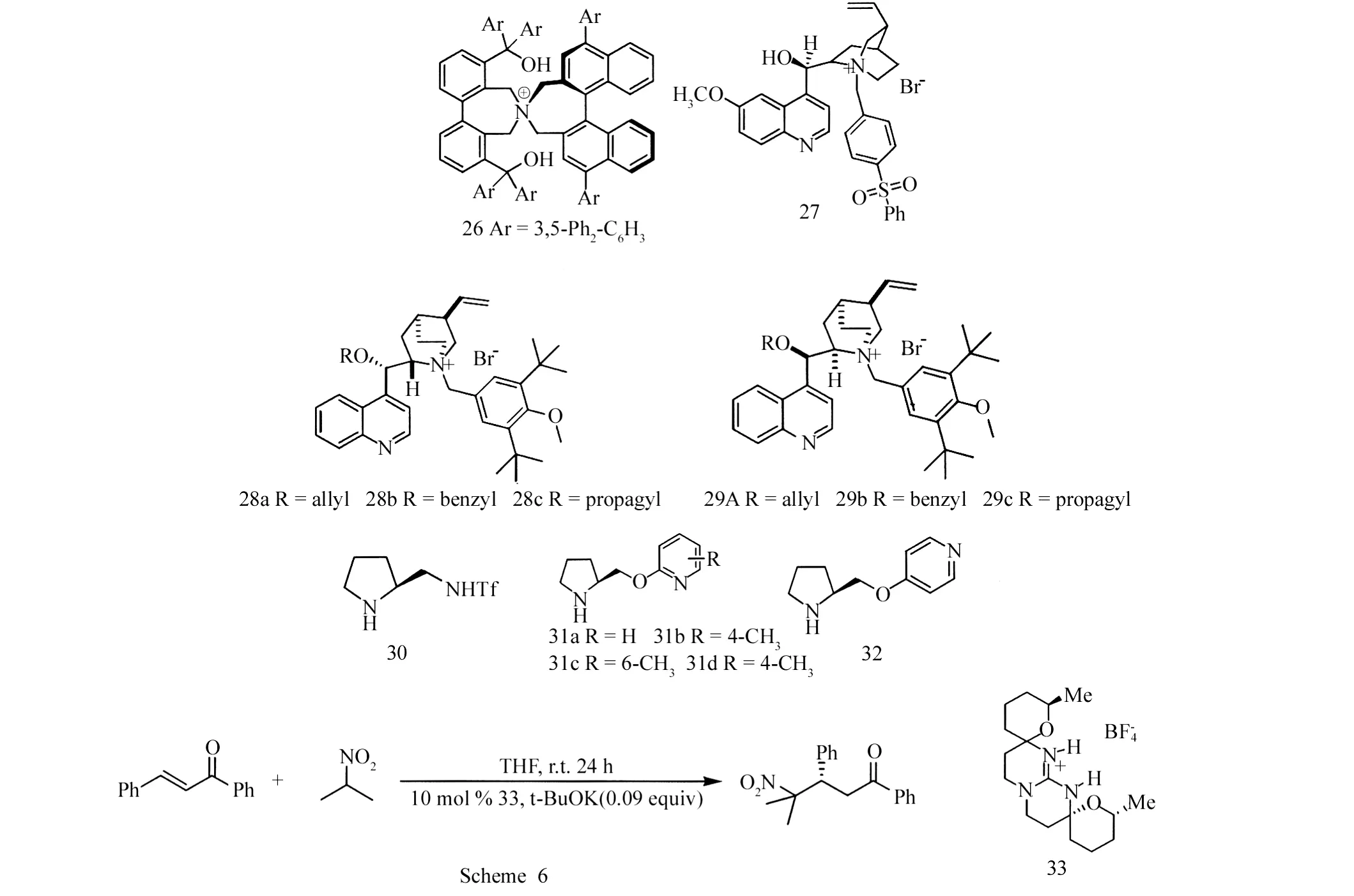
Ooi等[20]与Dere等[21]使用化合物26、27催化丙二酸二乙酯与查尔酮的Michael加成反应,发现产率高达94%~99%.化合物26的产物手性选择性较好,e e值可达85%~94%.2006年,Cho等[22]研究了化合物28、29催化的丙二酸二酯与查尔酮的不对称Michael加成反应,发现28a的产物手性选择性较好,e e为45%~70%.
1.5 脯氨酸
Wang等[23]和Xu等[24]研究了化合物30、31、32催化环酮与查尔酮的不对称加成,发现e e值为73%~100%.
2007年,Kumar等[25]使用L-脯氨酸催化了硫醇(酚)与查尔酮的不对称Michael加成,产率为80%~98%,但e e值 ≤39%.
除了上述五类化合物作为查尔酮参与的Michael不对称加成催化剂外,Suresh与 Torke等[26-29]研究了葡萄糖类化合物催化硝基烷烃与查尔酮的不对称Michael加成反应.产率为90%~100%,e e值为58%~65%.Allingham等[30]使用化合物33催化2-硝基丙烷对查尔酮的不对称Michael加成(Scheme 6),产率为70%,e e值为23%.
2 总结与展望
由于查尔酮在医药领域的应用,对其手性衍生物的研究具有重要的意义.其参与的不对称Michael加成反应是通过引入C-C键、C-N键及C-O键合成新的手性化合物或杂环化合物的重要方法,这其中有机小分子催化剂的研究显得十分重要.
[1]Almasi D,Alonso D A,Najera C.Organocatalytic asymmetric conjugate additions[J].Tetrahedron:Asymmetry,2007,18:299-365.
[2]李宁,郗国宏,吴秋华,等.有机催化不对称 Michael加成反应[J].有机化学,2009,29:1018-1038.
[3]Hiemstra H,Wynberg H.Asymmetric synthesis of(S)-and(R)-malic acid from ketene and chloral[J].J A m Chem Soc,1981,103:417-423.
[4]Corey E J,Noe M C.Rigid and highly enantioselective catalyst for the dihydroxylation of olefins using osmium tetraoxide clarifies the origin of enantiospecificity[J].J A m Chem Soc,1993,115(26):12579-12580.
[5]Li H,Zuo L S,Wang J,et al.Organocatalytic enantioselective Michael addition of thioacetic acid to enones[J].Tetrahed Lett,2006,47:3145-3148.
[6]Gu C,Liu L,Sui Y,et al.Highly enantioselective Michael additions of a-cyanoacetate with chalcones catalyzed by bifunctional cinchona-derived thiourea organocatalyst[J].Tetrahedron:Asymmetry,2007,18:455-463.
[7]Deng J G,Li X F,Cun L F,et al.Highly enantioselective Michael addition of malononitrile toα,β-unsaturated ketones[J].Org Biomol Chem,2008,6:349-353.
[8]Xie J W,Huang X,Fan L P,et al.Efficient method for the synthesis of optically active 2-amino-2-chromene derivativesviaone-pot tandem reactions[J].A dv S ynth Catal,2009,351:3077-3082.
[9]Zhang Y N,Yu C G,Wang W,et al.Diastereo-and enantioselective organocatalytic direct conjugate addition ofγ-butenolide to chalcones[J].Chem Asian J,2010,3:971-979.
[10]Li J,Wu H,Wang Y M.Organocatalytic enantioselective aza-Michael additions of N-heterocycles toα,β-unsaturated enones[J].Eur J Org Chem,2010:2073-2083.
[11]Scettri A,Massa A,Palombi L,et al.Organocatalytic asymmetric aza-Michael addition of aniline to chalcones under solvent-free conditions[J].Tetrahedron:Asymmetry,2008,19:2149-2152.
[12]Vakulya B,Varga S,Tibor Soos,et al.Highly enantioselective conjugate addition of nitromethane to chalcones using bifunctional cinchona organocatalysts[J].Org Lett,2005,10:1967-1969.
[13]Vakulya B,Varga S,Tibor Soos.Epi-cinchona based thiourea organocatalyst family as an efficient asymmetric Michael addition promoter:Enantioselective conjugate addition of nitroalkanes to chalcones andα,β-unsaturated N-acylpyrroles[J].J Org Chem,2008,73:3475-3481.
[14]Wang J,Li H,Wang W,et al.Organocatalytic enantioselective conjugate additions to enones[J].J A m Chem Soc,2006,128:12652-12653.
[15]Biddle M,Lin M,Scheidt K,et al.Catalytic enantioselective synthesis of flavanones and chromanones[J].J A m Chem Soc,2007,129:3830-3831.
[16]Pham T S,Balázs L,Petneházy I,et al.Enantioselective Michael addition of diethyl cyanomethylphosphonate to chalcones using bifunctional cinchona-derived organocatalysts:synthesis of chiral precursors ofα-substitutedβ-aminophosphonates[J].Tetrahedron:Asymmetry,2010,21:346-351.
[17]Wang Z M,Wang Q M,Zhang Y,et al.Synthesis of new chiral ionic liquids from natural acids and their applications in enantioselective Michael addition[J].Tetrahed Lett,2005,46:4657-4660.
[18]Qian YB,Xiao S Y,Wang Y M,et al.A mild and efficient procedure for asymmetric Michael additions of cyclohexanone to chalcones catalyzed by an amino acid ionic liquid[J].Tetrahedron:Asymmetry,2008,19:1515-1518.
[19]Corey E J,Zhang F Y.Highly enantioselective Michael reactions catalyzed by a chiral quaternary ammonium salt.Illustration by asymmetric syntheses of(S)-ornithine and chiral 2-cyclohexenones[J].Org Lett,2000(2):1097-1100.
[20]Ooi T,Ohara D,Fukumoto K,et al.Importance of chiral phase-transfer catalysts with dual functions in obtaining high enantioselectivity in the Michael reaction of malonates and chalcone derivatives[J].Org Lett,2005,7:3195-3197.
[21]Dere R T,Pal R R,Patil P S,et al.Influence of ionic liquids on the phase transfer-catalysed enantioselective Michael reaction[J].Tetrahed Lett,2003,44:5351-5353.
[22]Cho M J,Cho M G,Kim D Y,et al.Asymmetric Michael reaction of malonate derivatives withα,β-unsaturated ketones using chiral quaternary ammonium salts[J].B ull Korean Chem Soc,2006,27:857-862.
[23]Wang J,Li H,Wang W,et al.Highly enantioselective organocatalytic Michael addition reactions of ketones with chalcones[J].A dv S ynth Catal,2006,348:425-428.
[24]Xu D Z,Shi S,Wang Y M,et al.Pyrrolidine-pyridine base catalysts for the enantioselective Michael addition of ketones to chalcones[J].Tetrahedron,2009,65:9344-9349.
[25]Kumar A,Akanksha.Amino acid catalyzed thio-Michael addition reactions[J].Tetrahedron,2007,63:11086-11092.
[26]Suresh P,Pitchumani K.Per-6-amino-β-cyclodextrin catalyzed asymmetric Michael addition of nitromethane and thiols to chalcones in water[J].Tetrahedron:Asymmetry,2008,19:2037-2044.
[27]Bako P,Torke L.Asymmetric Michael addition of 2-nitropropane to a chalcone catalyzed by chiral crown ethers incorporatingα-D-glucose unit[J].Heteroatom Chem,1997,8:333-338.
[28]Bako T,Bako P,Torke L,et al.Enantioselective Michael reaction of 2-nitropropane with substituted chalcones catalysed by chiral azacrown ethers derived fromα-D-glucose[J].Tetrahedron:Asymmetry,2002,13:203-209.
[29]Bako T,Bako P,Torke L,et al.Enantioselective Michael addition of 2-nitropropane to chalcone analogues catalyzed by chiral azacrown ethers based onα-D-glucose andD-mannitol[J].Tetrahedron:Asymmetry,2003,14:1917-1923.
[30]Allingham M T,Andrew H J,Peter W R,et al.Synthesis and applications of C2-symmetric guanidine bases[J].Tetrahed Lett,2003,44:8677-8680.
Organo-catalyzed Enantioselective Michael Addition to Chalcone
J IANG Yin-zhi*,ZHOU Jun
(Chemistry Department,Zhejiang Sci-Tech University,Hangzhou310018,Zhejiang,China)
Organo-catalyzed asymmetric Michaael addition to chalcone in this decade has been reviewed.The mechanism of the catalysis interaction with the substance may usually be through the hydrogen bond or ionic bond.
organo-catalyst;chalcone;enantioselective Michael addition
O 622.4
A
1008-1011(2010)06-0100-05
2010-07-06.
国家自然科学基金资助项目(20901067);浙江省自然科学基金资助项目(Y4080342).
江银枝(1973-),女,副教授,博士,研究领域:有机化学、配位化学,药物化学.E-mail:jiangyinzhi2003@yahoo.com.cn.
