花生种皮中一种NBS类抗病基因的克隆与序列分析
2009-01-15石运庆陈高孙兵单世华陈静苗华荣胡晓辉
石运庆 陈 高 孙 兵 单世华 陈 静 苗华荣 胡晓辉

摘 要:利用植物抗病基因核苷酸结合位点(NBS)的保守区设计一对特异引物,以抗、感黄曲霉病花生品种J11和金花1012的种皮基因组DNA和RNA为材料进行DNA-PCR和RT-PCR扩增,经克隆、测序,得到一条504 bp的目的片段pnbs1,在GenBank上的登录号为GQ199610。Blast和Blastx分析发现pnbs1核苷酸序列与C8V1G10F 抗性蛋白的核苷酸序列的同源性为89%,与抗性蛋白PLTR的氨基酸序列同源性为59%。该片段的氨基酸序列中含有抗病基因NBS区域的3个保守模体:GPGGVGKTT、KKFFIVLDDVW和STILLTTR,推测pnbs1可能是花生NBS类抗性基因的核心区域。
关键词:花生种皮;NBS类抗病基因;克隆;序列分析
中图分类号:Q785 文献标识号:A 文章编号:1001-4942(2009)12-0001-06
花生(Arachis hypogaea L.)是我国重要的油料作物和经济作物,为我国提供了丰富的花生制品和油脂[1]。虽然我国的花生产业在世界上占有非常重要的地位,总产、单产和出口量均居世界首位,但也面临着诸如黄曲霉毒素污染、青枯病、褐斑病、叶斑病等问题[2,3],严重影响着我国花生产业的可持续发展。通过化学药剂防治植物病害,会带来病原物抗性和环境污染问题,其应用受到越来越多的限制。筛选和培育抗病品种是最经济、有效、安全的防御病害的途径,但传统的抗病育种方法周期长、效率低[4]。利用分子标记、转基因等生物技术可以大大缩短选育抗病品种的时间,提高选育效率。
图位克隆法和转座子标签法为经典的植物抗病基因分离方法,适用于基因组较小的植物(如拟南芥、番茄等),对小麦、大豆、花生等植物则不适合[5]。已克隆的植物抗病基因在氨基酸水平上表现出了一定程度的相似性,在一些区段高度保守,如核苷酸结合位点(nucleotide binding site, NBS)、亮氨酸拉链(leucine zippers, LZ)、富含亮氨酸重复序列(leucine-rich repeats, LRR)、丝氨酸/苏氨酸激酶(serine-threonine kinase, STK)、跨膜结构域(transmembrane domain, TM)及Toll白介素-1区域(Toll-interleukin-1 region, TIR)等。其中以NBS结构域为主,它能够结合ATP或GTP,在植物抗病反应中起重要作用[6,7]。抗病基因的保守性使得同源性克隆成为可能。同源克隆技术是近年来兴起的基因分离技术,目前已应用于植物抗病基因及其同源物的分离,且已利用其从拟南芥、水稻、小麦、大麦、大豆、玉米、甘薯、黄瓜、番茄和香蕉等植物中分离了许多抗病基因同源片段[5~9,11~18]。
花生基因组较复杂且花生栽培种是异源4倍体,遗传背景不清楚,与其它作物相比,花生抗病基因的分离相对滞后,但也已得到了一些抗性基因同源片段。Yuksel等(2005)[22]根据已知的抗病基因保守区设计了4对兼并引物(PLTR、PNTR、PCF、PRGA)和2对特异引物(PCRE、PPTO),利用PLTR引物,获得179个片段,经Blast分析后只有95个片段有完整的开放阅读框, 43个片段含有1个或多个终止密码子。晏立英等(2007)[23]利用已克隆的植物抗病基因的NBS区域设计兼并引物或特异引物,从花生栽培种中花6号幼叶中获得了5条具有连续ORF的抗病基因类似物(Resistance gene analogs, RGAs)序列。本研究根据已知的抗病基因NBS保守区设计一对特异引物,采用同源克隆技术,试图从抗、感黄曲霉病花生品种的种皮中分离出花生抗黄曲霉基因,进而对该基因的组织结构和表达特性进行分析研究,为功能性花生抗病基因的分离和遗传转化奠定基础。
1 材料与方法
1.1 植物材料
抗黄曲霉病花生品种J11和感病品种金花1012种植于日光温室中,在荚果充实期取样,以两品种的种皮作为试验材料。
1.2 试剂
PCR反应所需试剂,各种限制性内切酶,凝胶回收试剂盒等,购自TIANGEN公司和TaKaRa公司。
1.3 方法
1.3.1 花生总DNA和总RNA提取
利用改良的SDS法[21]提取两花生品种的种皮基因组DNA;采用TIANGEN公司的植物RNA提取试剂盒分别提取两花生品种的种皮总RNA。
1.3.2 DNA-PCR扩增
根据抗病基因产物的保守NBS结构域设计并合成以下引物:
正向Pf: GGACCTGGTGGGGTTGGGAAGACAAC;
反向Pr: CAACGCTAGTGGCAATCC。
DNA-PCR反应条件:30 μl反应体系包含10×buffer 3.0 μl,25 mmol/L MgCl2 2.0 μl,2.5 mmol/L dNTP 1 μl,(10 μmol/L)Pf 1 μl, (10 μmol/L)Pr 1 μl, 50 ng/L DNA模板1 μl。
反应程序:94℃预变性5 min;94℃变性55 s,45~60℃退火45 s,72℃延伸1 min,35个循环;72℃后延伸10 min,4℃保存。
1.3.3 RT-PCR扩增
引物同上。反应条件:使用TaKaRa公司的RT-PCR试剂盒,50 μl体系,10×One Step RT-PCR Buffer 5 μl,One Step Enhancer Solution 1 μl, dNTP Mixture (均10 mmol/L)2 μl,RNase Inhibitor (40 U/μl) 1 μl,PrimeScriptTM RTnase (for 1 step) 0.5 μl,TaKaRa Ex TaqTM HS(5 U/L)1 μl,上游引物(10 μmol/L)1 μl,下游引物(10 μmol/L)1 μl,Total RNA 1 μl。
反应程序:50℃ 30 min;94℃ 2 min,94℃ 30 s,55~65℃ 30 s,30 循环;72℃ 1 min。
1.3.4 PCR产物的克隆
使用1.2%琼脂糖凝胶电泳分离PCR产物,用BioFlux公司的凝胶回收试剂盒回收目的带,连接到pBS-T载体上,转化TOP10感受态细胞,蓝白斑筛选,挑取阳性单菌落(白斑)摇菌培养,用TIANGEN公司的质粒小量提取试剂盒提取质粒,用HindⅢ和EcoRⅠ进行酶切。
1.3.5 序列测定和分析
测序委托TIANGEN公司和三博远志公司完成。序列分析用BLAST和DNAMAN等软件,所用数据库为GenBank。
2 结果与分析
2.1 花生中NBS类抗病基因同源片段的分离
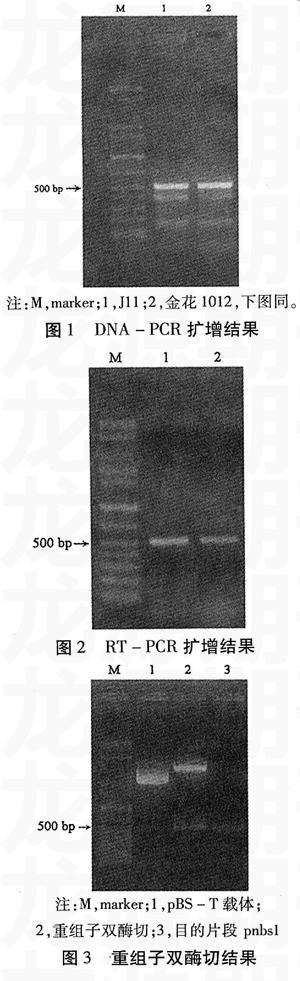
以抗黄曲霉病花生品种J11和感病品种金花1012的种皮基因组DNA为模板,经PCR扩增后在两材料上出现一条与预期大小相符的500 bp左右的条带(图1),以及2条分子量较小的条带。以两品种种皮RNA为模板,经RT-PCR扩增后在两材料上都仅得到一条500 bp左右条带(图2)。
含有目的带的重组子经HindⅢ和EcoRⅠ双酶切后出现两条带,分别为目的带和载体带(见图3)。

2.2 同源片段的核苷酸序列分析
从重组子中任意挑选5个测序。经测序发现,目的片段长504 bp,命名为pnbs1,GenBank登录号为GQ199610。经Nucleotide blast分析发现pnbs1核苷酸序列与野生种Arachis cardenasii C8V1G10F的抗性蛋白假基因的核苷酸序列的同源性为89%(图4),推测pnbs1可能是花生抗性基因的部分序列。
2.3 同源片段的氨基酸序列分析
Blastx分析发现pnbs1与抗性蛋白PLTR的氨基酸序列同源性为59%,在NBS保守区域和疏水结构域氨基酸序列基本相同(图5)。
2.4 同源片段的NBS保守区域分析
根据核苷酸序列推导的pnbs1氨基酸序列中含有抗病基因NBS区域的3个保守模体:磷酸结合环(p-loop)GPGGVGKTT,激酶2a KKFFIVLDDVW,激酶3a STILLTTR(图6)。同时将pnbs1的这3个保守区与大豆的SR1基因、烟草的N基因、亚麻的L6基因和拟南芥的Rps2的保守区进行比对分析,结果见表1。


3 讨论
黄曲霉毒素是黄曲霉菌(Aspergillus flavus)侵染花生等作物后产生的对人体有极强致癌作用的次生代谢物质,黄曲霉毒素污染一直是制约我国花生出口增长的重要因素。选育抗黄曲霉菌的花生品种是最经济有效的途径。花生种皮是抵抗黄曲霉侵染的天然屏障,种皮的完整性有利于提高黄曲霉抗性[25]。单世华等(2007)[26]利用基因芯片技术进行了抗、感黄曲霉菌差异基因表达分析研究,发现在种皮发育阶段抗、感花生种皮中存在大量的差异表达基因。
本研究根据已知抗性基因的保守区设计引物,从花生的种皮中获得了一条抗性基因片段pnbs1,经Nucleotide blast分析发现pnbs1核苷酸序列与Arachis cardenasii 的C8V1G10F核苷酸序列的同源性为89%。Blastx分析发现pnbs1与抗性蛋白PLTR的氨基酸序列同源性为59%,该抗性片段的氨基酸序列中含有已知抗病基因NBS区域的3个保守模体磷酸结合环(p-loop)、激酶2a和激酶3a,另外,C-末端还有疏水结构域。因此,推测pnbs1很可能就是花生的NBS类抗性基因的核心区域。

本试验利用设计的特异引物,从花生种皮的DNA和RNA中都获得了一条目的带,经测序后发现两条序列完全相同,证明pnbs1序列中没有内含子;该基因的核心片段在抗黄曲霉病花生品种和感病品种中完全相同。pnbs1核苷酸序列推导的氨基酸序列的3个保守区与大豆的SR1基因、烟草的N基因、亚麻的L6基因和拟南芥的Rps2的保守区比对分析,发现它们具有很大的同源性。推测,NBS类抗黄曲霉病基因可能是一类组成型表达的基因[27],以多基因家族的形式存在于染色体上[6],在抗病品种染色体上的拷贝数多于在感病品种上的拷贝数;或此基因可能是非抗黄曲霉病的NBS类抗性基因,这需要通过RACE技术获得全长序列后进行原核表达或转基因试验进一步验证。
参 考 文 献:
[1] 万书波. 山东省花生增效技术对策[J].山东农业科学,2008,4:113-116.
[2] 陈 高,闫彩霞,李春娟,等. 黄曲霉侵染前后花生过氧化酶与过氧化氢酶活性变化研究[J].山东农业科学,2009,3:12-14.
[3] 张佃文,张 娜,王 青,等.抗青枯病高产花生新品种日花1号的选育及栽培技术要点[J].山东农业科学,2008,9:103-104.
[4] 万书波,单世华,李春娟,等. 我国花生安全现状与对策[J].花生学报, 2005,34(1):1-4.
[5] 贺超英,张志永,陈受宜.大豆中NBS类抗病基因同源序列的分离与鉴定[J].科学通报,2001,46(12):10-17.
[6] 易图永,谢丙炎,张宝玺,等.植物抗病基因同源序列及其在抗病基因克隆与定位中的应用[J].生物技术通报,2002,2:16-20.
[7] 秦跟基,李万隆,陈佩度.植物抗病基因结构特征及其类似序列的研究进展[J].南京农业大学学报,1999,22(3):102-107.
[8] Jane E P, Mark J C, Veronique S, et al. The Arabidopsis downy mildew resistance gene RPP5 shares similarity to the Toll and interleukin-1 receptors with N and L6[J]. The Plant Cell, 1997,9:879-894.
[9] Satomi Y, Utako Y, Yuichi K, et al. Expression of Xa1, a bacterial blight-resistance gene in rice,induced by bacterial inoculation[J]. Proc. Natl. Acad. Sci. USA, 1998,95:1663-1668.
[10]Rainer B, Karin H, Ralph P, et al.The barley Mlo gene: a novel control element of plant pathogen resistance[J].Cell, 1997, 88(7):695-705.
[11]Mark S D, Kostas H, David A J, et al.The tomato cf-5 disease resistance gene and six homologs show pronounced allelic variation in leucine-rich repeat copy number[J].The Plant Cell, 1998,10:1915-1925.
[12]Gurmukh S J, Steven P B. Reductase activity encoded by the HM1 disease resistance gene in maize[J].Science, 1992, 258(6):985-987.
[13]LI Ai-li, KONG Xiu-ying, ZHOU Rong-hua, et al. Isolation and characterization of Mlo and NBS-LRR like gene sequences in wheat[J].Acta Botanica Sinica , 2003,45(4):472-478.
[14]Madsen L H, Colllins N C, Rakwalska M, et al. Barley disease resistance gene analogs of the NBS-LRR class: identification and mapping[J].Mol.Gen.Genomics, 2003, 269:150-161.
[15]Penuela S, Danesh D, Young N D. Targeted isolation, sequence analysis, and physical mapping of non TIR NBS-LRR genes in soybean[J].Theor.Appl.Genet.,2002,104:261-272.
[16]MO Ting-hui, Huang Jun-sheng, Du Zhong-jun, et al.Cloning and Characterization of one NBS-LRR like resistance gene analog from banana[J].Chinese Journal of Tropical Crops,2006,27(3):46-50.
[17]刘 毅,翟旭光,吴芳抗,等.禾谷孢囊线虫基因中核苷酸结合位点区(NBS)—亮氨酸重复序列区(LRR)的克隆与序列分析[J].应用与环境生物学报, 2006,12(6):745-749.
[18]邓洪新,杨晓娟,邓光兵,等.易变山羊草抗禾谷孢囊线虫基因中核苷酸结合位点区(NBS)的克隆与序列分析[J].中国生物化学与分子生物学报,2001,17(6):751-755.
[19]杨秀红,陈庆山,杨庆凯,等.大豆NBS类抗病相关基因的克隆与序列分析[J].高技术通讯,2005,15(2):71-78.
[20]陈观水,周以飞,林 生,等.甘薯NBS类抗病基因类似物的分离与序列分析[J].热带亚热带植物学报,2006,14(6):359-365.
[21]丁国华,秦智伟,刘宏宇,等.黄瓜NBS类抗病基因同源序列的克隆与分析[J].园艺学报,2005,32(4):638-642.
[22]Yuksel B, Estill J C, Schulze S R, et al. Organization and evolution of resistance gene analogs in peanut[J]. Mol. Gen. Genomics, 2005, 274:248-263.
[23]晏立英,廖伯寿,黄家权,等.花生NBS类抗病基因类似物的分离与序列分析[A].第五届全国花生学术研讨会论文集[C].2007,244-248.
[24]王关林,方宏筠.植物基因工程(第2版)[M]. 北京:科学出版社,2002,742-744.
[25]梁炫强,周桂元,潘瑞炽.花生种皮蜡质和角质层与黄曲霉侵染和产毒的关系[J].热带亚热带植物学报,2003,11(1):11-14.
[26]单世华,李春娟,严海燕,等.花生种皮抗黄曲霉差异基因表达分析[J].植物遗传资源学报,2007,8(1):26-29.
[27]Hammond-Kosack K E, Jones D A. Plant resistance gene[J].Annu. Rev. Plant Mol. Biol., 1997, 48:575.
