梅毒螺旋体与母胎界面细胞相互作用影响妊娠结局的机制研究进展*
2024-03-07黄少彬刘兆平张晓红赵飞骏
黄少彬, 熊 顺, 刘兆平, 张晓红, 赵飞骏,2△
(1南华大学衡阳医学院病原生物学研究所/特殊病原体防控湖南省重点实验室,湖南 衡阳 421001;2南华大学附属第一医院检验医学中心/感染性疾病研究所,湖南 衡阳 421001)
梅毒是由梅毒螺旋体(Treponema pallidum, Tp)感染引起的一种慢性、性传播疾病[1]。近十年来,梅毒在世界范围内流行,特别是在非洲、东南亚、西欧、俄罗斯和中国,并在这些地区造成了严重的公共卫生问题[2-3]。梅毒发病率逐年上升,先天性梅毒(congenital syphilis, CS)发生率也一直处于较高水平[4-5]。CS是由Tp经胎盘垂直传播感染胎儿的一种先天感染性疾病,可发生于妊娠任何阶段,并可引起早产、死产、新生儿皮肤病变、骨骼和中枢神经系统异常等多种不良妊娠结局[1]。正常情况下,母体免疫环境受到母胎界面细胞和免疫因子的调节以保持促炎/抗炎动态平衡,建立母体对胎儿的免疫耐受。然而,严重细菌感染可诱导母体过度炎症,导致免疫耐受稳态失衡[6]。早期梅毒患者体内以促炎免疫反应为主[7],Tp也被证实可致多种免疫细胞功能紊乱和细胞因子表达异常[8-11],破坏免疫耐受稳态。基于国内外学者对CS和母胎界面免疫学的认识,本文从CS发病特点、临床表现和母胎免疫反应的角度出发,阐述Tp如何与母胎界面细胞群相互作用并导致不良妊娠结局的潜在机制。
1 CS发病特点与临床表现
CS主要由Tp经胎盘传播引起,较少情况下由胎儿在分娩期间接触母体皮肤病变所致。所有未经治疗或治疗不当的梅毒孕妇所怀胎儿或所生婴儿,无论是否有梅毒症状,均视为CS病例[12]。CS可发生在妊娠任何阶段,但随着妊娠的进展,CS感染风险会越来越高[1],由CS导致的不良妊娠结局发生率约为66.5%,且多集中在妊娠早期和中期[13-14]。此外,CS发生率亦取决于孕妇的梅毒病程,一期、二期或早期梅毒孕妇后代CS发生率约40%~90%,而晚期梅毒孕妇后代CS发生率低于10%,即梅毒在母体患病的早期阶段,其传给胎儿的风险较高,而随着梅毒进展至晚期,传给胎儿的风险相对较低[1]。根据确诊时间将CS分为早期CS和晚期CS,如表1[15-18]所示。早期CS症状与成人梅毒相似,出现在2岁之前,但超过半数(60%~90%)患儿出生时无症状,直至第3个月时才首次出现临床症状,且非特异性临床表现复杂多变,加上缺乏敏感、特异和简便的诊断方法,使得早期CS漏诊率较高[1]。早期CS的常见症状包括水疱、皮疹、患儿发育迟缓、肝大、全身性淋巴结肿大、发烧、神经系统障碍和骨质损害。晚期CS的症状则出现在2岁以后,主要是由早期CS引起的持续炎症所致,晚期CS可导致多种后遗症,主要累及中枢神经系统、骨骼、关节、牙齿、眼睛和皮肤[15-18]。

表1 先天性梅毒的分期及临床症状Table 1.Stages and clinical symptoms of congenital syphilis (CS)
2 Tp感染介导不良妊娠结局的机制
2.1 Tp穿过胎盘屏障导致CS 母胎界面主要由母源性蜕膜和胎源性胎盘构成,胎盘主要由合体滋养层细胞(syncytiotrophoblasts, STBs)、细胞滋养层细胞(cytotrophoblasts, CTBs)和绒毛外滋养层细胞(extravillous trophoblasts, EVTs)构成,这3种细胞共同形成胎盘绒毛结构,也是分隔母体和胎儿的主要屏障[19]。有研究证实,Tp可黏附定植于胎盘,并能在动物/人胎盘组织及羊水中检测到Tp[20-21];Fitzgerald等[22]通过体外实验证实活Tp能破坏并穿过完整羊膜。以上研究提示Tp可以通过侵犯胎盘、胎膜、生殖道(图1[19,23])等方式穿过胎盘屏障。此外,Tp感染介导的胎盘炎症和损伤可引发母体过度免疫和炎症,最终导致不良妊娠结局。梅毒孕妇胎盘外观苍白、肿大和积水,镜下绒毛血管周围分布大量细胞坏死碎片,胎盘血管腔内见大量胎儿单核细胞,绒毛增生伴多形核细胞、淋巴细胞、单核细胞和霍夫鲍尔细胞(Hofbauer cells, HBCs)浸润,有慢性绒毛炎迹象[16]。另外,妊娠期梅毒引发的高达50%胎儿死亡可能归因于胎盘本身的炎症反应,使用抗生素治疗妊娠期梅毒导致炎症反应的增强也与早产和胎盘功能不全有关[23]。
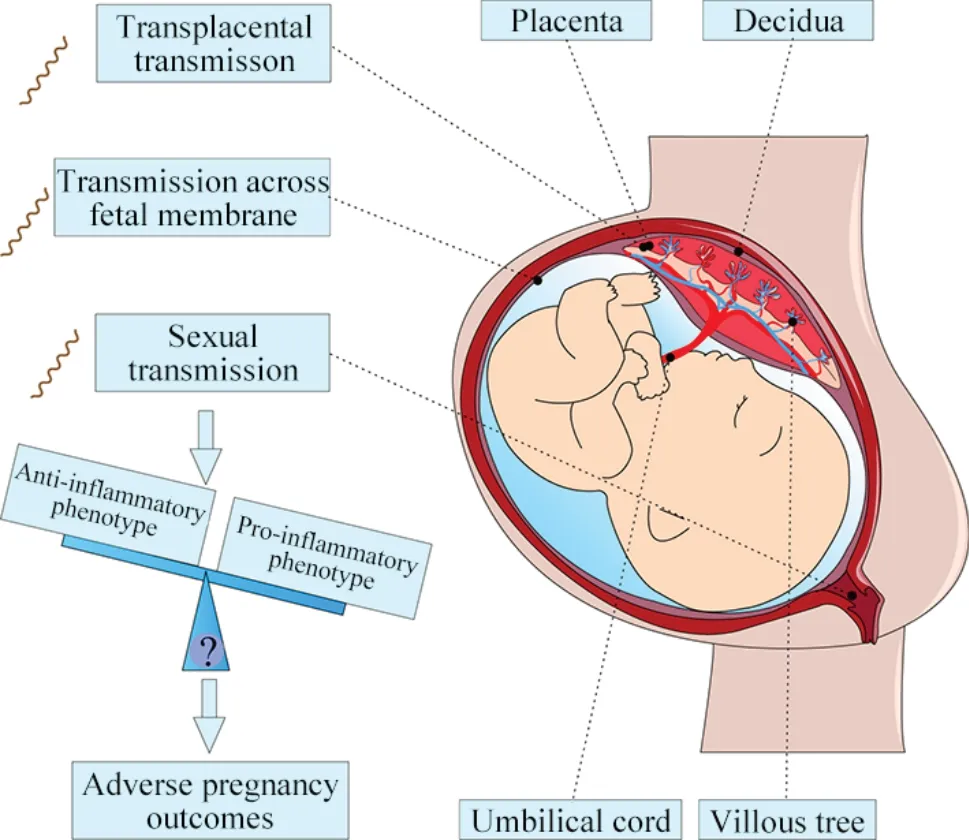
Figure 1.Vertical transmission of Treponema pallidum (Tp) infecting the fetus and leading to adverse pregnancy outcomes.The Tp may infect the fetus through various mechanisms, including direct translocation across the placenta or amniotic membranes, as well as through sexual contact.Additionally, Tp can cause placental inflammation and injury, which can trigger maternal hyper-immunity and inflammation.This disruption of maternal immune tolerance to the fetus can ultimately leading to adverse pregnancy outcomes.图1 梅毒螺旋体垂直传播感染胎儿并导致不良妊娠结局
2.2 Tp感染影响母胎界面细胞群功能和组成的动态变化 母胎界面细胞群和细胞因子的组成处于动态变化之中,以维持不同妊娠时期抗炎与促炎的动态平衡。妊娠早期,母体会建立促炎免疫环境,表现为蜕膜免疫细胞聚集和促炎因子积累,有利于胚胎植入和胎盘形成[6]。妊娠中期,母体依赖母胎界面Th2细胞、蜕膜巨噬细胞(decidual macrophages,DM)、蜕膜自然杀伤(natural killer, NK)细胞、Treg细胞和滋养层细胞的调控建立抗炎环免疫境,以促进胎儿耐受和正常生长[6]。相反,Tp已被证实可致多种免疫细胞功能紊乱和细胞因子表达异常[8-11],破坏免疫耐受稳态,这可能导致不良妊娠结局。其机制总结为6个方面,如图2所示。

Figure 2.Disruption of maternal immune homeostasis by Treponema pallidum (Tp).The Tp may lead to dysfunction of immune cells at the maternal-fetal interface and trophoblasts, as well as abnormal expression of pro-inflammatory cytokines, shifting the maternal immune environment towards a pro-inflammatory state.The involved mechanisms include inducing overactivation of maternal Th1 immune responses, inhibiting decidual NK cell activity, stimulating the differentiation of decidual macrophages and Hofbauer cells into M1 type, disrupting the dynamic balance of Th17/Treg in peripheral blood and the decidua,and causing functional abnormalities in trophoblasts.图2 梅毒螺旋体感染介导母胎界面抗炎稳态失衡
2.2.1 Tp感染破坏Th1/Th2动态平衡 母胎免疫耐受是一种Th1/Th2动态平衡下Th2免疫占主导的现象,而感染导致的妊娠丢失则是Th1/Th2细胞失衡[24]。早期梅毒患者体内以Th1型免疫反应占主导,其血清中可检测到大量促炎因子如白细胞介素2(interleukin-2, IL-2)、IL-12、干扰素γ(interferon-γ,IFN-γ)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)[7,25];研究表明,导致母胎排斥反应的Th1型细胞因子,如IFN-γ和TNF-α会对妊娠造成威胁。另一方面,Th2型细胞因子,如IL-4、IL-5和IL-10则可以抑制Th1反应,增强母体对胎儿的耐受[26]。因此,早期梅毒感染引起的Th1型免疫反应可能打破妊娠中期建立的抗炎稳态,免疫系统的过度激活可介导胎盘屏障的损伤并导致不良妊娠结局,这也可以解释为何一期和二期梅毒孕妇的胎儿CS发生率高于晚期梅毒孕妇。
2.2.2 Tp抑制蜕膜NK细胞活性 蜕膜NK细胞约占母胎界面免疫细胞的70%,蜕膜NK细胞数量减少、激活状态和表型的改变都会导致不良妊娠结局[27]。研究表明,梅毒孕妇外周血NK细胞数量低于正常人[28-29]。Jensen等[8]观察到梅毒患者血清中存在一种免疫抑制因子,可抑制NK细胞活性。Cruz等[30]观察到大多数二期梅毒患者外周血IFN-γ(CD56bright)和细胞毒性(CD56dimCD16bright)NK细胞亚群减少,并且明显出现另一高度非典型(CD56negtiveCD16bright)NK细胞群,这与Mavilio等[31]在未经治疗的HIV患者中观察到的(CD56negtiveCD16bright)NK细胞增加情况类似,NK细胞这一亚群不仅细胞毒性低,且产生IFN-γ和其他细胞因子的能力受损,提示Tp可以抑制NK细胞的增殖和激活。尽管外周血NK细胞与蜕膜NK细胞具有不同转录谱,但主流观点认为蜕膜NK细胞很大可能是由外周NK细胞分化而来[32],外周血NK细胞活性受到抑制,很大程度也会影响蜕膜NK细胞的数目和活性。
2.2.3 Tp影响DM极化 维持正常妊娠的DM主要是M2型,DM向M1型极化产生的促炎环境则易引发妊娠丢失[33]。研究表明,Tp可诱导单核细胞向M1巨噬细胞极化,同时通过Toll样受体2(Toll-like receptors 2, TLR2)和核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)刺激巨噬细胞产生大量促炎因子,包括IL-1β、IL-6、TNF-α和IL-12[9,34],但Tp能否直接诱导M2型DM极化为M1型尚不得知。Tp菌体蛋白在引发促炎反应中也发挥了重要作用。Tp外膜蛋白Tp92能通过识别单核巨噬细胞表面CD14/TLR2诱导IL-8的分泌,同时该蛋白通过胱天蛋白酶1前体蛋白(pro-caspase-1)和受体相互作用蛋白激酶1(receptor-interacting protein kinase 1, RIPK1)/caspase-8/caspase-3途径诱导人单核细胞发生焦亡和凋亡,降低固有免疫应答系统清除Tp的能力[35-36]。TpF1可诱导巨噬细胞活化,促进IL-1β释放[37]。Tp0768可刺激巨噬细胞分泌IL-1β、IL-6和IL-8[38]。Tp0136可通过蛋白酶激活受体1(protease-activated receptor 1, PAR1)促进血小板活化和聚集,并增加血小板中P选择素的表达[39]。免疫细胞中,单核细胞与血小板释放的P-选择素亲和力最高,血小板-单核细胞聚集体的形成可促进单核细胞释放促炎细胞因子,包括TNF-α、IL-1β、IL-6、IL-12和IL-8[40],人胎盘组织免疫染色显示,母体螺旋动脉中的血小板附着于血管壁和侵袭至血管壁的EVTs表面[41],提示Tp可能通过介导母体血管中的血小板活化和聚集促进胎盘单核细胞浸润。此外,Tp一些脂蛋白可诱导小鼠巨噬细胞合成TNF-α,具有激活和诱导细胞凋亡的潜能。细胞凋亡与机体对病原体的免疫应答有关,包括一些导致先天性感染的病原体[13],但完整的机制仍有争议,就目前研究表明,与CS有关的细胞凋亡还没有被探索过。
2.2.4 Tp破坏Th17/Treg动态平衡 母体外周血和蜕膜Th17/Treg的平衡同样对正常妊娠的维持至关重要[42]。研究表明,梅毒孕妇和普通梅毒患者外周血Th17细胞数量与IL-17水平显著增加[10-11]。早期梅毒患者体内可检测到持续高水平的IL-6[7];Bettelli等[43]发现,IL-6可与转化生长因子β1(transforming growth factor-β1, TGF-β1)结合,并诱导原始T细胞分化为Th17细胞,同时抑制TGF-β1诱导的Treg细胞分化,IL-6水平升高破坏Th17/Treg平衡,从而导致Th17细胞的增加。另有研究显示,梅毒孕妇外周血Treg细胞水平低于正常孕妇,并可以此作为妊娠期梅毒的标志性参考指标[11],同样,神经梅毒患者中枢神经系统的损伤也与局部Treg细胞减少导致宿主免疫反应失控有关[44]。鉴于Treg细胞在调节免疫介导的组织损伤中的重要作用,Tp可能通过破坏母体循环或母胎界面Th17/Treg平衡,导致母胎界面由抗炎状态转化为促炎状态,破坏免疫耐受。
2.2.5 Tp与滋养层细胞相互作用的潜在机制 妊娠期间I型IFN水平升高与宫内生长迟缓、早产和胎儿死亡有关。梅毒患者血细胞受到Tp抗原刺激后,其培养物上清可检测到高水平的IFN-α、IFN-β和IFN-γ,梅毒患者血清同样也有较高水平的IFN[7]。Buchrieser等[45]证实,妊娠期间病原体感染诱导的I型IFN可激活胎盘干扰素诱导跨膜蛋白1(IFN-induced transmembrane protein 1, IFITM1)、IFITM2和IFITM3,抑制合胞素介导的STBs融合,导致胎盘形成受阻和功能低下。除了IFN的升高,滋养层细胞的迁移和侵袭受到抑制同样可导致妊娠丢失等不良妊娠结局[46-47]。研究表明,早期梅毒患者血浆外泌体miR-146a-5p表达上调;同时,巨噬细胞在受到Tp刺激后,miR-146a-5p也是上调较为显著的外泌体miRNA之一[48],而M1型巨噬细胞来源的外泌体miR-146a-5p已被证实可靶向TNF受体相关因子6(TNF receptor-associated factor 6, TRAF6)抑制滋养层细胞的迁移和侵袭,这提示Tp感染期间外泌体miR-146a-5p水平的升高是导致不良妊娠结局的重要因素[47]。
2.2.6 Tp与HBCs相互作用诱导胎盘损伤 不同于DM,HBCs是胎儿来源的巨噬细胞,也是胎盘唯一的胎儿免疫细胞,具有M2型巨噬细胞的免疫调节表型,对维持胎盘抗炎稳态至关重要[49]。CS胎盘可表现为急性绒毛炎,但更多表现为慢性绒毛炎,这是一种破坏性的绒毛膜炎症病变,主要由母体对胎儿产生免疫反应引起,特征为大量HBCs增生及浸润,强烈的炎症反应可导致早产或流产[16,49]。绒毛炎过程中,HBCs释放C-X-C基序趋化因子配体9(C-X-C motif chemokine ligand 9, CXCL9)、CXCL10、CXCL11和CXCL13增加,同时与浸润的母体免疫细胞相互作用,导致局部或全身炎症,产生类似移植物抗宿主反应,这种情况下,HBCs被认为是造成胎盘损伤的原因之一[50]。绒毛炎的发生也存在于其他垂直传播病原体的感染,包括弓形虫、单核细胞增生性李斯特菌、风疹病毒和巨细胞病毒[51]。单核细胞增生性李斯特菌可感染HBCs并导致HBCs发生促炎重编程,感染的HBCs表达促炎因子,促进胎盘白细胞浸润[52]。Rosenberg等[51]在增殖的HBCs中检测到寨卡病毒的存在,但寨卡病毒感染并不会引起胎盘坏死或绒毛炎,表明HBCs可能充当了传播媒介。尽管Tp一直以来都被认为是一种胞外菌,但各种实验表明Tp入侵宿主时有过短暂的细胞内状态,表明Tp可能主动进入细胞并“躲藏”于细胞内,并助受感染的母体免疫细胞跨过胎盘屏障将Tp传递给胎儿[53]。因此,Tp介导的HBCs增生浸润及胎盘绒毛炎,可能在一定程度上促进了Tp垂直传播,最终导致不良妊娠结局。
3 小结与展望
CS作为一种严重的梅毒并发症,一直是临床面临的挑战,梅毒孕妇治疗不及时可导致不良妊娠结局。基于目前国内外研究者对CS和母胎界面免疫调控的认识,CS的发病机制很大可能与母胎界面抗炎稳态失衡有关。Tp介导的促炎免疫反应的过度激活和母胎界面细胞功能的改变,均可能是引发不良妊娠结局的原因。由于Tp新陈代谢的特殊性[54]、Tp体外培养和基因编辑技术尚不成熟,以及缺少合适的能够重现母胎免疫细胞串扰的体外模型,Tp与母胎界面细胞群相互作用的具体机制仍不清楚,这是未能控制CS的重要原因[55]。因此,未来研究的重心应当阐明Tp、母体和胎儿之间的免疫调控机制,建立合适的体外胎盘模型。希望将来能攻破这一难题,明确Tp与母胎界面细胞互作机制可能会对之前未知的宿主防御方式提供新见解,并为CS诊断、治疗和预后评估提供参考。
